羊奶作为世界上一类重要的奶源,具有较高的营养价值和医学价值,在全球范围内被越来越多地消费[1]。因为羊奶中的蛋白质具有更小的免疫原性、更高的消化能力以及更接近人乳的比例,被认为是牛乳过敏者最好的替代乳[1~4]。
目前国内关于羊乳蛋白的研究主要方向是通过研究羊乳蛋白成分、蛋白质稳定性以研究羊乳的加工过程和营养价值[5, 6]。但因为乳制品体系复杂多变,对于羊奶粉质量控制研究仍比较少,而乳源的纯正对于羊乳的营养需求、医用要求以及加工方法的选择都格外重要。乳蛋白作为乳中的重要成分,其种类、数量和结构等随着乳源的不同而有所差异。因此,乳蛋白质作为乳中的特征性成分能够较好地反映乳的质量信息[7]。通过对乳中总蛋白、酪蛋白和乳清蛋白质的种类、含量和相对比例等多指标的分析检测,评价乳品质量。因而,通过羊乳蛋白的合理分析和评价,来综合和完整地反映羊乳的乳源和质量信息具有重要的意义[8~12]。
羊乳中存在六种主要的蛋白质,包括αs1-酪蛋白(αs1-CN)、αs2-酪蛋白(αs2-CN)、β-酪蛋白(β-CN)、κ-酪蛋白(κ-CN)四种酪蛋白,以及α-乳白蛋白(α-La)、β-乳球蛋白(β-Lg)两种乳清蛋白,同样,该六种主要蛋白质也存在于牛乳中[4]。文献报道,RP-HPLC能够实现乳中的各种蛋白质组分乃至遗传变体的分离[13];并且,在不同物种的乳蛋白分析和乳蛋白质遗传变体分析中有广泛的应用[13~24]。现阶段羊乳蛋白遗传变体的分析较多,而国内羊乳企业的发展需要一种快速准确的质量评价方法。本文通过RP-HPLC分析羊乳蛋白,从而进行羊乳大规模的质量分析。
指纹图谱技术是指样品经适当处理后,采用一定的分析手段,得到能够标示其化学特征的谱图。在特定样品分析中除了对已知物质的定量测定,指纹图谱技术还能够表示样品的整体信息,准确地反映样品的全貌,因而能得到乳品的整体质量特征[12, 25]。这方面中药注射剂的指纹图谱有较好的研究,并出台了相应的规定,譬如产品的相似度,成品指纹图谱相似度的计算值在0.9~1.0才符合要求。对于相似度小于0.9,但直观又难以否定的产品,需进一步采用模式识别方法检查原因。
考虑到发展羊乳品的重要性,同时尚没有很好的质量标准,因此,本文将用RP-HPLC技术分析乳中的蛋白质组分,建立羊乳的指纹图谱方法,并结合化学计量法完成对羊乳品的定性检测和乳源的分析,为乳品质量的监控提供技术保障。
2 材料和方法 2.1 试剂与样品乙腈为色谱纯试剂,三氟乙酸(TFA)、BisTris、盐酸胍、二硫苏糖醇(DTT)、柠檬酸钠均为分析纯。超纯水由Purelab Classic超纯水仪制备。
五种牛乳蛋白标准品κ-CN (lot C0406,≥ 70%,PAGE),α-CN (lot C6780,≥ 70% αs-casein,Electrophoresis),β-CN (lot C6905,≥ 98%,PAGE),α-La (lot L6010,Type Ⅲ,≥ 85%,PAGE),β-LgB (lot L8005,≥ 90%,PAGE)均购自美国Sigma-Aldrich公司。配制五种牛乳蛋白标准品混合物,将其简写为B-sta。
九种不同来源的羊奶粉均为贝因美公司惠赠,分别为陕西美力源一阶段婴儿配方绵羊奶粉(蛋白标签值12 g·(100 g)-1)、一阶段婴儿配方山羊奶粉、贝因美配方全脂山羊奶粉(陕西)、贝因美配方全脂山羊奶粉(CBM)、贝因美配方脱脂山羊奶粉(CBM)、美力源全脂原料山羊奶(放养)、新西兰全脂绵羊奶粉、玉山全脂山羊奶粉、玉山全脂原料山羊奶,将其依次简写为S-1、G-2、G-3、G-4、G-5、G-6、S-7、G-8、G-9。
2.2 仪器设备日本岛津HPLC LC-10A设备系统:配备SCL-10AVP系统控制器、Mixer SUS 10A混合器、SPD-10AVP紫外检测器、2个LC-10ADVP恒流泵、LCsolution中文工作站、HT-330柱温箱、7725i-049手动进样器(美国Rheodyne)、20 μL定量环。
色谱柱ZORBAX 300SB-C8 (250 mm×4.6 mm,5 μm,300 Ǻ):美国安捷伦。
Scientific Sorvall Legend Micro 17R微量高速离心机:美国Thermo;KQ5200E超声波清洗器:昆山市超声仪器有限公司;Purelab Classic超纯水仪:英国ELGA;一次性针管注射器;0.22 μm滤膜。
2.3 实验方法 2.3.1 RP-HPLC分析乳样品中的蛋白质 2.3.1.1 乳蛋白样品制备样品预处理:准确称量30 mg奶粉,去离子水定容至1 mL,溶解充分后取400 μL溶液加入等体积的工作液Ⅰ (0.1 mol·L-1 BisTris,6 mol·L-1盐酸胍,5.37 mmol·L-1柠檬酸钠,19.5 mmol·L-1 DTT),将混合溶液涡旋振荡10 s混匀,室温静置1 h。将混合溶液置于16000 g 4℃离心5 min,用药匙除去表层乳脂。取底层溶液300 μL于新的离心管中,加入3倍体积的工作液Ⅱ (0.1% TFA水溶液,内含4.5 mol·L-1盐酸胍)混匀,用0.22 μm滤膜过滤待测[23, 24]。
标准品预处理:准确称量牛乳蛋白标准品,用去离子水溶解,分别配制标准品浓度为:κ-CN 1mg·mL-1,α-CN 2 mg·mL-1,β-CN 2 mg·mL-1,α-La 1 mg·mL-1,β-LgB 1 mg·mL-1。将配好的标准品等体积混合,配制成混合标样溶液,之后操作步骤同样品预处理。
2.3.1.2 乳蛋白样品RP-HPLC色谱条件色谱柱:ZORBAX 300SB-C8;检测波长:214 nm;柱温45℃;流量:0.7 mL·min-1;进样量:100 μL;洗脱时间:45 min。梯度洗脱流动相:流动相A为0.1% TFA水溶液,流动相B为0.1%TFA乙腈溶液,经过抽滤、超声脱气后上机使用。梯度洗脱程序如下:33% ~ 35% B 5 min (0.4% B·min-1),35% ~ 37% B 4 min (0.5% B·min-1),37% ~ 40% B 9min (0.33% B·min-1),40% ~ 41% B 4 min (0.25% B·min-1),41% B保持5.5 min,41% ~ 43% B 0.5 min (4% B·min-1),43% ~ 45% B 8 min (0.25% B·min-1),45% ~ 33% B 1 min (12% B·min-1),33% B保持8 min[21]。
2.3.2 羊乳蛋白色谱指纹图谱技术的建立 2.3.2.1 羊乳蛋白指纹图谱分析分别取9批不同来源羊奶粉样品,按2.3.1.1节方法制备羊乳蛋白供试液。采用2.3.1.2节所述色谱条件进行乳蛋白RP-HPLC分析,随后进行谱图积分获得保留时间、峰面积等信息,记录色谱图。将乳蛋白HPLC色谱图从色谱工作站导出AIA数据文件,导入中药色谱指纹图谱相似度评价系统软件,建立不同羊奶的指纹图谱,进行相似度和差异性评价。
2.3.2.2 羊乳样品主成分分析分别取9批不同来源羊奶粉样品,按2.3.1.1节方法制备羊乳蛋白供试液。采用2.3.1.2节所述色谱条件进行乳蛋白RP-HPLC分析,然后进行谱图积分获得保留时间、峰面积等信息,分别以各样品的峰面积,通过SPSS作主成分分析。
3 结果与讨论 3.1 乳样品蛋白质RP-HPLC图 1显示了5种牛乳蛋白标准物质在RP-HPLC中的分离,其中κ-CN保留时间在5~16 min,α-CN保留时间在17~27 min,β-CN保留时间在27~35 min,α-La保留时间在35~37 min,β-LgB保留时间在37~38 min。
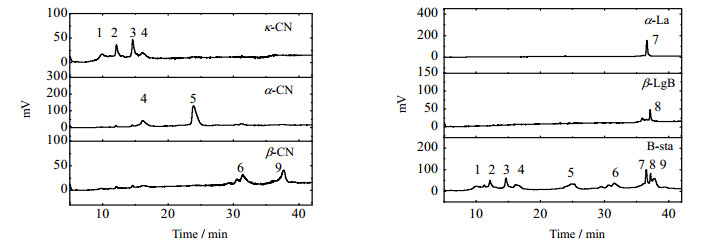
|
图 1 牛乳蛋白标准品RP-HPLC Fig.1 RP-HPLC spectra of bovine milk protein references |
图 2显示了9批不同来源的羊乳样品蛋白质在RP-HPLC中的分离,将9批羊乳蛋白与图 1进行比对,5~16 min为κ-CN,17~27 min为α-CN,27~35 min为β-CN,35~37 min为α-La,37~38 min为β-LgB。
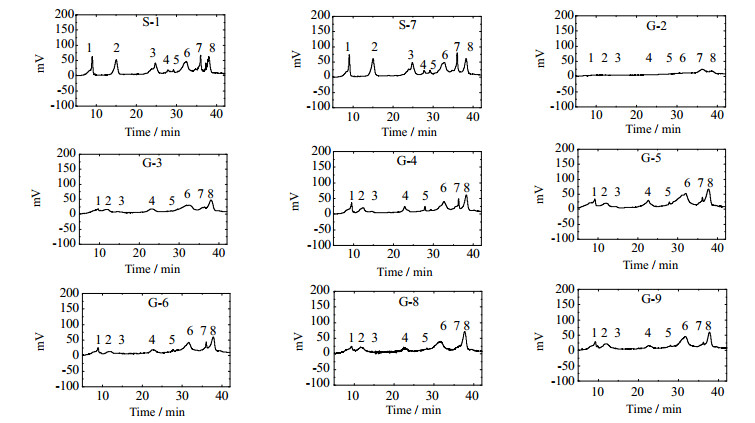
|
图 2 RP-HPLC分离羊奶粉蛋白质 Fig.2 RP-HPLC spectra of goat milk proteins |
在S-1和S-7两种绵羊乳样品中,5~16 min中检测到两种κ-CN,峰1、2;17~27 min检测到一种α-CN,峰3;27~35 min检测到三种β-CN,峰4、5、6;35~37 min检测到一种α-La,峰7;37~38 min一种β-Lg,峰8。
在G-3、G-4、G-5、G-6、G-8、G-9六种山羊乳样品中,5~16 min检测到3种κ-CN,峰1、2、3;17~27 min检测到一种α-CN,峰4;27~35 min检测到2种β-CN,峰5、6;35~37 min检测到一种α-La,峰7;37~38 min检测到一种β-Lg,峰8。在G-3中的α-La峰和其他样品峰相比较小;在G-8、G-9中κ-CN峰3和其他样品峰相比也较低。
在G-2山羊奶粉中检测到极低的κ和α酪蛋白(峰1、2、3、4),β酪蛋白和α-La、β-Lg蛋白峰值(峰5、6、7、8)也较小。
对乳蛋白RP-HPLC进行了方法验证。连续对6份相同浓度样品的乳蛋白进行了RP-HPLC重复性分析,结果表明S-7绵羊奶粉样品峰保留时间的相对标准偏差(RSD%)在0.18%~1.40%,峰面积相对标准偏差(RSD%)在2.58%~15.92%;G-4山羊奶粉样品峰保留时间的相对标准偏差(RSD%)在0.27%~1.64%,峰面积相对标准偏差(RSD%)在1.57%~32.57%。
3.2 乳蛋白指纹图谱 3.2.1 羊乳蛋白指纹图谱分析在本实验建立的RP-HPLC分析条件下,将7批不同山羊奶粉蛋白质供试品测定结果,导入中药色谱指纹图谱相似度评价系统,生成山羊乳蛋白指纹图谱对照。分别以山羊乳蛋白指纹图谱对照和9批不同来源的羊奶样品蛋白质RP-HPLC测定结果为模板,采用国家药典委员会中药色谱指纹图谱相似度评价系统,生成羊奶蛋白质指纹图谱,结果见图 3。并对所得的羊奶蛋白质指纹图谱进行相似度计算,分别计算各样品间的相似度,结果见表 1。
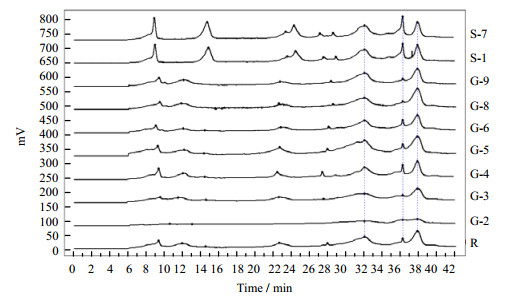
|
图 3 羊乳蛋白指纹图谱。 Fig.3 Fingerprint of goat milk proteins R为山羊乳蛋白对照图谱 R is the caprine milk protein reference |
| 表 1 羊乳蛋白相似度匹配结果 Table 1 Similarity of goat milk proteins |
从表 1中可以看出:以生成的山羊乳蛋白对照图谱作为模板,G-3、G-4、G-5、G-6、G-8、G-9山羊奶粉样品相似度较高,都在0.977~0.993;而G-2山羊奶粉相似度为0.803;S-1、S-7绵羊奶粉相似度是0.784和0.747。同样以绵羊样品作为模板,所有检测的绵羊样品相似度在0.996,所有山羊样品的相似度在0.706~0.822。因此,G-3、G-4、G-5、G-6、G-8、G-9山羊奶粉样品具有较好的相关性,由于G-2山羊奶粉样品测试前即被告知可能存在质量问题,因此G-2山羊奶粉与其他批山羊奶粉相关性较差,S-1、S-7绵羊奶粉与所有山羊奶粉的相关性都较差。说明本方法对奶粉的质量和物种来源鉴别有极强的参考价值。
3.2.2 羊乳样品主成分分析(principal component analysis,PCA)在本实验建立的分析条件下,将9批不同羊乳供试品,分别以各样品的峰面积数据,标准化后通过SPSS作主成分分析,选取前两个主成分绘制主成分图。
经SPSS主成分分析,得到各个样本在两个主成分上的得分值。以主成分1为X轴,主成分2为Y轴,将9个样本点分别标入坐标系中,得到图 4,反映样本在两个主成分上的得分。
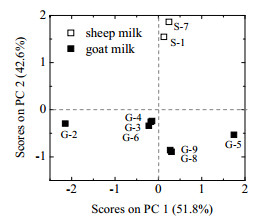
|
图 4 羊奶的 PCA 得分图 Fig.4 PCA scores of different goat milk |
图 4显示了9个样品的分类情况,从图中各点的分布来看,S-1、S-7绵羊乳蛋白,主要集中在PC2 > 0的区域。G-2、G-3、G-4、G-5、G-6、G-8、G-9山羊乳蛋白,主要集中在PC2 < 0的区域;其中,G-2在-2.5 < PC1 < -1,-1 < PC2 < 0的区域;G-3、G-4、G-6主要集中在-1 < PC1 < 0,-1 < PC2 < 0的区域;G-8、G-9主要集中在0 < PC1 < 1,-1 < PC2 < 0的区域;G-5在1 < PC1 < 2,-1 < PC2 < 0的区域。从图中各点的分布来看,绵羊乳和山羊乳得到很好的区分。在山羊乳大类中,G-3、G-4、G-6产地来源为陕西、CBM;G-8、G-9产地来源为玉山,各个样品点之间具有一定的分散,说明不同来源的各个乳样品具有差异性,可以作为不同产地和来源的乳样品判别。
从分类结果可以看出:即使样品所有的成分相同,但不是一种乳,也可以有效地区分。
4 结论研究建立了羊乳蛋白RP-HPLC指纹图谱。通过羊乳蛋白质指纹图谱分析,两批绵羊乳样品间相似度较高;在不同来源的山羊乳样品中,六批山羊乳的相似度较高,同时也检测出相似度较低的G-2山羊乳样品。通过羊乳蛋白主成分分析,由PCA得分图,看出绵羊、山羊不同哺乳动物来源的乳样品能够清晰地归到不同大类;在同一大类中,不同来源羊乳样品各个样品点之间具有一定的分散,说明不同来源的羊乳样品具有差异性。结果表明,羊乳蛋白质作为羊乳中的特征性成分较好地反映了乳源的品类和质量信息。本文所建立的方法对企业建立特定羊乳乳源的指纹图谱、对乳品上下游加工的质量控制以及乳成品的质量监测等提供了有效的方法。
| [1] | Park Y W, Juárez M, Ramos M, et al. Physico-chemical characteristics of goat and sheep milk[J]. Small Ruminant Research , 2007, 68(1-2): 88-113. DOI:10.1016/j.smallrumres.2006.09.013. |
| [2] | Costa W K A D, de Souza E L, O-Filho E M B, et al. Comparative protein composition analysis of goat milk produced by the alpine and saanen breeds in northeastern brazil and related antibacterial activities[J]. Plos One , 2014, 9(3): e93361. DOI:10.1371/journal.pone.0093361. |
| [3] | Wang Y, Zheng Y, Jiang M, et al. Comparison of the biochemical components and characteristic of milk between Tibetan sheep and goat in neighboring area[J]. African Journal of Biotechnology , 2011, 10(11): 2092-2100. |
| [4] | Park Y W, Haenlein G F W. Handbook of milk of non-bovine mammals[M].Ames: Blackwell Publishing, 2006: 275-296. |
| [5] | SONG Hong-xin(宋宏新), ZHANG Xiao-miao(张小苗), XUE Hai-yan(薛海燕). The comparative studies of proteins of bovine and goat milk(牛羊乳蛋白组分比较研究)[J]. China Brewing(中国酿造) , 2012, 31(2): 21-23. |
| [6] | SHI Yong-cui(史永翠), LIU Chang(刘畅), XU Xiao-dan(许晓丹), et al. Research progress on the stability of goat milk and products(羊奶及其制品稳定性的研究进展)[J]. Journal of Dairy Science and Technology(乳业科学与技术) , 2013, 36(3): 16-19. |
| [7] | SONG Hong-xin(宋宏新), BO Hong-mei(柏红梅), XUE Hai-yan(薛海燕), et al. Analytical technology of dairy products' quality based on milk protein(基于乳源蛋白质分析的乳品质量检测技术探讨)[J]. Science and Technology of Food Industry(食品工业科技) , 2008, 29(9): 298-301. |
| [8] | Barłowska J, Szwajkowska M, Litwińczuk Z, et al. Nutritional value and technological suitability of milk from various animal species used for dairy production[J]. Comprehensive Reviews in Food Science and Food Safety , 2011, 10(6): 291-302. DOI:10.1111/crf3.2011.10.issue-6. |
| [9] | WANG Ju(汪菊), FU Da-you(付大友), XU Chen-xi(徐晨曦). Study on determination method of protein in milk powder(奶粉中蛋白质检测方法的研究)[J]. Food Engineering(食品工程) , 2014(2): 15-18. |
| [10] | 食品安全国家标准食品中蛋白质的测定: 北京: 中国标准出版社, 2010. National food safety standard determination of protein in foods : GB 5009. 5-2010[S]. Beijing : China Standards Press, 2010. |
| [11] | FAN Ping(樊萍), ZHANG Ren-ming(张人明), HE Wu-ming(贺武明), et al. Application of fingerprint technology in dairy production quality control(指纹图谱技术在乳制品质量控制中的应用)[J]. Science and Technology of Food Industry(食品工业科技) , 2012, 33(13): 417-419. |
| [12] | WANG Ling-ling(王玲玲), DONG Wen-bin(董文宾), MU Xiao-ting(穆小婷), et al. New technology of quality control in dairy products-Fingerprints(乳品质量控制新技术——指纹图谱技术)[J]. Food Science and Technology(食品科技) , 2013, 38(7): 303-306. |
| [13] | Borková M, Snášelová J. Possibilities of different animal milk detection in milk and dairy products-a review[J]. Czech Journal of Food Sciences , 2005, 23(2): 41-50. |
| [14] | Moatsou G, Samolada M, Panagiotou P, et al. Casein fraction of bulk milks from different caprine breeds[J]. Food Chemistry , 2004, 87(1): 75-81. DOI:10.1016/j.foodchem.2003.10.020. |
| [15] | Montalbano M, Tortorici L, Mastrangelo S, et al. Development and validation of RP-HPLC method for the quantitative estimation of as1-genetic variants in goat milk[J]. Food Chemistry , 2014, 156(156): 165. |
| [16] | Rodríguez N, Ortiz M C, Sarabia L, et al. Analysis of protein chromatographic profiles joint to partial least squares to detect adulterations in milk mixtures and cheeses[J]. Talanta , 2010, 81(1-2): 255-264. DOI:10.1016/j.talanta.2009.11.067. |
| [17] | Moatsou G, Moschopoulou E, Molle D, et al. Comparative study of the protein fraction of goat milk from the Indigenous Greek breed and from international breeds[J]. Food Chemistry , 2008, 106(2): 509-520. DOI:10.1016/j.foodchem.2007.06.014. |
| [18] | Montalbano M, Segreto R, Di Gerlando R, et al. Quantitative determination of casein genetic variants in goat milk:application in Girgentana dairy goat breed[J]. Food Chemistry , 2016, 192: 760-764. DOI:10.1016/j.foodchem.2015.07.075. |
| [19] | Ha M, Bekhit A E, Mcconnell M, et al. Fractionation of whey proteins from red deer (Cervus elaphus) milk and comparison with whey proteins from cow, sheep and goat milks[J]. Small Ruminant Research , 2014, 120(1): 125-134. DOI:10.1016/j.smallrumres.2014.04.012. |
| [20] | Bonfatti V, Giantin M, Rostellato R, et al. Separation and quantification of water buffalo milk protein fractions and genetic variants by RP-HPLC[J]. Food Chemistry , 2013, 136(2): 364-367. DOI:10.1016/j.foodchem.2012.09.002. |
| [21] | Bonfatti V, Grigoletto L, Cecchinato A, et al. Validation of a new reversed-phase high-performance liquid chromatography method for separation and quantification of bovine milk protein genetic variants[J]. Journal of Chromatography a , 2008, 1195(1-2): 101-106. DOI:10.1016/j.chroma.2008.04.075. |
| [22] | Bordin G, Cordeiro R F, de la Calle B, et al. Identification and quantification of major bovine milk proteins by liquid chromatography[J]. Journal of Chromatography A , 2001, 928(1): 63-76. DOI:10.1016/S0021-9673(01)01097-4. |
| [23] | Bobe G, Beitz D C, Freeman A E, et al. Sample preparation affects separation of whey proteins by Reversed-Phase High-Performance liquid chromatography[J]. Journal of Agricultural and Food Chemistry , 1998, 46(4): 1321-1325. DOI:10.1021/jf970687f. |
| [24] | Bobe G, Beitz D C, Freeman A E, et al. Separation and quantification of bovine milk proteins by Reversed-Phase High-Performance liquid chromatography[J]. Journal of Agricultural and Food Chemistry , 1998, 46(2): 458-463. DOI:10.1021/jf970499p. |
| [25] | LUO Guo-an(罗国安), LIANG Qiong-lin(梁琼麟), WANG Yi-ming(王义明). Fingerprint of traditional Chinese medicine:quality evaluation, quality control, new drug research and development(中药指纹图谱——质量评价、质量控制与新药研发)[M].Beijing(北京): Chemical Industry Press(化学工业出版社), 2009. |




