脂肪族聚酯(PHA)是一种可进行多种形式生物降解并具有良好的生物相容性的高聚物,因此它有着广泛地应用价值,尤其是在医药和环保方面[1, 2]。传统的脂肪族聚酯的合成方法通常采用Al、Zn 和稀土金属的氧化物或有机化合物为催化剂进行合成[3, 4],所以在合成出的聚合物中容易存在残留的有毒金属化合物。近年来,人们越来越关注用酶催化合成脂肪族聚酯。酶法是一种新型的环境友好的绿色化学技术,且具有很多独特的优势,如温和的反应条件、良好的回收能力,高区域选择性[5, 6]。聚ε己内酯(PCL)是一种脂肪族直链聚酯,由于其单体简单易得,常被人们当作模板反应进行研究。然而,用酶法催化己内酯开环聚合仍有一些局限性,如猪胰脂酶(PPL)催化ε-己内酯开环聚合需要的反应96~120 h[7]。
实验室研究发现脂肪酶Candida sp. 99-125能够催化ε-己内酯开环聚合[8],但是所需的反应时间较长,且分子量分布较宽(Mw/Mn = 2.2)。作者曾用该脂肪酶催化长链的油酸和烷基醇在无溶剂体系下进行酯化,反应效果较好[9]。于是可认为该酶对长链线型底物亲和性较好,继而考虑用它催化长链线型羟基酸类单体进行缩聚。但是反应中不断产生的水需要高温或高压等极其严格的反应条件才能除去。希望寻求一种简单易行的反应方式来考察脂肪酶Candida sp. 99-125的催化能力。羟基酸酯,其重复单元与羟基酸相同,仅以甲氧基将端羧基封端,既具备了可降解的性能,还表现出更高的热稳定性,适当调节其相对分子质量,可以改变力学性能,使其适用于不同医疗领域,具有广泛的应用前景[10]。而用脂肪酶Candida sp. 99-125催化长链线型羟基酸甲酯合成脂肪族直链聚酯的的反应并未有过相关报道。
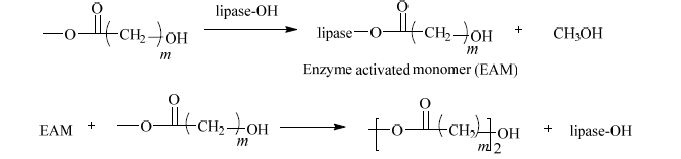
酶催化羟基酸甲酯聚合反应被认为是先进行快速地酯交换(Scheme 1),其次是中间聚合物分子量增加,最后缓慢聚合达到最大分子量[11, 12]。
|
方案 1 脂肪酶催化不断聚合的机理 Scheme1 Mechanism of step-growth polymerization catalyzed by lipase |
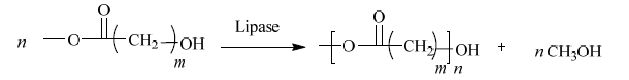
本文报道了在无溶剂体系下采用脂肪酶Candida sp. 99-125 催化羟基酸甲酯聚合(Scheme 2)。以6-羟基己酸甲酯为模板考察了酶量、温度、反应时间和表面活性剂等反应条件的影响。考察不同碳链长度的单体,发现随着碳链的增长,反应的转化率提高。单体15-羟基十五烷酸甲酯在最优条件下反应24 h,聚合物分子量就可达到10000 (Mw)。
|
方案 2 脂肪酶催化羟基酸甲酯聚合 Scheme2 Polymerization of methyl hydroxyl acid catalyzed by lipase |
2-羟基乙酸甲酯,δ-戊内酯,ε-己内酯,10-羟基癸酸甲酯,环十五内酯、三乙胺和甲醇钠等试剂都是安耐吉的。脂肪酶Candida sp. 99-125(酶活:10000 U⋅g-1)由北京化工大学谭天伟课题组提供。
其他所有的试剂都是分析纯的。
2.2 酶催化反应过程将0.1 g脂肪酶Candida sp. 99-125,1.0 g 6-羟基己酸甲酯加入到三口圆底烧瓶中,液面下通N2,搅拌反应。反应结束后,得到的混合物加入二氯甲烷溶解后过滤,滤液加入冷甲醇纯化,得到白色固体PHA。滤渣为脂肪酶Candida sp. 99-125,可重复使用[13]。
2.3 表征单体的纯度由气相分析:安捷伦气相色谱仪7890A;氢火焰离子检测器。
单体结构分析通过核磁与质谱。采用Bruker AV-400 型核磁共振仪进行1H-NMR谱分析,d-氯仿为溶剂。质谱采用Agilent 6520 Q-TOF LC/MS。
产物的重均分子量(Mw)由SEC获得,核磁辅证,分子量分布(Mw/Mn或PDI)通过SEC获得。通过端基分析法和凝胶过滤色谱法测得,凝胶渗透色谱采用Water201 型SEC,THF 为流动相,流速1.0 mL⋅min-1。聚苯乙烯为标样。待测聚合物预先在25℃下减压干燥24 h。
产物的产率通过称重计算得到,公式:
产率(%)=称得产物(g)÷理论产物(g)×100%,理论产物(g)=114×底物量(g)÷146
3 结果与分析 3.1 单体的制备5-羟基戊酸甲酯(99%)是通过δ-戊内酯开环得到[14]。1H-NMR(400 MHz,CDCl3):δ H 3.64 (3H,s,OCH3),3.61 (2H,t,J 6.4 Hz,CH2OH),2.33 (2H,t,J 7.2 Hz,CH2COOCH3),2.06(1H,S,OH),1.72~1.65(2H,m,CH2CH2OH),1.60~1.53 (2H,m,CH2CH2COOCH3); MS:155.0673(+Na)。6-羟基己酸甲酯(纯度>95%)是通过ε-己内酯开环制得[15]。1H-NMR(400 MHz,CDCl3):δ H 3.64 (3H,s,OCH3),3.61 (2H,t,J 6.4 Hz,CH2OH),2.30 (2H,t,J 7.2 Hz,CH2COOCH3),1.80(1H,S,OH),1.67~1.60 (2H,m,CH2CH2COOCH3),1.60~1.52(2H,m,CH2CH2OH),1.35~1.41(2H,m,CH2CH2CH2OH ); MS:169.0827(+Na)。这两个单体的纯化方法主要通过减压蒸馏和硅胶柱层析。15-羟基十五烷酸甲酯是通过环十五内酯开环制得,单体的纯化方法为乙醚/正己烷=1/5双溶剂重结晶[16]。1H-NMR(400 MHz,CDCl3):δ H 3.66 (3H,s,OCH3),3.63 (2H,t,J 6.6 Hz,CH2OH),2.30 (2H,t,J 7.2 Hz,CH2COOCH3),1.63~1.52 (4H,m,CH2CH2OH and CH2CH2COOCH3),1.31~1.23 (20H,m,CH2: C4~C13);MS: 295.2254(+Na)。
3.2 优化反应条件 3.2.1 催化剂用量的影响在70℃、无溶剂体系下,考察脂肪酶用量对6-羟基己酸甲酯缩聚反应效果的影响。如表 1 所示,考察了5%(wt)、7%(wt)、10%(wt)和12%(wt)四种酶浓度下缩聚的效果,同时做了空白对照实验。可以发现随着催化剂用量的增加,重均分子量和产率也都在增加。当脂肪酶浓度超过10%(wt)时,产率不再提高,因为对于有限的底物来说,多余的脂肪酶并不能发挥催化作用[17]。综合考虑,选用10%(wt)脂肪酶用量为最佳用量。
| 表 1 脂肪酶Candida sp.99-125催化量的影响 Table 1 Effect of lipase Candida sp.99-125 catalyst dosage |
由表 2可知,脂肪酶催化聚合反应对单体纯度的要求并不严苛,自制单体的纯度为95%就可以直接用于聚合反应并产生不错的效果。随着单体纯度的提高,反应的产率和重均分子量略微提高,而反应时间明显缩短,分子量分布也明显变窄。因此,反应采用的最优单体纯度为99%。
| 表 2 单体纯度的影响 Table 2 Effects of monomer purity |
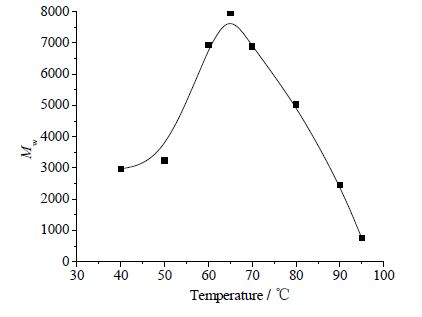
聚酯反应温度分别考察了40、50、60、65、70、80、90和95℃。如图 1所示,当反应温度从40提高到65℃,重均分子量也明显不断升高。随着温度继续升高,重均分子量反而降低。温度高于最适温度时,脂肪酶的催化活性降低;当温度过高(80℃、90℃和95℃),脂肪酶容易变性失活。所以最适反应温度为65℃。
|
图 1 反应温度的影响 Fig.1 Effects of reaction temperature Reaction conditions: 10 %(wt) lipase Candida sp.99-125, 60 h, solvent-free |
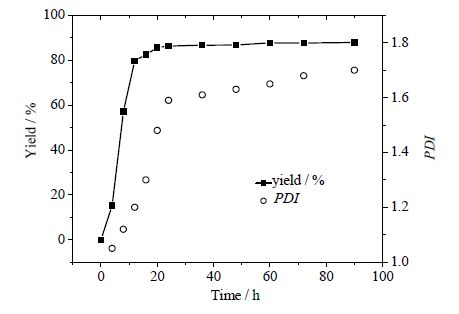
一般酶催化聚合反应可以通过适当地延长反应时间来提高聚合度,但是这样产物的PDI也可能变大。由图 2可以看出,PDI和产率的曲线趋势相似。在优化的条件下(65℃、10%脂肪酶、单体纯度99%),从0到24 h,两条曲线都增幅较大,反应24 h,产率达到86.31%,PDI为1.59。延长反应时间,产率和PDI的增长都趋于平缓。因此,最优反应时间为24 h。
|
图 2 反应时间的影响 Fig.2 Effect of reaction time Reaction conditions: 10 %(wt) lipase Candida sp.99-125, 65℃, solvent-free |
据报道,曲拉通X-100、吐温80等非离子型表面活性剂能够促进脂肪酶Candida sp.99-125活力的提高,因为合适的表面活性剂能够创造出巨大的脂肪酶催化所需的水-油界面[18, 19],影响脂肪酶的活性和立体选择性,快速提高酶促反应的速率[20]。如表 3所示,通过在反应中加入浓度为15 mg⋅mL-1的四种非离子型表面活性剂,可以提高分子量并缩窄分子量分布。其中曲拉通X-114控制分子量分布的效果最优,但提高分子量的能力较弱。而吐温80和吐温40对分子量和分子量分布的影响明显优于曲拉通X-100和曲拉通X-114。所选的4种表面活性剂均对聚合有正向的作用,综合考虑,选用表面活性剂吐温80。
| 表 3 表面活性剂的影响 Table 3 Effects of surfactants |
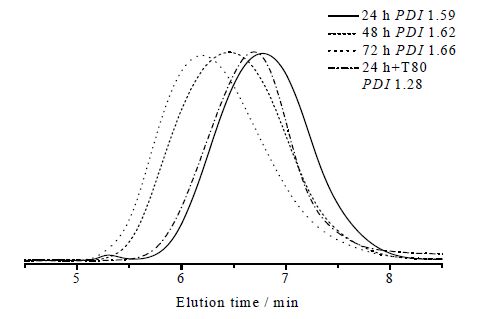
由图 3可知,考察了不同的反应时间(24 h、48 h、72 h)对重均分子量和分子量分布的影响。反应时间越长,SEC曲线的流出时间越短,分子量越大,分子量分布越宽。反应24 h与同等条件加15 mg⋅mL-1的吐温80相比较,则加吐温80合成的聚合物分子量分布明显变窄。说明表面活性剂吐温80对缩聚反应的聚合度和分子量分布都有很好的控制。
|
图 3 SEC监测聚合物变化 Fig.3 SEC results of different polymeric products Reaction conditions: monomer purity: 99%; 10%(wt) lipase Candida sp.99-125, 65℃, solvent-free. -24 h+T80: add Tween 80, 15 |
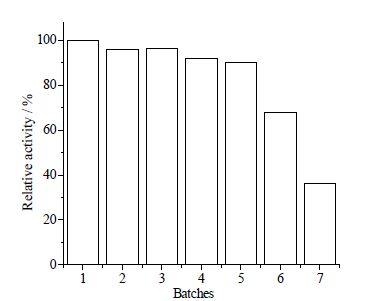
脂肪酶Candida sp.99-125呈粉末状均匀分散在反应体系中,并不溶解,因此便于循环使用。脂肪酶的重复使用可以通过过滤、乙醇洗涤和真空干燥来实现。在同样的反应条件下进行循环使用实验,根据每次反应的产率与第一次反应的产率比,计算相对活性。图 4表明,脂肪酶非常稳定,通过5次循环使用相对活性仍然保持在90%以上。如果继续循环使用,相对活性直线下降。
|
图 4 催化剂在聚酯反应中的重复使用 Fig.4 Catalyst activity after reusage Reaction conditions: 65℃, 24 h, solvent-free |
有报道脂肪酶诺维信435能够催化3-羟基丙酸甲酯进行缩聚[11],脂肪酶Candida sp.99-125可能对不同碳链长度的单体都有催化能力。如表 4,考查了5种不同碳链长度的单体。随着链长的增加,原料转化率也在增加,产率也在增加。其中单体2-羟基乙酸甲酯聚合效果最差,可能是因为乙醇酸甲酯分子具有较高的稳定性,分子得失电子的能力相对较弱,反应的活性较弱[21, 22]。而单体15-羟基十五烷酸甲酯聚合的效果最好。
| 表 4 单体碳数的影响 Table 4 Effect of monomer carbon chain length |
采用了一种利用脂肪酶催化缩聚反应合成脂肪族聚酯的方法。与传统的方法相比,该法对单体的纯度要求较低(>=95%),反应条件温和(65℃),催化剂回收利用率高(可以循环使用5次),环境友好。15-羟基十五烷酸甲酯在优化后的条件(单体纯度:99%、10%酶浓度、65℃、Tween 80: 15 mg⋅mL-1)下反应24 h重均分子量可以达到10012。脂肪酶Candida sp.99-125对不同链长的单体催化能力不同。单体的碳链越长,催化效果越好。
| [1] | YANG Jin-ming(杨金明), ZHANG Min(张敏) . Effect of monomer carbon number on synthesis of straight-chain polyester catalyzed by lipase N435(单体碳数对脂肪酶N435催化合成直链聚酯的影响)[J]. China Synthetic Resin and Plastics(合成树脂及塑料) , 2013, 30 (1) : 48-51 |
| [2] | Hazer B, Steinbuchel A . Increased diversification of polyhydroxyalkanoates by modification reactions for industrial and medical applications[J]. Applied Microbiology and Biotechnology , 2007, 74 (1) : 1-12 DOI:10.1007/s00253-006-0732-8 |
| [3] | Fliedel C, Mameri S, Dagorne S . Controlled ring-opening polymerization of trimethylene carbonate and access to PTMC-PLA block copolymers mediated by well-defined N-heterocyclic carbene zinc alkoxides[J]. Applied Organometallic Chemistry , 2014, 28 (7) : 504-511 DOI:10.1002/aoc.v28.7 |
| [4] | You L X, Shen Z Q, Kong J . A novel approach to RE-OR bond from in situ reaction of rare earth triflates and sodium alkoxides:A versatile catalyst for living ring-opening polymerization of epsilon-caprolactone[J]. Polymer , 2014, 55 (10) : 2404-2410 DOI:10.1016/j.polymer.2014.03.032 |
| [5] | Guldhe A, Singh B, Mutanda T . Advances in synthesis of biodiesel via enzyme catalysis:Novel and sustainable approaches[J]. Renewable & Sustainable Energy Reviews , 2015, 41 : 1447-1464 |
| [6] | Jiang L Y, Xie X N, Yue H . Highly efficient and regioselective acylation of arbutin catalyzed by lipase from Candida sp[J]. Process Biochemistry , 2015, 50 (5) : 789-792 DOI:10.1016/j.procbio.2015.02.014 |
| [7] | QI Geng-geng(齐耿耿), SUN Jian-zhong(孙建中), ZHOU Qi-yun(周其云) . Synthesis and Characterization of Enzyme-catalyzed Ring-openingn Polymerization of ε-caprolactone(酶催化己内酯开环聚合及表征)[J]. Journal of Chemical Engineering of Chinese Universities(高校化学工程学报) , 2003, 17 (6) : 655-659 |
| [8] | Zhu N, Zhang Z L, He W . Highly chemoselective lipase from Candida sp. 99-125 catalyzed ring-opening polymerization for direct synthesis of thiol-terminated poly(e-caprolactone)[J]. Chinese Chemical Letters , 2015, 26 (3) : 361-364 DOI:10.1016/j.cclet.2014.11.016 |
| [9] | Zhong H, Fang Z, Zou B H . Studies on the lipase-catalyzed esterification of alkyl oleates in solvent-free systems[J]. Journal of Molecular Catalysis B:Enzymatic , 2013, 90 : 114-117 DOI:10.1016/j.molcatb.2013.01.013 |
| [10] | WANG Ze-yun(王泽云), CUI Ai-jun(崔爱军), LU Wei-liang(陆为良) . Optimization on the synthesis process of polymethylglycolate via melt/solid polycondensation(熔融/固相缩聚法制备聚乙醇酸甲酯的工艺条件优化)[J]. Chemical Industry Engineering Progress(化工进展) , 2012, 31 (12) : 2771-2774 |
| [11] | Song H, Zhao Y J, Zhang Y X . Synthesis of polyhydroxyalkanoates by polymerization of methyl 3-hydroxypropionate in the catalysis of lipase[J]. Chinese Journal of Catalysis , 2012, 33 (3) : 423-438 |
| [12] | Liu W H, Wang F, Tan T W . Lipase-catalyzed synthesis and characterization of polymers by cyclodextrin as support architecture[J]. Carbohydrate Polymers , 2013, 92 (1) : 633-640 DOI:10.1016/j.carbpol.2012.09.064 |
| [13] | Uyama H, Kobayashi S . Enzyme-catalyzed polymerization to functional polymers[J]. Journal of Molecular Catalysis B Enzymatic , 2002, 785 (7) : 1-11 |
| [14] | Seifert T, Malo M, Kokkola T, et al[[J]. Journal of Medicinal Chemistry, 2014, 57(23), 9870-9888. |
| [15] | Choi S E, Pflum M K H . The structural requirements of histone deacetylase inhibitors:Suberoylanilidehydroxamic acid analogs modified at the C6 position[J]. Bioorganic & Medicinal Chemistry Letters , 2012, 22 (23) : 7084-7086 |
| [16] | Adamkiewicz M, O'Hagan D, Haehner G . Bis(Trifluoromethyl)methylene addition to vinyl-terminated SAMs:A gas phase C-C bond forming reaction on a surface[J]. Langmuir , 2014, 30 (19) : 5422-5428 DOI:10.1021/la5011727 |
| [17] | Emanuel G A, Horacio F O, Tonya L P . Lipase-mediated epoxidation utilizing urea-hydrogen peroxide in ethyl acetate[J]. Green Chemisty , 2006, 8 (10) : 923-926 DOI:10.1039/B604984B |
| [18] | TAN Tian-wei(谭天伟), CHEN Bi-qiang(陈必强) . Lipase from Candida sp. 99-125 and its application in synthesis of chemicals(Candida sp. 99-125脂肪酶及其在化学品合成中的应用)[J]. Journal of Chemical Industry and Engineering(化工学报) , 2010, 61 (7) : 1685-1692 |
| [19] | LIU You-yan(刘幽燕), XU Jian-he(许建和), HU Ying(胡英) . Effect of surfactants on lipase activity and enantioselectivity(表面活性剂对脂肪酶活性和选择性的影响)[J]. Acta Chimica Sinica(化学学报) , 2000, 58 (2) : 149-152 |
| [20] | Liu Y Y, Xu J H, Hu Y . Enhancing effect of Tween-80 on lipase performance in enantioselective hydrolysis of ketoprofen ester[J]. Journal of Molecular Catalysis B:Enzymatic , 2000, 10 (5) : 523-529 DOI:10.1016/S1381-1177(00)00093-X |
| [21] | Yan X, Dou W J, Zhao Y J . Kinetics Study for Ion-Exchange-Resin Catalyzed Hydrolysis of Methyl Glycolate[J]. Industrial & Engineering Chemistry Research , 2012, 51 (36) : 11653-11658 |
| [22] | NI Liang(倪良), ZHAO Chen-xuan(赵琛煊), JIANG Yong(姜勇) . Theoretical research on structure and nature of methyl glycollate(乙醇酸甲酯结构和性质的理论研究)[J]. Natural Gas Chemical Industry(天然气化工) , 2009, 34 (6) : 35-43 |




