葡萄糖-1-磷酸(G-1-P)广泛存在于动植物以及微生物中,在生物体中起着重要的作用[1],如G-1-P是糖原降解的第一个产物,在葡萄糖磷酸变位酶(EC 5.4.2.2)的作用下生成葡萄糖-6-磷酸,进入EMP途径[2];此外G-1-P还是合成核酸二磷酸葡萄糖(NDPG)的起始物质,NDPG可进一步用于各种糖苷的合成[3]。G-1-P在医药方面有重要用途,如:G-1-P能明显阻止脂肪肝浸润[4],促进骨骼及牙齿中钙的累积[5],以及增强钙在哺乳动物小肠内的主动运输[6]。此外,G-1-P还可以用作抗菌剂,其铂螯合物更可用于癌症的治疗[7],壳聚糖/G-1-P即型水凝胶可以作为创面止血材料及药物缓释材料[8]。
目前G-1-P的生产主要是利用蔗糖磷酸化酶(SPase)催化蔗糖及葡聚糖磷酸化酶(GPase)催化可溶性淀粉制备。在SPase催化的反应中,Christiane[9]等人以固定化重组SPase催化蔗糖,30℃下反应制备G-1-P,底物转化率达69.66%,是目前报道的以蔗糖为底物的最高值;在GPase催化可溶性淀粉的反应中,Jungdon[10]等利用重组GPase在70℃高温下催化可溶性淀粉制备G-1-P,底物转化率达68.78%,是报道的以可溶性淀粉为底物的最高值。而两种制备方法各有优缺点:a)以蔗糖为底物时,所用的SPase为常温酶,而工业生产中温度大多要求在60℃或者更高,以避免微生物污染,并降低反应体系黏度[11];而且,蔗糖酶催化生产G-1-P的最大理论碳摩尔转化率仅为50%,蔗糖中一半碳原子转化为果糖,造成碳原子的不完全利用;b)以可溶性淀粉为原料生产G-1-P,所用GPase大多为高温酶,满足工业要求;c)蔗糖与可溶性淀粉的价格均较高。相对而言,普通淀粉价格低廉。目前,国内外未见有关于普通淀粉制备G-1-P的报道,主要是因为淀粉在常温下不能完全糊化,较难利用。本研究首次尝试利用葡聚糖磷酸化酶以普通淀粉为原料,在高温下制备G-1-P,以期降低G-1-P生产原料成本。
2 材料与方法 2.1 菌株及质粒大肠杆菌E. coli DH 5α,E. coli BL21 (DE3),质粒pET-28a(+)为本实验室保存。
2.2 重组菌的构建参照GenBank中公布的Pyrococcus furiosus DSM3638的葡聚糖磷酸化酶基因序列,根据宿主E. coli中的密码子偏好性进行基因优化,并在基因序列两端引入Sac I和Hind Ⅲ酶切位点,交由上海生工生物工程有限公司全合成。实验中采用双酶切的方法,将目的基因定向连接至pET-28a(+),构建重组质粒pET-28a-GP,转化到E.coli BL21(DE3)中,构建重组菌。
2.3 工具酶与试剂Protein Marker等购自TaKaRa公司;卡那霉素和异丙基-β-D-硫代半乳糖苷(IPTG)购自上海生工生物有限公司;蛋白胨、酵母粉购自Oxiod公司,淀粉购自阿拉丁公司,其他试剂均购自国药集团。
2.4 发酵条件及优化从新鲜的平板上挑取单菌落接种于含有卡那霉素的5 mL LB培养基中,37℃,200 r·min-1培养过夜。以2%接种量转接于50 mL含卡那霉素的TB培养基中,考察诱导时间、IPTG浓度及诱导后培养温度对GPase的表达和酶活的影响。
2.5 GPase催化反应条件和过程优化在1 mL反应体系中,GPase初始活力为5000 U·L-1,反应30 min,考察不同反应温度(60~100℃)、pH(6-8)、初始底物浓度比例以及不同金属离子的添加对酶活的影响。
在100 mL烧瓶中测定过程曲线。反应液总体积100 mL,含5000 U·L-1 GPase,pH 6.6的1 mol·L-1磷酸钾缓冲液的反应体系,80℃搅拌反应24 h,以5%的初始淀粉添加量,考察以不同淀粉为原料的G-1-P产量和原料预处理的影响。预处理时将不含酶的体系在100℃保温2 h,待温度降至80℃时加入酶液反应。在同样反应条件下,考察不同初始底物浓度底物及补料对G-1-P产量的影响。
2.6酶活测定
G-1-P的浓度通过双酶法测定,反应式如下所示:
| $ {\text{UTP + G - 1 - p}}\overset {{\text{UGPase}}} \leftrightarrows {\text{UDPG + PPi}}\;\;\;\;\;\;\;\;\;\;\; {\text{PPi}} \to {\text{2Pi}} $ |
UDPG(尿苷二磷酸葡萄糖)在260 nm处有较强的紫外吸收,可用HPLC测定,从而推算出G-1-P的含量。
反应总体积为1.0 mL,包含50 mmol·L-1 Tris-HCl(pH 8.0),2 mmol·L-1 MgCl2,淀粉反应液10 μL,2 mmol·L-1 UTP(尿苷三磷酸),5000 U·L-1 PPase(无机焦磷酸化酶)及3000 U·L-1 UGPase(尿苷二磷酸葡萄糖焦磷酸化酶),以包含除酶外所有底物的体系作为对照,25℃反应10 min,沸水浴5 min结束反应。12000 g,4℃离心10 min除去变性酶蛋白,上清液进行HPLC分析。
HPLC条件为,Agilent 5 TC-C18 (2)色谱柱(250 mm×4.6 mm,5 μm),检测波长260 nm,流动相为50 mmol·L-1甲酸铵(pH=3.5),流速1.0 mL·min-1,柱温30℃,进样量10 μL。
一个酶活力单位定义为在最适条件下,每分钟催化生成1 μmol G-1-P所需的酶量。
3 结果与讨论 3.1 GPase表达条件优化由图 1(a)可知,培养4 h诱导,此时蛋白表达量及酶活最高。IPTG浓度从0.05 mmol·L-1提高到0.2 mmol·L-1,蛋白的表达量及酶活均增加,但是IPTG浓度继续增加时,蛋白的表达水平(图 1(b))及酶活(表 2)均降低,这可能是由于较高浓度的IPTG加快蛋白的折叠,导致形成包涵体,使可溶蛋白的表达量降低。诱导温度在28℃时,蛋白表达量及酶活达到最高(图 1(c),表 2)。综上所述,GPase的最适诱导条件为:培养4 h后加入0.2 mmol·L-1 IPTG,28℃诱导。

|
图 1 GPase不同诱导条件的SDS-PAGE分析 Fig.1 SDS-PAGE analysis of different induction conditions Effects of induction time (a), IPTG concentration (b) and induction temperature (c) on GPase expression |
| 表 1 不同诱导条件对GPase在E. coli BL21中表达的影响 Table 1 Effects of different induction conditions on the expression of GPase in E. coli BL21. |
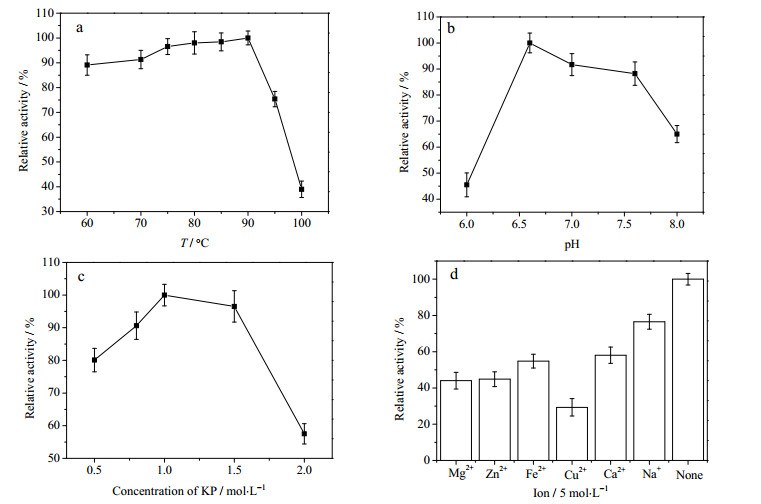
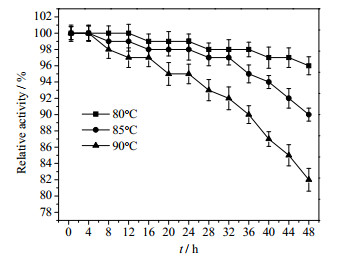
在GPase催化过程中,酶活受多种因素影响。以可溶性淀粉为例,优化反应条件,结果如图 2、3所示。
|
图 2 GPase最适反应条件 Fig.2 Optimal reaction conditions of GPase a. GPase activity under different temperatures b. GPase activity under different pH c. GPase activity under different substrate ratios d.effects of ions on GPase activity |
|
图 3 GPase的热稳定性 Fig.3 Thermal stability of GPase Note: The initial enzyme activity was 100% |
由图 2a可知,GPase的酶活在75~90℃变化不显著,90℃以上随温度增加迅速下降。同时考察了GPase的热稳定性,结果如图 3所示。GPase在80℃时热稳定性较好,经过48 h的80℃保温,仍保持初始酶活的97%,90℃下酶的热稳定显著降低。故选择80℃作为最适反应温度,以保证温度在(80±5)℃范围内操作时,酶活力较高且稳定性好。
由图 2c可知,在0.5~1.0 mol·L-1浓度范围内,随着磷酸钾缓冲液浓度增加,酶活增加。这是由于GPase催化的是可逆反应,磷酸盐缓冲液浓度的增加有助于反应向正向进行。而当磷酸钾缓冲液浓度继续增加时,酶活降低。故最适底物浓度比例为5%可溶性淀粉/1 mol·L-1磷酸盐缓冲液。
由图 2d可知金属离子对GPase的活性均有一定的抑制。GPase需要磷酸吡哆醛作为辅因子[12],金属离子的存在可能会影响磷酸吡哆醛与GPase的结合或者影响GPase的空间结构,从而抑制酶活。
综上所述,GPase最适反应条件为80℃,pH 6.6,底物浓度比例为5%可溶性淀粉/1 mol·L-1磷酸盐缓冲液,不添加金属离子。
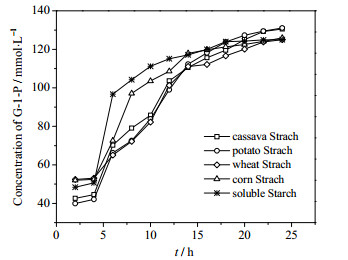
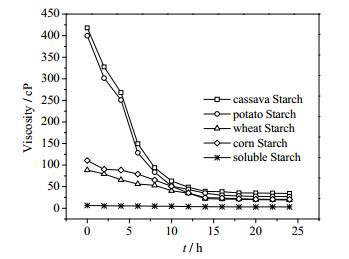
3.3 不同淀粉原料的比较由图 4可知,GPase对于各种淀粉都有较强的催化能力,其中可溶性淀粉利用较快,这可能是由于可溶性淀粉在80℃下完全溶解,且体系黏度较低(图 5),有利于反应。而薯类淀粉由于体系初始粘度较大(图 5),不利于传质,催化速度较慢。24 h后,所有淀粉体系反应达到平衡,G-1-P浓度均在125~130 mmol·L-1,转化率为65.04%~67.63%。
|
图 4 不同底物反应进程 Fig.4 Reaction profiles of different substrates |
|
图 5 不同底物反应进程中体系黏度变化 Fig.5 Viscosity variation of different substrates during reaction Note: The viscosity was determinated at 80℃ |
从图 4可知,以淀粉为底物,在开始的2-4 h这段时间内,反应速度很慢。可能是由于淀粉颗粒以螺旋结构存在,暴露在水溶液中的只有少数较短的支链,而主链包裹在螺旋内。前2 h内,GPase降解暴露的支链上的α-1, 4糖苷键,而当这些糖苷键全部被降解之后,主链没有完全打开,酶与底物无法充分接触,故反应速度降低。为了提高反应速度,进行原料预处理。由图 6可知,经过100℃保温2 h,可以使淀粉主链完全打开,前6 h内反应速度明显提高,迟滞现象消失,且在12 h反应已趋于平衡,缩短反应时间。综上所述,预处理可以在不影响G-1-P产量的前提下,提高反应速度,缩短反应时间,所以在后续反应中均采用此方法进行预处理。
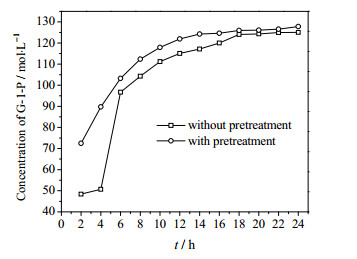
|
图 6 预处理及未预处理体系反应进程图 Fig.6 Reaction profiles of systems with and without pretreatment |
为了提高G-1-P产量,进行高底物浓度催化。在3.3节中可知,薯类体系初始黏度很高,不适合用于高浓度反应。小麦淀粉价格相对玉米淀粉较高,且反应平衡时G-1-P产量相近。故选取玉米淀粉为底物,进行高浓度催化,结果如表 2所示。
| 表 2 GPase催化不同浓度底物的转化率 Table 2 Conversion ratios with different concentrations of starch |
由表 2可知,当淀粉浓度为12.5%时,即使延长反应时间,转化率仍低于40%,可能是由于此时体系中磷酸钾浓度为2.5 mol·L-1,浓度过高,影响酶空间结构,严重抑制酶活。以可溶性淀粉为底物,当浓度不高于10%时,经48 h反应后底物转化率均大于65%。而以10%玉米淀粉为底物时,反应速率显著降低,而且48 h后依旧没有达到最大转化率。可能是由于10%玉米淀粉在80℃下,不能完全糊化,体系初始黏度较大,造成转化率低。而当浓度低于10%时,玉米淀粉可以完全糊化,体系初始黏度较低,转化率较高。
3.6 补料反应由3.5节可知,当以玉米淀粉为原料,浓度大于10%时,反应速率较低,达到反应平衡需要较长的时间。为了能实现以玉米淀粉为原料高产G-1-P,进行补料催化反应,反应进程图如图 7所示。
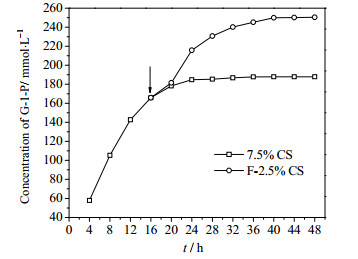
|
图 7 补料反应进程图 Fig.7 Reaction profiles with substrate feeding during reaction |
以7.5%玉米淀粉为底物,反应16 h后补入2.5%玉米淀粉,继续反应32 h,反应达到平衡,此时G-1-P产量达250.34 mmol·L-1,底物转化率达65.1%,与10%可溶性淀粉相比,产量与转化率相近(252.9 mmol·L-1,65.9%)。补料反应不仅解决了初始玉米淀粉浓度过高造成的转化率低,实现了玉米淀粉高产G-1-P的可能,而且产量与可溶性淀粉体系相近,证实了玉米淀粉可以替代可溶性淀粉生产G-1-P。目前利用GPase催化产G-1-P的研究中,最高产物浓度仅为132.2 mmol·L-1[17],远低于本研究的结果;最高转化率为68.7%[17],与本研究的结果相近;但其原料(可溶性淀粉)成本远高于本研究中原料成本。本研究以普通淀粉替代可溶性淀粉高产G-1-P,大幅降低G-1-P生产成本,为G-1-P工业化奠定基础。
4 结论重组GPase对不同的淀粉及可溶性淀粉均表现出较强的催化能力,实验中通过反应过程优化提高G-1-P产量。通过补料催化,G-1-P产量达250.34 mmol·L-1,转化率达65.1%,与相同浓度可溶性淀粉相比,产量与转化率相近。且本研究中转化率与目前报道最高值相近,但原料成本远低于文献报道。实验证实了玉米淀粉可以替代可溶性淀粉作为底物制备G-1-P,大幅降低G-1-P生产成本,为G-1-P的工业化生产奠定了基础。
| [1] | Frydman R, Slabnik E . The role of phosphorylase in starch biosynthesis[J]. Annals of the New York Academy of Sciences , 1973 (210) : 153-169 |
| [2] | Kitaoka M, Hayashi K . Carbohydrate-processing phosphorolytic enzymes[J]. Trends in Glycoscience and Glycotechnology , 2002, 14 (75) : 35-50 DOI:10.4052/tigg.14.35 |
| [3] | Kim J S, Koh S, Shin HJ, et al Lee DS, Lee SY . Biochemical characterization of a UDP-sugar pyrophosphorylase from Thermus caldophilus GK24[J]. Biotechnology and Applied Biochemistry , 1999, 29 (1) : 11-17 |
| [4] | Grassi G.G . Activity of Glucose-I-phosphate on Liver Steatosis[J]. Nature , 1958, 181 (4601) : 53-53 DOI:10.1038/181053a0 |
| [5] | Erick J Vandamme, Jan Van Loo, Lieve M . Microbial sucrose phosphorylase:fermentation process, properties, and biotechnical applications[J]. Advances in Applied Microbiology , 1987, 32 (6) : 163-201 |
| [6] | Hidetake F, Junji N, Hisataka K . Glucose 1-phosphate increases active transport of calcium in intestine[J]. Archives of Biochemistry and Biophysics , 2007, 460 (2) : 152-160 DOI:10.1016/j.abb.2006.09.006 |
| [7] | Kayane S, Kawai T, Sakata M, et al. Process for preparing glucose-1-phosphate[P]. EU Patent 0305981[P], 1987-09-02. |
| [8] | Stephanie S, Nicolas A, Julie B . Chitosan/glucose 1-phosphate as new stable in situ forming depot system for controlled drug delivery[J]. European Journal of Pharmaceutics and Biopharmaceutics , 2014, 88 (2) : 361-373 DOI:10.1016/j.ejpb.2014.05.015 |
| [9] | Christiane G, Alexandra S, Alphonse M . Recombinant sucrose phosphorylase from Leuconostoc mesenteroides:characterization, kinetic studies of transglucosylation, and application of immobilized enzyme for production of D-glucose 1-phosphate[J]. Journal of Biotechnology , 2007, 129 (1) : 77-86 DOI:10.1016/j.jbiotec.2006.11.019 |
| [10] | Jungdon B, DuckHee L, Dooil K . Facile synthesis of glucose-1-phosphate from starch by Thermus caldophilus GK24α-glucan phosphorylase[J]. Process Biochemistry , 2005, 40 (12) : 3707-3713 DOI:10.1016/j.procbio.2005.05.007 |
| [11] | Bruins M E, Janssen A E M . Thermozymes and their applications-a review of recent literature and patents[J]. Applied Biochemistry and Biotechnology , 2001, 90 (2) : 155-186 DOI:10.1385/ABAB:90:2 |
| [12] | Reinhard S, Bernd N . Bacterial α-glucan phosphorylases[J]. FEMS Microbiology Letters , 1999, 171 (2) : 73-79 |




