2. 天津大学 化学工程联合国家重点实验室,天津 300072
2. State Key Laboratory of Chemical Engineering, Tianjin University, Tianjin 300072, China
随着现代工业的迅猛发展,大量的挥发性有机化合物(volatile organic compounds,VOCs)被排放到大气中,使得VOCs成为仅次于颗粒污染物的第2大大气污染物。据文献报道,中国每年排放的VOCs接近2 000万吨[1]。大量研究证明,VOCs具有致癌、致畸和致突变效应;同时,还是形成臭氧、光化学烟雾和气溶胶等污染物的重要前体物[2-4]。当前,尽管世界各国在VOCs治理上投入了巨大的精力和财力,但是VOCs污染对环境和人类的危害仍然是全球面临的一大威胁。
VOCs治理常用的非生物工艺主要包括冷凝法、吸收法、吸附法、燃烧法、膜分离法、臭氧氧化法、等离子体降解法、光催化降解法等[2, 5];生物工艺主要有生物过滤、生物滴滤、生物洗涤等[1, 6]。
与非生物工艺相比,生物工艺具有设备简单、运行成本低、净化效率高、无二次污染等优点,在无机恶臭气体治理,如H2S、NH3等领域获得成功应用[7-8],但对于VOCs,尤其是疏水性、难降解的有机废气[9-10],生物治理技术的工程应用进展缓慢。
目前,国内丁辛醇行业的年产能已接近500万吨,在丁辛醇产品的生产、储存、装卸及后期使用过程中,会产生大量的VOCs,且主要为具有一定疏水性的异丁醛、正丁醛、异丁醇和正丁醇等组分。与其他组分相比,异丁醛在空气中具有更低的嗅觉阈值(0.001 0 mg·m-3)[11];而根据SERCU等[12]的研究结果,在微生物降解异丁醛的过程中,异丁醇为中间降解产物;另外,异丁醛作为正丁醛的同分异构体,由于含有支链的甲基,更难以被微生物降解[13-14]。因此,本文以异丁醛废气来模拟丁辛醇装置中的VOCs,针对生物滴滤塔(biotrickling filter, BTF)净化异丁醛废气的过程展开研究,以期为BTF系统在丁辛醇行业VOCs治理领域的工业化应用提供理论依据和数据支撑。
2 材料与方法 2.1 BTF系统的构建BTF实验装置如图 1所示,BTF-1塔内径为75 mm,填料层高度1 000 mm,所用填料为直径25 mm多面空心球。BTF-2塔内径为75 mm,填料层高度1 500 mm,填料层底部配有锥形气体分布器,所用火山岩填料的粒径为8~10 mm。BTF内的气液两相采取逆流操作,进气流量和营养液循环量调节分别由气体流量计(LZB型玻璃转子流量计,常州双环热工仪表有限公司)和液体流量计(DK型玻璃转子流量计,常州双环热工仪表有限公司)控制,流量读数已校正。
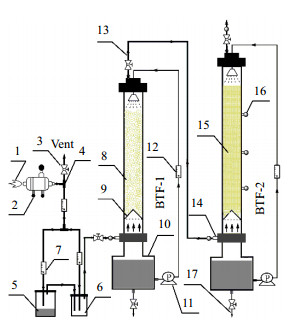
|
图 1 生物滴滤塔系统降解异丁醛的示意图 Fig.1 Schematic diagram of the BTF system for isobutyraldehyde removal 1. ambient air 2. compressor 3. needle valve 4. tee joint 5. isobutylaldehyde reservoir 6. mixed chamber 7. gas flow meter 8. polyhedrom empty balls 9. gas distributor 10. nutrient tank 11. pump 12. liquid flow meter 13. outlet 14. inlet 15. lava rocks 16. sampling port 17.solid & liquid outlet |
首先,由空气泵鼓出的空气经三通阀后被分成两路气流,每股气流的流量均由流量计控制。随后,一路气流被引入盛有500 mL异丁醛的5 L广口瓶内,通过调节气流流速控制气相中的异丁醛浓度;另一路气流被直接引入混合罐内,在混合罐内与载有异丁醛的气流混合,混合均匀后的气体最终先被引入BTF-1塔内,经初步除尘、降解后,进入BTF-2塔内。
2.3 菌种的驯化选用天津威立雅渤化永利水务有限责任公司的活性污泥,用医用纱布过滤;根据前期研究的营养液配方[15],先配制异丁醛浓度为4 mL·L-1的营养液,然后取200 mL加入到500 mL的三角瓶中,再倒入50 mL活性污泥;将三角瓶放置到水浴摇床中,25 ℃、120 r·min-1震荡培养;驯化期间,异丁醛是唯一的碳源,每隔5 d将三角瓶中的培养液倾倒出125 mL;同时,补加125 mL异丁醛含量为4 mL·L-1的营养液。
2.4 BTF系统挂膜前降解VOCs的研究在BTF接种前,先启动液体泵,开始营养液(不含异丁醛)循环,每个BTF内的循环营养液总量为5 L,循环营养液流速(liquid recirculation rate, LRR)为4.5 m·h-1,同时维持进塔异丁醛浓度约为1 622 mg·m-3,进气流量为0.1 m3·h-1,研究各BTF出口异丁醛浓度及脱除效率(removal efficiency,RE)随时间的变化规律。其中:
| $ {\rm{RE}} = \frac{{{C_\rm i} - {C_\rm o}}}{{{C_\rm i}}} \times 100{\rm{\% }} $ | (1) |
式中:Ci为换算后的进口VOCs浓度,mg·m-3;Co为换算后的出口VOCs浓度,mg·m-3;其中VOCs浓度采用美国华瑞公司的VOCs检测仪MiniRAE Lite PGM-7300进行检测,精度0.3 mg·m-3。
2.5 BTF系统的挂膜启动及参数调控取驯化一个月的活性污泥1 L,由塔顶倾倒到BTF中,静止2 h;启动液体泵,开始营养液(不含异丁醛)循环和挂膜,每个BTF内的循环营养液总量均为5 L;Ci为442~1 770 mg·m-3,进气流量为0.1 m3·h-1,各BTF的LRR为4.5 m·h-1;挂膜期间,每隔7 d排出2.5 L循环营养液,并加入2.5 L新鲜的营养液。
挂膜结束后,以RE和脱除能力(elimination capacity,EC)作为BTF性能的评定指标,重点考察气相空床停留时间(empty bed retention time,EBRT)、气相进料负荷(inlet loading,IL)等参数变化对BTF性能的影响。其中:
| $ {\rm{EC}} = \frac{{({C_{\rm{i}}} - {C_{\rm{o}}}) \times Q}}{{V \times 1\;000}} = \frac{{{\rm{RE}}}}{{100}} \times \frac{{{C_{\rm{i}}}}}{{1\;000}} \times \frac{Q}{V} $ | (2) |
| $ IL = \frac{{{C_{\rm{i}}} \times Q}}{{V \times 1\;000}} $ | (3) |
式中:EC为脱除能力,g·m-3·h-1;IL为气相进料负荷,g·m-3·h-1;Q为进气流量,m3·h-1;V为填料层体积,m3。首先,维持Q为0.1 m3·h-1,调节Ci和LRR,分别为531~3 244 mg·m-3和1.1~18.1 m·h-1;随后,维持Ci为(2 212 ± 147) mg·m-3,各BTF的LRR为4.5 m·h-1,调节Q在0.1~1 m3·h-1变化。
在研究不同运行条件对BTF性能影响的过程中,每个参数条件下,BTF的运行时间不低于2 d;且每次改变参数条件前,先调节Ci为1 475 mg·m-3,Q为0.1 m3·h-1,LRR为4.5 m·h-1,待BTF系统的RE恢复并稳定在98%左右后,再重新考察下一个参数变动对BTF性能的影响。BTF运行期间,BTF系统温度维持在(25±1) ℃;循环营养液pH始终处于6.0~7.0。
2.6 分析检测方法16S rDNA分析:沿BTF-1塔填料高度方向,分别从填料层的顶部、中部及底部各取20颗多面空心球填料(其余填料回装到BTF-1塔内时,尽量保持各层填料在塔内的原有位置),分别用去离子水浸泡以洗去未固定在填料上的微生物;然后用接种针剥离填料上的生物膜,依次收集标记。同时,沿BTF-2塔填料高度方向,分别从填料层的顶部、中部及底部各取20颗火山岩填料,分别用去离子水浸泡以洗去未固定在填料上的微生物;随后分别放置到250 mL烧杯中,加去离子水至液位没过填料,超声25 min以剥离填料上的生物膜;然后弃去烧杯中的火山岩,将烧杯中剩余的固液混合物转移至离心管中,12 000 r·min-1离心15 min;弃去上清液,依次收集下层菌体,并做好标记。最终,将收集标记的全部菌体冷藏,并送往北京诺禾致源生物信息科技有限公司进行基因测序和菌种分析。
HPLC-MS分析:高效液相色谱-质谱联用仪,Thermo Finnigan Surveyor高效液相色谱耦联LCQ Deca XP质谱仪,色谱柱为C18反相色谱柱(100 mm×2.1 mm×3.5 μm),进样量为5 μL;流动相为乙腈-水溶液,流速为250 μL·min-1;维持10%的乙腈流动3 min后,匀速升高流动相中乙腈的浓度,在35 min时升至90%,并维持15 min;经过色谱分离后的各组分最终进入质谱仪(MS)内进行检测,MS条件为:负离子扫描,电喷雾电压4.5 kV,扫描范围为50~1 000 m/z,毛细管温度为300 ℃。样品检测前先采用CHCl3对浓缩后的有机相稀释40倍。
3 结果与讨论 3.1 BTF系统的挂膜启动BTF系统挂膜期间,VOCs出口浓度和RE如图 2所示。在挂膜初期,BTF系统即表现出较高的VOCs降解能力,RE接近100%;而在作者采用BTF系统降解八甲基环四硅氧烷(D4)的研究中,BTF在挂膜初期需要1周多的过渡期,其RE值仅能达到20%以上[15]。LUVSANJAMBA等[16]在研究BTF降解异丁醛时,发现了类似的挂膜现象;对于醛类、酮类、醇类和酯类等易生物降解的有机化合物,BTF通常在挂膜初期就显示出较高的降解能力[12]。
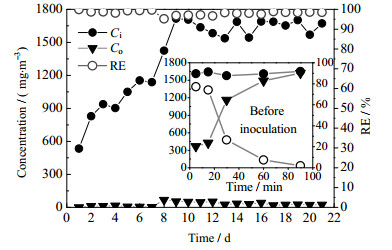
|
图 2 进出口VOCs浓度和降解效率随BTF系统挂膜时间的变化规律 Fig.2 Variation of inlet and outlet VOCs concentrations and REs during startup of the BTFs |
随后,当Ci提高到590~1 160 mg·m-3,RE先下降至98%左右,但在第7 d升至99.7%。进一步提高Ci至1 475~1 770 mg·m-3,RE下降到96%左右,直至第17 d以后,RE才上升至98%以上,并维持98.5%上下波动。另外,还采用未挂膜的BTF系统进行了异丁醛对比降解实验,结果如图 2所示。对于未挂膜的BTF系统,在90 min内RE从77.2%下降至1.9%,表明未挂膜的BTF系统内填料和循环营养液能够吸附和吸收异丁醛,但达到饱和后,RE迅速下降,BTF也随之丧失脱除能力。ACCETTOLA和FORTUNY等[17-18]在研究BTF降解硅氧烷、H2S等污染物过程中,也曾报道过填料和营养液对污染物的吸附和吸收。
从图 2还可看出,随着挂膜时间增长,BTF系统降解异丁醛能力也随之增强;当VOCs进口浓度升高至1 160~1 770 mg·m-3时,RE最终稳定在(98.5 ± 0.5)%,预示着挂膜期的完成。CHOU等[19]曾利用BTF降解甲乙酮(methyl ethyl ketone, MEK),发现采用活性污泥接种的BTF降解MEK时,BTF的挂膜期大约需要3周,与本研究中的挂膜周期接近。然而,与BTF降解H2S体系的挂膜期相比[10],本研究中观察到的挂膜期要略长,其主要原因可能是异丁醛疏水性较H2S强,导致微生物不能获得足够的异丁醛来提供生长繁殖的碳源和能源;或是微生物自身缺乏高效的异丁醛代谢途径,导致生长繁殖缓慢。此外,尽管在挂膜期间的第8 d和第15 d更换了一半的营养液,但在1 h后的检测中,并未出现ACCETTOLA等[17]观察到的RE显著升高现象。
3.2 循环营养液流速对BTF系统性能的影响在BTF系统内,循环营养液不仅能将微生物代谢产物从填料层上的生物膜内冲洗出来,避免代谢产物积累造成的反馈抑制;还可为生物膜中微生物提供营养和适宜的生存环境[20-21];但是生物膜表面的液相流动,也为VOCs从气相进入生物膜内增添了屏障[22],因此LRR的大小对BTF系统性能有着重要影响。另外对于BTF体系,虽然其空塔气速可高达6 000 m·h−1,但LRR常小于10 m·h−1 [23]。本研究中分别在不同Ci条件下,考察了LRR在1.1~13.6 m·h−1时RE的变化规律(图 3)。
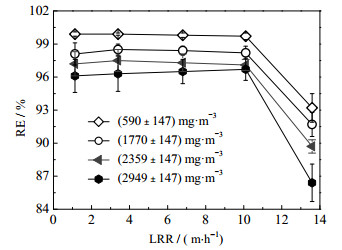
|
图 3 不同VOCs进口浓度下循环营养液流速对VOCs降解效率的影响 Fig.3 Effects of liquid flow rates on VOCs removal efficiency at different VOCs inlet concentrations |
当LRR≤10.2 m·h−1时,VOCs的RE不受LRR影响;另外,即使Ci增加到(2 949±147) mg·m-3时,RE仍能维持在96%以上。当LRR达到13.6 m·h−1时,BTF-1底部填料层开始出现泡沫,同时在BTF-1塔内,可以明显地看到有小块生物膜被冲刷下来,RE迅速下降。此时RE的下降主要由3个因素引起:(1) BTF-1底部填料层出现的泡沫降低了塔内的气-液传质速率,导致RE下降;(2)增大LRR会导致BTF系统内(BTF-1最为显著)部分生物膜从填料层上脱落下来,引起RE下降[24];(3)增大LRR也会导致生物膜表面的液膜厚度过大,增大了气-液传质屏障,同时在塔内出现了液体沟流,引起RE下降[25-26]。此外,关于LRR对BTF性能的影响有诸多报道(表 1),但各研究结论并不一致。
|
|
表 1 文献报道中循环液体流速对RE的影响 Table 1 Effects of liquid recirculation rate on RE in literatures |
CHOU等[19]在利用BTF处理甲乙酮的研究中发现,Ci不同时,LRR对BTF脱除效率影响也随之改变;CHOU等认为对于水溶性污染物,当Ci不高,循环营养液中仅有微量污染物残存时,LRR对RE的影响非常微弱;当Ci非常高时,较大的LRR会导致污染物在循环营养液中积累,并由气提作用重新进入气相中,导致BTF的Co增高,RE降低。然而MIRMOHAMMADI等[27-28]在利用BTF降解水溶性污染物三乙胺(triethylamine, TEA)的研究中,在高Ci下得到了与CHOU等截然相反的结论,但在较低Ci下,MIRMOHAMMADI等的试验结果与CHOU等的结论一致。
综合CHOU和MIRMOHAMMADI等的研究结果,可以得出:在污染物Ci较低时,LRR对RE没有影响。HARTMANS等[29]研究BTF降解二氯甲烷(dichloromethane, DCM)时发现,当EBRT为11 s,Ci维持在低值347 mg·m-3,LRR从3.0增大至15.1 m·h−1时,DCM的RE随着LRR的增加呈线性增长趋势。另外,CHOU等[30]在利用BTF降解疏水性污染物苯乙烯的研究中,却得到了与上述报道均不相同的结果:当停留时间为9 s,Ci高达1 365 mg·m-3时,LRR由3.84增大至9.60 m·h-1,LRR对RE没有影响;维持EBRT不变,进一步提高Ci至2 270~2 546 mg·m-3时,LRR由3.84增大至9.60 m·h-1,RE也随之增大。
RAMIREZ等[31]在研究不同填料类型对BTF降解CH4性能的影响中发现,在其他操作参数均保持不变的条件下,填料类型不同,LRR对RE的影响也不相同。但CAICEDO等[32]在研究不同填料类型对BTF降解甲苯(methylbenzene, MB)和乙苯(ethylbenzene, EB)性能的影响中发现,在其他操作参数均保持不变的条件下,即使填料类型不同,LRR对RE的影响也趋于一致。另外,在BTF降解无机污染物的研究中,现有文献关于LRR对RE的影响也不尽相同[33-37]。
尽管众多学者在研究LRR与BTF脱除效率关系规律中得出了不同结论,但大家关于LRR影响BTF脱除效率的机理认识是统一的。增大LRR对BTF脱除效率的促进作用主要包括:(1)提高LRR可以增加BTF内气-液传质面积;(2)可以增加污染物在BTF内的液相传质系数,同时提高气-液传质速率;(3)可以冲洗掉填料层生物膜表面的死细胞,从而提高液相中污染物与生物膜的有效传质面积;(4)可以冲洗掉填料层上微生物的代谢产物,解除代谢产物抑制。而增大LRR对BTF脱除效率的抑制作用主要包括:(1)提高LRR会增加生物膜表面的液膜厚度,从而增大气液传质屏障;(2)会堵塞BTF内的气体通道,还会引起液体沟流,从而降低气-液传质面积;(3)会将BTF内填料层上的生物膜冲刷下来,导致BTF的RE下降;(4)当BTF内循环营养液中污染物积累时,过高的LRR会导致污染物从液相中解吸出来,进入气相中,引起RE下降。
另外,从表 1中可以看出在BTF系统内,污染物种类、填料类型、生物膜组成、气液流动方式、进口浓度、EBRT等参数会影响LRR与RE之间的规律,而且不同参数与LRR之间有着复杂的相互作用关系,最终共同影响BTF的性能[36],BTF系统内存在的这种多参数相互作用,也证明了对BTF运行参数进行优化的必要性。
3.3 鼠李糖脂对LRR与RE关系规律的影响在研究LRR对BTF脱除效率影响过程中,作者发现当LRR达到13.6 m·h−1时,BTF-1底部填料开始出现泡沫;进一步增大LRR,BTF-1填料层会充满泡沫,BTF-2塔釜和填料层底部也开始出现泡沫,导致RE快速下降(图 3)。根据文献报道,即使LRR达到20 m·h−1时[32],也未发现类似现象。采用16S rDNA技术研究BTF内微生物沿填料层轴向分布规律时发现,BTF-1内的微生物种类约有200种,但其中20%以上为铜绿假单胞菌(Pseudomonas aeruginosa, P. aeruginosa),BTF-2内也有约1%的P. aeruginosa存在。P. aeruginosa能够分泌一种生物表面活性剂——鼠李糖脂[38],因此当LRR过高时,塔内大量泡沫的产生可能与鼠李糖脂的存在有关。
为验证BTF系统内是否有鼠李糖脂存在,根据前期的研究方法[15],利用HPLC-MS对BTF系统内循环营养液的CHCl3-CH3OH萃取物进行了检测。分别在19.95、24.78、33.53和38.12 min的洗脱时间得到了4种类型的鼠李糖脂:Rha‒Rha‒C10、Rha‒Rha‒C8‒C8、Rha‒C10‒C8和Rha‒C10‒C12:1。图 4为洗脱时间为38.12 min的Rha‒C10‒C12:1。其中m/z 529为Rha‒C10‒C12:1的准分子离子峰;m/z 195为C12:1脂肪酸失H后的碎片离子峰;m/z 169为Rha的碎片离子峰;m/z 365的碎片离子峰为Rha‒C10‒C12:1丢失Rha分子引起的;m/z 333为Rha‒C10‒C12:1丢失C12:1脂肪酸分子引起的。
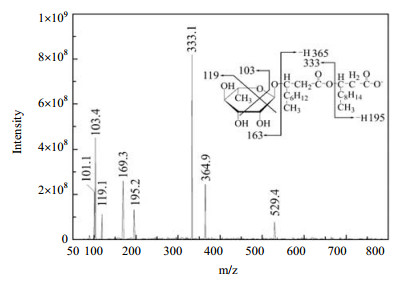
|
图 4 鼠李糖脂Rha‒C10‒C12:1的质谱图及其结构 Fig.4 Mass spectrum and structure of Rha‒C10‒C12:1 |
异丁醛在BTF系统内完成降解,首先需从气相进入液相中,然后才能被生物膜捕获降解[10]。因此,气体的EBRT会影响异丁醛的气-液传质过程,从而影响其降解效果。
本研究中BTF系统对异丁醛的RE和EC值随EBRT变化如图 5所示。随着EBRT的增加,BTF系统RE值逐渐升高,但EC值不断减小。当EBRT为40 s时,RE在77%左右,此时BTF系统EC为158 g·m-3·h-1;当EBRT增至397 s时,RE达到最大值99.6%左右,但由于此时IL较低,EC仅为20 g·m-3·h-1。由此表明,随着EBRT的增加,尽管BTF系统降解异丁醛的效率不断增加,但BTF系统的EC是呈下降趋势。
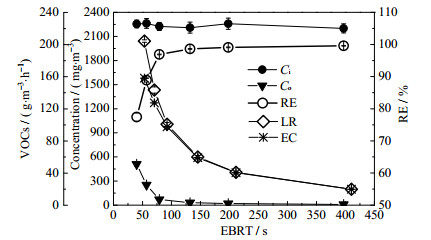
|
图 5 EBRT对BTF系统性能的影响 Fig.5 Effects of EBRT on the performance of BTFs |
此外,本研究中考察EBRT对BTF系统性能影响是从BTF系统启动后的第31 d开始,后来在对BTF系统压降∆p进行整理时发现,在相同操作参数下,第49 d的BTF的∆p约为第33 d的1.6倍。由此表明,在考察EBRT对BTF系统性能影响期间,BTF系统内的生物膜仍处于不断生长阶段,一方面导致∆p升高[39],同时也提高了BTF系统的性能。因此,在第50 d当EBRT增加至397 s时,RE达到前所未有的高值99.6%。由图 5还可以看出,随着EBRT的增加,RE曲线上升的斜率越来越小。根据双模理论,在BTF系统内VOCs透过液膜的传质速率方程如式(4)所示:
| $ N = {K_{\rm{L}}} \times (\frac{{{C_G}}}{m} - {C_{\rm{L}}}) $ | (4) |
式中:N为异丁醛的传质速率,KL为液相传质系数,CG为异丁醛在气相中的浓度;CL为异丁醛在液相中的浓度;m为异丁醛的相平衡常数。由于CG ≈ Ci,故随着气体在塔内停留时间的增加,气相内的异丁醛浓度CG越来越小,导致异丁醛的气-液传质推动力(CG/m ‒ CL)也越来越小,异丁醛进入液相的传质速率变慢,因此RE增长速率也随之变慢。
SERCU等[12]报道了好氧生物滤池降解异丁醛的研究,其最大EC值为70.6 g·m-3·h-1。LUVSANJAMBA等[16]研究了不同温度下BTF降解异丁醛效果,研究发现EC随着温度的升高逐渐增大,即在25 ℃下运行的BTF,其ECmax为97 g·m-3·h-1;在52 ℃下运行的BTF,其ECmax为139 g·m-3·h-1;且LUVSANJAMBA等认为,常温BTF系统内微生物过量繁殖、泡沫产生以及酸化是导致EC降低的主要原因。综合上述研究可知,BTF降解异丁醛的能力明显优于生物滤池;且在本研究中常温BTF系统的ECmax为158 g·m-3·h-1,明显高于LUVSANJAMBA等研究中BTF的ECmax。在利用BTF降解能源气中D4研究时曾发现鼠李糖脂能够提高BTF性能[15],因此本研究中BTF表现出较高的ECmax可能与鼠李糖脂有关。
另外,与LUVSANJAMBA等[16]的研究结果不同,本研究仅在LRR较大时,发现BTF系统有泡沫产生;且仅在BTF-1中发现酸化现象(图 6中pH-1),在不添加碱液时,BTF-1塔pH由6.9降至5.5;但是BTF-2的pH则稳定在6.4~6.9(图 6中pH-2)。同时从图 6中可以看出,随着时间推移,∆p呈上升趋势,表明BTF系统内生物膜不断繁殖[39]。由于BTF系统内微生物过量繁殖,BTF-2塔在第85 d发生液泛。随后作者将BTF-2塔更换新的火山岩填料,并在第87 d重新启动BTF系统,最终BTF-1塔在150 d也发生了液泛。但在液泛之前,并未发现微生物过量生长导致BTF系统EC明显下降的现象。
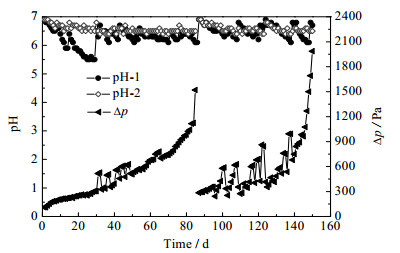
|
图 6 BTF系统pH和∆p随时间的变化趋势 Fig.6 Variation of pH and ∆p as a function of time |
(1) LRR对BTF性能的影响与污染物种类、填料类型、生物膜组成、气液流动方式、进气浓度、EBRT等参数均存在关联;本研究中当LRR不大于10.2 m·h−1时,BTF的RE不受LRR影响。
(2) BTF系统中的鼠李糖脂能够增加气-液传质速率,从而提高BTF降解异丁醛的能力,但当LRR大于13.6 m·h−1时,鼠李糖脂会导致BTF系统内出现大量泡沫,造成BTF系统性能的下降。
(3) 增大EBRT有利于提高BTF系统降解异丁醛的效率,但随着EBRT的不断增大,RE上升速率越来越慢;同时,BTF系统的EC值也不断变小。
(4) 本研究中BTF系统并未出现LUVSANJAMBA等报道的泡沫、显著酸化(仅在BTF-1中发现pH降低)等情况,但BTF系统微生物过度繁殖导致了液泛的发生;而在液泛之前,微生物过量繁殖并未造成BTF系统性能明显下降。
|
|
符号说明: |
| [1] |
CHEN X, QIAN W, KONG L, et al. Performance of a suspended biofilter as a new bioreactor for removal of toluene[J]. Biochemical Engineering Journal, 2015, 98: 56-62. DOI:10.1016/j.bej.2015.02.025 |
| [2] |
MUSTAFA M F, FU X, LIU Y, et al. Volatile organic compounds (VOCs) removal in non-thermal plasma double dielectric barrier discharge reactor[J]. Journal of Hazardous Materials, 2018, 347: 317-324. DOI:10.1016/j.jhazmat.2018.01.021 |
| [3] |
CHEN H L, LEE H M, CHEN S H, et al. Removal of volatile organic compounds by single-stage and two-stage plasma catalysis systems: a review of the performance enhancement mechanisms, current status, and suitable applications[J]. Environmental Science & Technology, 2009, 43(7): 2216-2227. |
| [4] |
WANG H, TANG M, ZHANG K, et al. Functionalized hollow siliceous spheres for VOCs removal with high efficiency and stability[J]. Journal of Hazardous Materials, 2014, 268: 115-123. DOI:10.1016/j.jhazmat.2013.12.070 |
| [5] |
HUANG Y, HO S S H, LU Y, et al. Removal of indoor volatile organic compounds via photocatalytic oxidation: A short review and prospect[J]. Molecules, 2016, 21(56): 1-20. |
| [6] |
GONZÁLEZ-SÁNCHEZ A, REVAH S, DESHUSSES M A. Alkaline biofiltration of H2S odors[J]. Environmental Science & Technology, 2008, 42(19): 7398-7404. |
| [7] |
RAMIREZ M, GÓMEZ J M, AROCA G, et al. Removal of hydrogen sulfide and ammonia from gas mixtures by co-immobilized cells using a new configuration of two biotrickling filters[J]. Water Science and Technology, 2009, 59(7): 1353-1359. DOI:10.2166/wst.2009.105 |
| [8] |
GBRIEL D, DESHUSSES M A. Retrofitting existing chemical scrubbers to biotrickling filters for H2S emission control[J]. Proceedings of the National Academy of Sciences, 2003, 100(11): 6308-6312. DOI:10.1073/pnas.0731894100 |
| [9] |
KRAAKMAN N J R, ROCHA-RIOS J, VAN L M C M. Review of mass transfer aspects for biological gas treatment[J]. Applied Microbiology and Biotechnology, 2011, 91(4): 873-886. DOI:10.1007/s00253-011-3365-5 |
| [10] |
徐百龙, 夏银锋, 王向前, 等. 硅油对生物滴滤塔处理邻二甲苯废气的影响[J]. 高校化学工程学报, 2014, 28(5): 1154-1159. XU B L, XIA Y F, WANG X Q, et al. Effect of silicone oil on the removal of o-Xylene from waste gases in biotrickling filters[J]. Journal of Chemical Engineering of Chinese Universities, 2014, 28(5): 1154-1159. |
| [11] |
VAN G L J. Compilations of odour threshold values in air, water and other media (second enlarged and revised edition)[M]. Utrecht: Oliemans Punter & Partners BV, 2011.
|
| [12] |
SERCU B, DEMEESTERE K, BAILLIEUL H, et al. Degradation of isobutanal at high loading rates in a compost biofilter[J]. Journal of the Air & Waste Management Association, 2005, 55(8): 1217. |
| [13] |
SCHAEFFER T L, CANTWELL S G, BROWN J L, et al. Microbial growth on hydrocarbons: Terminal branching inhibits biodegradation[J]. Applied and Environmental Microbiology, 1979, 38(4): 742-746. DOI:10.1128/AEM.38.4.742-746.1979 |
| [14] |
FRITSCHE W, HOFRICHTER M. Aerobic degradation by microorganisms[M]. New York: John Wiley & Sons, 2000.
|
| [15] |
LI Y H, ZHANG W J, XU J. Siloxanes removal from biogas by a lab-scale biotrickling filter inoculated with Pseudomonas aeruginosa S240[J]. Journal of Hazardous Materials, 2014, 275: 175-184. DOI:10.1016/j.jhazmat.2014.05.008 |
| [16] |
LUVSANJAMBA M, SERCU B, KERTÉSZ S, et al. Thermophilic biotrickling filtration of a mixture of isobutyraldehyde and 2-pentanone[J]. Journal of Chemical Technology & Biotechnology, 2007, 82(1): 74-80. |
| [17] |
ACCETTOLA F, GEORG M G, SCHOEFTNER R. Siloxane removal from biogas by biofiltration: Biodegradation Studies[J]. Clean Technologies & Environmental Policy, 2008, 10(2): 211-218. |
| [18] |
FORTUNY M, BAEZA J A, GAMISANS X, et al. Biological sweetening of energy gases mimics in biotrickling filters[J]. Chemosphere, 2008, 71(1): 10-17. DOI:10.1016/j.chemosphere.2007.10.072 |
| [19] |
CHOU M S, HUANG J J. Treatment of methylethylketone in air stream by biotrickling filters[J]. Journal of Environmental Engineering, 1997, 123(6): 569-576. DOI:10.1061/(ASCE)0733-9372(1997)123:6(569) |
| [20] |
VIKROMVARASIRI N, CHAMPREDA V, BOONYAWANICH S, et al. Hydrogen sulfide removal from biogas by biotrickling filter inoculated with Halothiobacillus neapolitanus[J]. International Journal of Hydrogen Energy, 2017, 42(29): 18425-18433. DOI:10.1016/j.ijhydene.2017.05.020 |
| [21] |
XUE N, WANG Q, WANG J, et al. Odorous composting gas abatement and microbial community diversity in a biotrickling filter[J]. International Biodeterioration & Biodegradation, 2013, 82: 73-80. |
| [22] |
KRAAKMAN N J R, ROCHA-RIOS J, VAN L M C M. Review of mass transfer aspects for biological gas treatment[J]. Applied Microbiology and Biotechnology, 2011, 91(4): 873-886. DOI:10.1007/s00253-011-3365-5 |
| [23] |
KIM S, DECHUSSES M A. Determination of mass transfer coefficients for packing materials used in biofilters and biotrickling filters for air pollution control—2: Development of mass transfer coefficients correlations[J]. Chemical Engineering Science, 2008, 63(4): 856-861. DOI:10.1016/j.ces.2007.10.021 |
| [24] |
MPANIAS C J, BALTZIS B C. Biocatalytic removal of mono-chlorobenzene vapor in trickling filters[J]. Catalysis Today, 1998, 40(1): 113-120. DOI:10.1016/S0920-5861(97)00129-6 |
| [25] |
CHEN J M, JIANG L Y, SHA H L. Removal efficiency of high-concentration H2S in a pilot-scale biotrickling filter[J]. Environmental Technology, 2006, 27(7): 759-766. DOI:10.1080/09593332708618687 |
| [26] |
KIM S, DESHUSSES M A. Understanding the limits of H2S degrading biotrickling filters using a differential biotrickling filter[J]. Chemical Engineering Journal, 2005, 113(2/3): 119-126. |
| [27] |
MIRMOHAMMADI M, SOTOUDEHEIAN S, BAYAT R. Triethylamine removal using biotrickling filter (BTF): Effect of height and recirculation liquid rate on BTFs performance[J]. International Journal of Environmental Science and Technology, 2017, 14(8): 1615-1624. DOI:10.1007/s13762-017-1273-7 |
| [28] |
MEHRDADI N, AZIMI A, MIRMOHAMMADI M. Removal of triethylamine vapor from waste gases by biotrickling filter[J]. Journal of Environmental Health Science & Engineering, 2010, 7(4): 337-334. |
| [29] |
HARTMANS S, TRAMPER J. Dichloromethane removal from waste gases with a trickle-bed bioreactor[J]. Bioprocess Engineering, 1991, 6(3): 83-92. DOI:10.1007/BF00369060 |
| [30] |
CHOU M S, HSIAO C C. Treatment of styrene-contaminated airstream in biotrickling filter packed with slags[J]. Journal of Environmental Engineering, 1998, 124(9): 844-850. DOI:10.1061/(ASCE)0733-9372(1998)124:9(844) |
| [31] |
RAMIREZ A A, JONES J P, HEITZ M. Methane treatment in biotrickling filters packed with inert materials in presence of a nonionic surfactant[J]. Journal of Chemical Technology & Biotechnology, 2012, 87(6): 848-853. |
| [32] |
CAICEDO F, ESTRADA J M, SILVA J P, et al. Effect of packing material configuration and liquid recirculation rate on the performance of a biotrickling filter treating VOCs[J]. Journal of Chemical Technology & Biotechnology, 2018, 93(8): 2299-2306. |
| [33] |
CHAIPRAPAT S, CHARNNOK B, KANTACHOTE D, et al. Bio-desulfurization of biogas using acidic biotrickling filter with dissolved oxygen in step feed recirculation[J]. Bioresource Technology, 2015, 179: 429-435. DOI:10.1016/j.biortech.2014.12.068 |
| [34] |
FORTUNY M, GAMISANS X, DESHUSSES M A, et al. Operational aspects of the desulfurization process of energy gases mimics in biotrickling filters[J]. Water Research, 2011, 45(17): 5665-5674. DOI:10.1016/j.watres.2011.08.029 |
| [35] |
CHARNNOK B, SUKSAROJ T, BOONSWANG P, et al. Oxidation of hydrogen sulfide in biogas using dissolved oxygen in the extreme acidic biofiltration operation[J]. Bioresource Technology, 2013, 131: 492-499. DOI:10.1016/j.biortech.2012.12.114 |
| [36] |
ABDEHAGH N, NAMINI M T, BONAKDARPOUR B, et al. Effect of operating parameters on the performance of a Thiobacillus thioparus-immobilized polyurethane foam biotrickling filter for hydrogen sulfide removal[J]. CLEAN–Soil, Air, Water, 2014, 42(9): 1311-1317. DOI:10.1002/clen.201300003 |
| [37] |
JIN Y, VEIGA M C, KENNES C. Autotrophic deodorization of hydrogen sulfide in a biotrickling filter[J]. Journal of Chemical Technology & Biotechnology, 2005, 80(9): 998-1004. |
| [38] |
DU J, ZHANG A, ZHANG X, et al. Comparative analysis of rhamnolipid congener synthesis in neotype Pseudomonas aeruginosa ATCC 10145 and two marine isolates[J]. Bioresource Technology, 2019, 286: 121380. DOI:10.1016/j.biortech.2019.121380 |
| [39] |
OKKERSE W J H, OTTENGRAF S P P, OSINGA-KUIPERS B, et al. Biomass accumulation and clogging in biotrickling filters for waste gas treatment. Evaluation of a dynamic model using dichloromethane as a model pollutant[J]. Biotechnology and Bioengineering, 1999, 63(4): 418-430. DOI:10.1002/(SICI)1097-0290(19990520)63:4<418::AID-BIT5>3.0.CO;2-0 |




