2. 浙江大学 工业控制技术国家重点实验室, 浙江 杭州 310027
2. State Key Laboratory of Industrial Control Technology, Zhejiang University, Hangzhou 310027, China
环己醇、环己酮(两者混合物俗称KA油)是生产己内酰胺的原料,己内酰胺可进一步合成高分子材料尼龙-6,世界上90%以上的KA油都是采用环己烷氧化反应制备的,因此环己烷的氧化反应是一类十分重要的化学反应[1~4]。目前,工业上采用液相环己烷与空气或氧气与氮气的混合气体(氧气浓度小于21%)作为反应物进行环己烷的液相氧化反应,反应首先为环己烷直接被空气氧化为环己酮、环己醇和环己基过氧化氢等,然后剩余的环己基过氧化氢在碱性条件下分解为环己醇、环己酮等产物,其中环己醇和环己酮是目标产物。为了增大环己醇与环己酮的产率,现有的反应器一般采取串联的搅拌釜反应器或者串联的鼓泡塔反应器。由于此工艺需要大型设备,投入较大,且由于单程转化率低(约4%),选择性差(约80%),大量未反应的环己烷与产物分离后需循环利用,操作费用与能耗较大。对于一般的釜式反应器,反应时间一般工业上为1 h,对于工业上采用的钴盐的工艺来说,反应时间也至少要10 min[5~8]。另外,还存在中间产物环己基过氧化氢分解工段产生大量废液,环境污染严重,在生产过程中,由于反应器的比表面积小、散热差,还存在爆炸的隐患。虽然国内外对于环己烷氧化反应的优化进行了不懈的探索,并在催化剂的研发方面也取得了大量的成果[9~12],但至今在无催化下的环己烷选择性氧化仍然受到研究者的广泛关注。
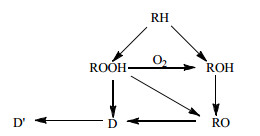
近年来,微反应器的研究和应用热度持续增长。与传统反应器相比,微反应器中的传质、传热得到了很大的加强,这促使研究人员在实验中使用微反应器,同时一些小规模的工业生产中也开始使用微反应器[13]。微管是横向尺寸小于2.5 mm的毛细管或微通道,微管反应器属于微反应器中的一种。与传统反应器相比,微管的横向尺寸小,使得管内流体与壁面之间的传热得到强化,能有效地移走反应中积聚的热量,避免热点和链式爆炸的出现,防止飞温,反应更加安全;同时微管的比表面积大,横向尺寸上的质量传递也得到强化,使得多相反应得到加强[14]。在现有的文献研究中,Fischer等[15]曾经考察过不同内径的不锈钢微管中的环己烷氧化反应,指出了由于微管内反应的传质没有对反应造成限制,环己烷与氧气的气液平衡处处存在,可以用作环己烷氧化的本征动力学研究,并取得了一定的研究成果。Pohorecki等[16]提出的环己烷氧化的简化机理如图 1所示,其中RH表示环己烷,ROOH表示环己基过氧化氢,ROH表示环己醇,RO表示环己酮,D表示己二酸,D’表示己二酸环己酯。然而现有的文献中很少对微管反应的具体工艺条件进行考察。因此本文尝试将微管应用于环己烷的无催化氧化,采用氧气作为氧化剂,考察不同工艺条件,包括反应温度、反应压力、气液摩尔比和反应停留时间等对环己烷氧化性能及产物分布的影响。
2 实验部分 2.1 化学试剂及原料环己烷(99.5%),杭州双林化工试剂厂;氧气(99.5%),杭州今工特种气体有限公司;正庚烷(98.5%),上海凌峰化学试剂有限公司;异丙醇(99.7%),国药集团化学试剂有限公司;硫代硫酸钠(99.0%),浙江杭州萧山化学试剂厂;碘化钾(98.5%),杭州化学试剂有限公司;可溶性淀粉,浙江湖州食品化工联合公司;冰乙酸(99.5%),国药集团化学试剂有限公司;氢氧化钠(96%),杭州萧山化学试剂厂;试剂均为分析纯。
2.2 实验仪器平流泵(2PB0540,2PB-30),北京卫星制造厂;气体质量流量控制器(D07-19B),北京七星华创电子股份有限公司;气液微混合器(SIMM-V2),德国美因茨研究所;流量显示仪(D08-4F),北京七星华创电子股份有限公司;背压阀(SS-91),北京熊川科技有限公司;不锈钢微反应管内径1 mm,长度5 m,壁厚0.5 mm。
2.3 微管内环己烷氧化性能评价微管内环己烷氧化性能评价装置见文献[17],其流程为:环已烷储罐中的环已烷通过平流泵;氧气钢瓶中的氧气经过氧气减压阀、过滤器、质量流量控制器及单向阀后,与环已烷以一定比例,进入气液微混合器混合、混合之后的气液以平推流进入微管反应器。为保证进入不锈钢微管的环己烷能够达到反应温度,将气液混合器置于油浴装置进行预热。预热之后的气液混合物进入置于空气恒温箱的不锈钢微管进行反应。由于环己烷氧化制环己醇与环己酮过程中,会产生己二酸等副产物遇冷易结晶,为此加入异丙醇与从微管流出的反应产物混合,淬灭反应的同时也能溶解反应产生的己二酸防止副产物堵塞后续的管道。反应压力通过背压阀控制,加入异丙醇后的反应产物流经过滤器、背压阀之后进入气液分离器进行分离,液相产物收集至产物罐中,气相排空。
2.4 环己烷氧化产物分析方法环己醇和环己酮在GC-1690型气相色谱仪上进行分析,色谱柱为SE-54型(0.30 mm×30 m)毛细管柱,氢焰检测器,以正庚烷作为内标物进行定量计算。由于样品中环己基过氧化氢在高温进样时易于分解生成环己酮和环己醇,从而显著影响选择性的分析结果,因此采用三苯基膦将环己基过氧化氢完全分解后进行分析。用碘滴定的方式测定环己基过氧化氢的含量,并用碱滴定的方式测定己二酸的含量,然后采用皂化并且用酸反滴定的方法测量产物中酯的含量。
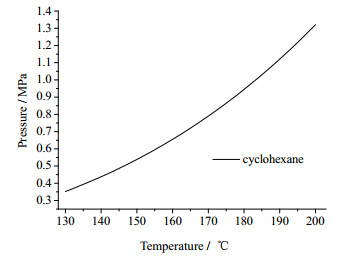
3 结果与讨论 3.1 反应温度对反应的影响环己烷饱和蒸汽压随温度的变化关系如图 2所示(来自Aspen Plus物性计算)。
|
图 2 环己烷饱和蒸汽压随温度的变化关系 Fig.2 Cyclohexane vapor pressure as a function of temperature |
由图可以看出,在130~200℃,环己烷以部分液体的状态存在的,反应是在气-液两相内进行,因此该反应是多相反应,不是均相反应。
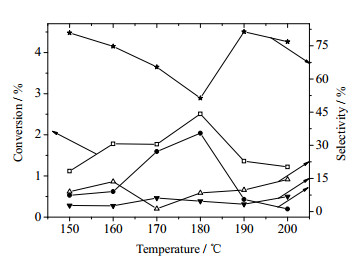
在反应压力为1.5 MPa,氧气和环己烷的摩尔比为0.3:1,反应停留时间为2 min时,反应温度对反应结果的影响,结果可见图 3,图中CyH、CyOH、CyO分别为环已烷、环已醇和环已硐。
|
图 3 反应温度对环己烷氧化的影响 Fig.3 Effects of reaction temperature on cyclohexane oxidation |
可以看出,环己烷的转化率随着反应温度的升高呈现出先增大后减小的趋势。当温度小于180℃时,环己烷的转化率随温度升高而升高,这是因为此时温度对反应速率的影响要大于气体分压对环己烷转化的影响,在相同的停留时间条件下,环己烷的转化率随温度增加而增大;而当温度大于180℃时,因为环己烷的氧化反应过程是在液相中进行的,随着反应温度的升高,更多环已烷气化进入气相中,液相中的环已烷减少,不利于反应的进行,因此环己烷的转化率此时随温度升高而减小。环己醇和环己酮的选择性在相同的停留时间内随温度升高而先增大后减小,环己基过氧化氢(CHHP)则先减小后增大,这可能是因为对于2min的停留时间来说,在温度小于170℃时,环己基过氧化氢的分解速率大于其生成速率,而分解产生的环己酮越多也越有利于己二酸(AA)的生成;在温度大于170℃时,环己基过氧化氢的生成速率大于其分解速率,因此环己基过氧化氢的选择性升高;在200℃时,环己醇可能会随温度升高而加快氧化的速率,因此环己酮的选择性上升,间接导致了己二酸选择性上升。具体的变化原因有待进一步的反应动力学研究,考虑到转化率和选择性两方面的原因,选择180℃进行下一步的研究。
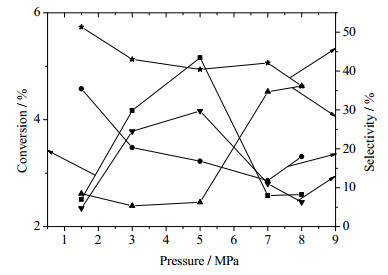
3.2 反应压力对反应的影响在反应温度为180℃,氧气和环己烷的摩尔比为0.3:1,反应停留时间为2 min时,反应压力对反应结果的影响可见图 4。
|
图 4 反应压力对环己烷氧化的影响 Fig.4 Effects of reaction pressure on cyclohexane oxidation ■ CyH ● CyOH ★CyO ▲CHHP ▼AA |
可以看出,在压力小于5 MPa时,环己烷的转化率随压力的增大而升高,最高可达5.16%;环己醇和环己酮的选择性随着压力的升高而降低;己二酸的选择性随着压力的增大而升高;环己基过氧化氢的选择性一直维持在5%~8%,变化不大,这说明在压力小于5 MPa时,压力对于反应的影响一直是向着减小分子数量的方向进行的。对于环己烷氧化的整个体系而言,氧化的程度越深,消耗的氧气越多,气相分子数越小,因此压力的升高会增大环己烷的转化率并升高己二酸的选择性。但是当压力大于7 MPa时,反应的结果发生了突变,环己烷的转化率和己二酸的选择性相比5 MPa时有了明显的降低,环己基过氧化氢的选择性则有了明显的升高。通过Aspen的模拟可知,在该气液摩尔比条件下,当反应压力升高到7 MPa时,反应体系中的氧气会完全溶于环己烷中,形成只有一相的流体,也就是说在此时体系的流动状态和反应状态都发生了很大的变化。可以看出,在7 MPa到8 MPa时,环己烷的转化率有所下降但变化不是很大,可能是氧气完全进入环己烷后流型变化对环己烷的转化造成了抑制,KA油的选择性没有明显的变化,而环己基过氧化氢的选择性有所升高,己二酸选择性下降,这是因为在只有一相的条件下,更加有利于氧气分子和环己烷分子碰撞形成自由基,在2 min的停留时间内,大量积累的自由基还来不及分解形成环己醇和环己酮,也就不利于己二酸的生成,也就是说,当压力大于7 MPa时,控制反应停留时间,能够有效抑制副反应的发生。但是考虑到操作的安全和便利性,并综合考虑反应的选择性和转化率,还是采用1.5 MPa进行下一步的研究。
3.3 气液摩尔比对反应的影响在反应温度为180℃,反应压力为1.5 MPa,反应停留时间为2 min时,氧气和环己烷的摩尔比对反应结果的影响可见图 5。据图可知,环己烷转化率总体在1.2%~2.6%,KA油的选择性随气液摩尔比的升高先增大,在摩尔比大于0.5后基本不变,环己基过氧化氢的选择性随气液摩尔比的增大先减小后略有增大,己二酸的选择性随气液摩尔比的增大而减小。氧气与环己烷的摩尔比不同,环己烷氧化反应速率不同,且氧气与环己烷的摩尔比不同导致环己烷与氧气在管中的气液流动形式不同,在一定的摩尔比下能形成良好的气液泰勒流动,而在某些摩尔比下则气液流动状况较差,气液之间的接触面积变小,严重影响环己烷氧化反应中的气液传质情况。在停留时间较短时,对于转化率的影响可能还不那么明显,但是对于产物分布的影响已经可以较为明显地看出来。在2 min以内环己烷的转化率随着氧气与环己烷的摩尔比的增大而减小的原因是短时间氧气的耗量不大,所以短停留时间内影响环己烷氧化反应的主要因素是环己烷与氧气的接触面积,当氧气与环己烷摩尔比为0.15:1时,气液之间气泡与液柱较短,即接触面积较大,有利于环己基过氧化氢的生成,而当摩尔比大于0.5:1时,气泡与液柱的接触面积大体不变,而此时的停留时间较短,氧气比例增大有助于环己基过氧化氢增加,并且环己醇和环己酮还来不及被更进一步氧化生成己二酸,因此己二酸的选择性略有下降。随着停留时间的增长,反应进一步进行,氧气比例较高将会使环己烷的转化率增大,但是比例较高时大部分氧气未被消耗需要外排,造成资源浪费的同时也会造成一定的安全隐患。因此选择气液摩尔比为0.3:1来进行下一步的研究。综合考虑环己烷的转化率和产物选择性的因素,在反应温度为180℃,反应压力为1.5 MPa,反应停留时间为2 min时,适合的气液摩尔比为0.3。
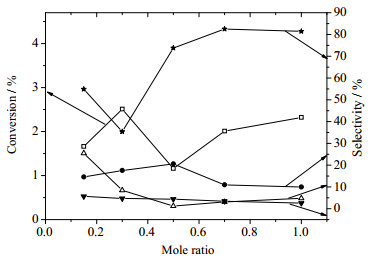
|
图 5 气液摩尔比对环己烷氧化的影响 Fig.5 Effects of gas to liquid molar ratio on cyclohexane oxidation □CyH ● CyOH ★CyO △CHHP ▼AA |
在反应温度为180℃,反应压力为1.5 MPa,氧气和环己烷的摩尔比为0.3:1时,反应的停留时间对反应结果的影响可见图 6。
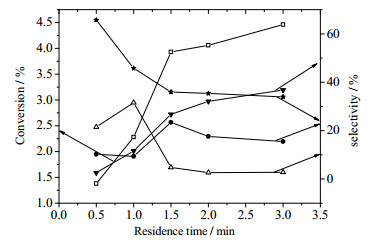
|
图 6 停留时间对环己烷氧化的影响 Fig.6 Effects of residence time on cyclohexane oxidation □CyH ● CyOH ★ CyO △CHHP ▼ AA |
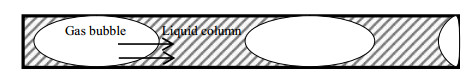
|
图 7 微管中环己烷氧化反应质量传递模型示意图 Fig.7 Schematic diagram of mass transfer of cyclohexane oxidation in amicro tube |
停留时间τ定义为微管体积V与反应管内环己烷流量vL及氧气流量vG总和之比,
| $ \tau = \frac{V}{{{v_{\rm{L}}} + {v_{\rm{G}}}}} $ |
其中气体和液体的流速均为该反应条件下的入口流速。可以看出,环己烷的转化率随着停留时间的增长而增大,最高4.46%;环己酮的选择性随着停留时间的增长而呈现出下降趋势,最大65.71%,最小33.94%;环己醇的选择性先增大后减小,最大值为23.39%;己二酸的选择性随时间的增长而增大,最大36.78%;环己基过氧化氢随时间增长选择性先增大后减小并维持一个相对稳定的水平,当反应停留时间只有0.5 min时,环己醇、环己酮和环己基过氧化氢的选择性之和甚至可以达到97.40%。环己烷的氧化反应过程是一个自由基反应的过程,氧气先与环己烷反应生成环己基过氧化氢,环己基过氧化氢再分解成为环己醇和环己酮,环己酮进一步氧化生成己二酸。其中环己基过氧化氢的积累过程也是液相中自由基大量累积的过程,可以视为反应的诱导期;在反应的诱导期过后,反应中的总自由基数量基本稳定,环己基过氧化氢的选择性基本不变,但是环己酮被氧化成为己二酸,因此己二酸的选择性随时间增长而上升。如果反应时间继续延长,有可能生成更多的二酸类与酯类副产物,甚至继续氧化生成二氧化碳、水等最终副产物。综合考虑转化率与选择性的因素,在反应温度为180 ℃,压力1.5 MPa,氧气与环己烷的摩尔比为0.3:1时,最佳的停留时间为1.5 min左右,采用2 min只是因为实验设计上的原因。
4 结论采用氧气作为氧化剂,将微管应用于环己烷的无催化氧化,考察内径1 mm,长度5 m的不锈钢微管内环己烷氧化反应的性能,并考察了不同工艺条件,包括反应温度、反应压力、气液摩尔比和反应停留时间对环己烷氧化性能的影响,发现微管反应器对于环己烷选择性氧化生成环己醇和环己酮有很好的效果,在180℃,压力1.5 MPa,氧气与环己烷的摩尔比为0.3:1,停留时间为1.5 min时,环己烷的转化率为3.93%,环己醇的选择性为23.39%,环己酮的选择性为35.95%,己二酸的选择性为26.71%,环己基过氧化氢选择性为4.78%。实验表明,微管内环己烷无催化氧化是可行性的,反应时间短且安全性高,为慢反应的微管内效果提供了借鉴作用,值得进一步研究推广。
| [1] | Punniyamurthy T, Velusamy S, Iqbal J . Recent advances in transition metal catalyzed oxidation of organic substrates with molecular oxygen[J]. Chemical Reviews , 2005, 105 (6) : 2329-2363 DOI:10.1021/cr050523v |
| [2] | QI Pin-bao(戚品豹), SUN Yong-cheng(孙永成), CHEN Ying-bin(陈英斌) . Research progress of process for preparing cyclohexanone by cyclohexane oxidation(环己烷氧化制环己酮工艺及研究进展)[J]. Journal of Chemical Industry & Engineering(化学工业与工程技术) , 2012, 33 (4) : 27-30 |
| [3] | ZHAO Jing(赵静), YANG Yang-yang(杨洋洋), ZHU Ming-qiao(朱明乔) . Research progress in hetergeneous catalysts for cyclohexane oxidation by molecular oxygen(环己烷分子氧氧化多相催化剂研究进展)[J]. China Synthetic Fiber Industry(合成纤维工业) , 2011, 10 (40) : 14-16 |
| [4] | ZHAO Jing(赵静), ZHU Ming-qiao(朱明乔), YANG Yang-yang(杨洋洋) . Study of cyclohexane oxidation over Au/Al2O3 catalyst(Au/Al2O3催化剂上环己烷氧化)[J]. Journal of Zhejiang University(Engineering Science)(浙江大学学报(工学版)) , 2012, 46 (2) : 232-236 |
| [5] | WEN Y, Potter O E, Sridhar T . Uncatalysed oxidation of cyclohexane in a continuous reactor[J]. Chemical Engineering Science , 1997, 52 (24) : 4593-4605 DOI:10.1016/S0009-2509(97)00301-1 |
| [6] | Jevtic R, Ramachandran P A, Dudukovic M P . Effect of oxygen on cyclohexane oxidation:A stirred tank study[J]. Industrial and Engineering Chemistry Research , 2009, 48 (17) : 7986-7993 DOI:10.1021/ie900093q |
| [7] | Hendry DG., Gould C W, Schuetzle D . Auto-oxidations of cyclohexane and its autoxidation products[J]. Journal of Organic Chemistry , 1976, 41 (1) : 1-10 DOI:10.1021/jo00863a001 |
| [8] | Pohorecki R, Baldyga J, Moniuk W . Liquid-phase oxidation of cyclohexane modeling and industrial scale process simulation[J]. Chemical Engineering Science , 1992, 47 (9-11) : 2559-2564 DOI:10.1016/0009-2509(92)87093-6 |
| [9] | Klemm E, Doering H, Geisselmann A . Microstructured reactors in heterogeneous catalysis[J]. Chemical Engineering and Technology , 2007, 30 (12) : 1615-1621 DOI:10.1002/(ISSN)1521-4125 |
| [10] | Zhao J, Zhu M Q, Chen J J . Cyclohexane oxidation catalyzed by Au/MxOyAl2O3 using molecular oxygen[J]. Advanced Materials Research , 2011, 233-235 : 254-259 DOI:10.4028/www.scientific.net/AMR.233-235 |
| [11] | XU Li-xin(许立信), ZHU Ming-qiao(朱明乔), HE Chao-hong(何潮洪) . Research progress of solid catalysts for selective oxidation of cyclohexane using oxygen(环己烷分子氧选择性氧化固体催化剂研究进展)[J]. China Synthetic Fiber Industry(合成纤维工业) , 2006, 29 (1) : 45-48 |
| [12] | XU Li-xin(许立信), HE Chao-hong(何潮洪), ZHU Ming-qiao(朱明乔) . Cyclohexane oxidation over nano gold catalysts supported on zirconia-modified alumina(锆改性氧化铝负载的纳米金催化剂上环己烷氧化研究)[J]. J Chem Eng of Chinese Univ(高校化学工程学报) , 2009, 23 (2) : 309-312 |
| [13] | Jevtic R, Ramachandran P A, Dudukovic M P . Capillary reactor for cyclohexane oxidation with oxygen[J]. Chemical Engineering Research and Design , 2010, 88 (3A) : 255-262 |
| [14] | Coleman J W, Garimella S . Characterization of two-phase flow patterns in small diameter round and rectangular tubes[J]. International Journal of Heat and Mass Transfer , 1999, 42 (15) : 2869-2881 DOI:10.1016/S0017-9310(98)00362-7 |
| [15] | Ficsher J, Lange T, Boehling R . Uncatalyzed selective oxidation of liquid cyclohexane with air in a microcapillary reactor[J]. Chemical Engineering Science , 2010, 65 (16) : 4866-4872 DOI:10.1016/j.ces.2010.05.028 |
| [16] | Pohorecki R, Moniuk W, Wierzchowski P T . Kinetic model of uncatalyzed oxidation of cyclohexane[J]. Chemical Engineering Research and Design , 2009, 87 (3) : 349-356 DOI:10.1016/j.cherd.2008.08.007 |
| [17] | Wang L, Zhu M Q, Lu J . Uncatalyzed oxidation of cyclohexane in the microchannels[J]. Key Engineering Materials , 2013, 562-565 : 1542-1547 DOI:10.4028/www.scientific.net/KEM.562-565 |