进行性假性类风湿样骨发育不良(progressive pseudorheumatoid dysplasia, PPD)又称晚发型脊柱骨骺发育不良伴进行性骨关节病(spondyloepiphyseal dysplasia tarda with progressive arthropathy, SEDT-PA)或儿童进行性假性类风湿样关节病(arthropathy progressive pseudorheumatoid of childhood, APPRC),属于脊柱骨骺发育不良疾病中的一种临床类型。由于PPD的临床表现类似类风湿关节炎,而X线摄片显示骨骺及软骨病变,2015年新版国际骨病研究组织将PPD归属于42种骨、软骨发育不良疾病中第31种“遗传性炎性类风湿样骨关节病”[1]。PPD为常染色体隐性遗传病,是由于Wnt诱导的信号肽通路蛋白3基因(Wnt-inducible signaling pathway protein 3,WISP3)(MIM 208230)突变导致[2]。其特征性表现为脊柱椎体扁平及椎体终板不规则,外周骨关节膨大,继发性骨关节炎,广泛骨质疏松,但无滑膜炎及其他炎性反应等。
Wynne-Davies等[3]于1982年首先报道该病例。PPD患病率约为1/100万, 主要发生在地中海东岸、中东等地区[4-5]。该病3岁前常无症状,多于4~8岁发病,随着年龄增长,关节软骨持续性破坏,病情加重[4-6]。PPD临床表现类似幼年类风湿关节炎、幼年强直性脊柱炎等炎性关节疾病,常被误诊。目前,临床上对于该病诊断主要依靠临床症状和影像学检查,最终确诊必须依靠基因诊断。2007年国内中南大学湘雅二院内分泌团队首次报告WISP3基因突变家系并开展功能研究[7]。2009年上海第六人民医院骨质疏松和骨病专科报道了2个WISP3基因新的突变(G46X和C114Y)[8]。本文将笔者科室最近收集的4例PPD患者家系报告如下,总结PPD患者的临床特征以及X线表现,并检测WISP3基因突变,旨在提高对PPD的认识。
对象与方法 对象家系1:女性,21岁。父母近亲婚配。11岁起双膝、双髋关节僵硬、疼痛、活动受限,不能跑步。
患者为自然顺产足月,出生时体长,体质量与同龄儿相当。16个月会走路,患者4岁时发现胸廓异常的表现,误诊为佝偻病,曾予钙剂和维生素D治疗。11岁开始出现下肢轻度弯曲畸形,身高较同龄人明显矮小,运动时自觉双膝疼痛,步行不利。无口干,无夜尿增多,无四肢抽搐,无晨僵等。近2年无诱因下自觉双膝疼痛发作加重。13岁初潮,月经正常,未婚未育。患者祖父与外祖母是兄妹。母亲身高158 cm,父亲身高173 cm,均体健。家族中无类似病史。查体:身高:147.5 cm,体质量45 kg。驼背,脊柱轻度侧弯,双膝轻度内翻,双下肢轻度“驼背”形腿。无智力障碍。
家系2:男性,10岁。父母非近亲婚配,父母身高正常。患者为第一胎第一产,出生时身长50 cm,体质量4 200 g,母乳喂养。14个月开始走路,6岁起出现手指关节膨大,伴双膝关节伸直困难。9岁起行走时双髋关节疼痛,10岁起出现活动后双膝关节疼痛,休息后好转。查体:头围55 cm,身高146 cm,双臂展长146 cm,上身长70 cm,下身长76 cm,双手指间关节粗大,双肘关节膨大,伸直及弯曲受限。双下肢4字试验(+),双膝关节膨大,伸直受限,下蹲困难。
家系3:女性,14岁。父母非近亲婚配,患者为第三胎、第一产。9岁时出现双膝关节膨大、活动受限,不能跑步下蹲。双手未见异常。查体:身高155 cm,体质量44 kg。双手未见异常,双膝关节膨大,双肘粗大、不能伸直。父母双亲体检无关节畸形、身高异常等。
家系4:父母非近亲婚配,父母体健。姐妹俩均发病,姐姐18岁,妹妹15岁,患者均顺产。姐姐5岁出现下蹲困难,之后逐渐出现多处关节疼痛,10岁出现行走困难。妹妹6岁开始下蹲困难,并进行性加重,但未治疗。同时出现双髋、双膝关节逢雨季酸痛,伴活动减少。查体:姐妹二人目前均坐轮椅,无法行走。二人均有脊柱侧弯,其中姐姐双手指关节膨大,四肢关节伸直、外展活动受限。妹妹下肢外8字畸形,走路摇摆,双膝关节膨大,无法行走及下蹲。
4例家系见图 1。
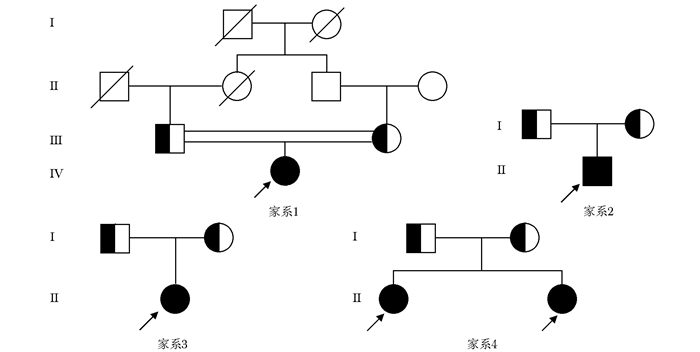
|
| 图 1 4例家系图 Figure 1 Family charts of 4 cases with PPD PPD:进行性假性类风湿样骨发育不良 |
生化指标检测:检测血清钙、磷和碱性磷酸酶,肝、肾功能(丙氨酸氨基转移酶、天门冬氨酸氨基转移酶、尿素氮、肌酐等),甲状旁腺素(parathyroid hormone, PTH),类风湿因子(rheumatoid factor, RF)等。
影像学检查:检查胸腰椎正侧位片、骨盆X片、双手正侧位片、双膝正侧位片等。
骨密度检测:使用双能X线吸收仪(Lunar Prodigy)测量患者腰椎L1-4以及髋部骨密度。
WISP3基因突变检测:抽取所有受试对象的静脉血5 mL, 抗凝保存于-80 ℃冰箱,利用常规方法抽提基因组DNA。首先对先证者采用Sanger直接测序技术检测WISP3基因突变,PCR扩增WISP3基因5个外显子及其侧翼序列,参考GeneBank(NC_000006), 使用Primer3软件设计WISP3基因5对引物,详见文献[8]报道。然后对4个家系的先证者父母,进行验证,分析样本是否存在WISP3基因突变。
结果 实验室检测5例患者及其家庭成员的生化检测(血清钙、磷、丙氨酸氨基转移酶、天门冬氨酸氨基转移酶、尿素氮、肌酐、PTH、RF等)均正常。
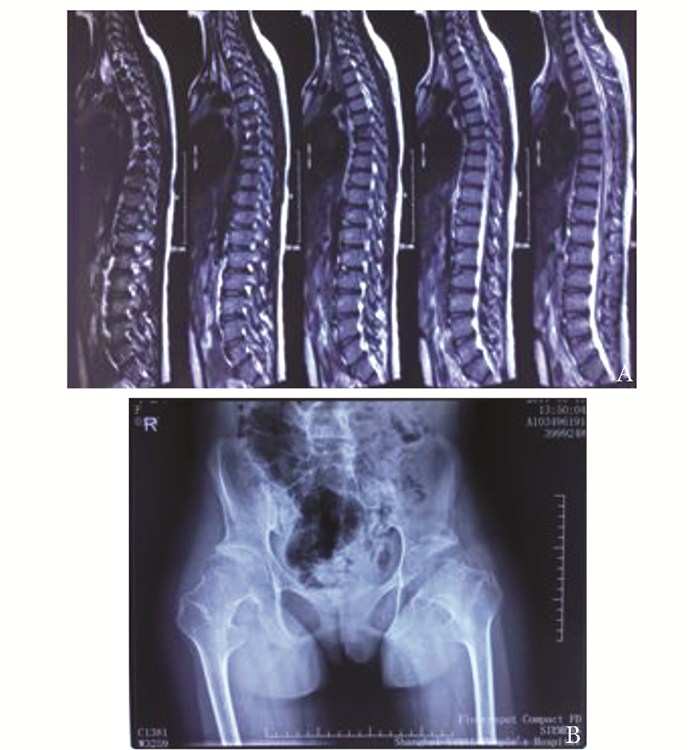
影像学检测家系1先证者X线表现:胸腰椎椎体扁平,椎体前缘鱼嘴样改变,双髋臼轻度变形(图 2)。家系2先证者X线表现:双侧髋臼骨骺发育不良继发退变,部分椎体变形(图 3)。家系3先证者X线表现:胸腰椎椎体扁平,椎体前缘鱼嘴样改变;双肘关节膨大、关节间隙变窄;双膝关节膨大(图 4)。家系4先证者姐姐:胸腰椎椎体扁平,椎体前缘鱼嘴样改变,双膝关节骨质疏松伴关节间隙狭窄,右髋关节半脱位(图 5)。家系4先证者妹妹胸腰椎椎体扁平,椎体前缘鱼嘴样改变,双膝关节骨质疏松伴关节间隙狭窄,双髋关节股骨头膨大,关节间隙狭窄,关节面毛糙(图 6)。
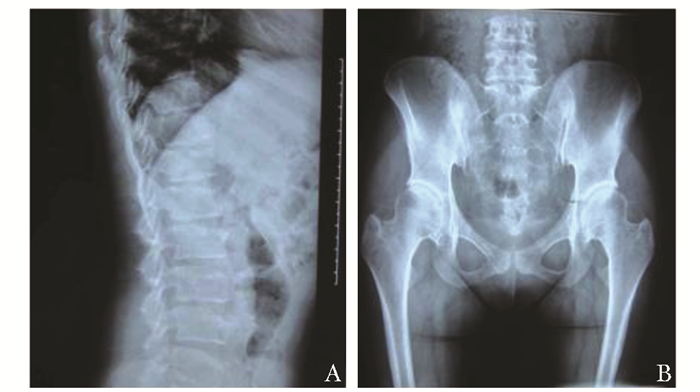
|
| 图 2 家系1先证者影像学检查 Figure 2 Imaging examination of the proband in family 1 A:腰椎平片,胸腰椎椎体扁平,椎体前缘鱼嘴样改变;B:骨盆平片,双髋臼轻度变形 |

|
| 图 3 家系2先证者影像学检查 Figure 3 Imaging features of the proband in family 2 A:胸、腰椎平片:胸腰椎椎体扁平,椎体前缘鱼嘴样改变;B:骨盆平片:双髋臼骨骺发育不良;C:掌指关节局部梭形膨大,近远指关节间隙变窄;D.双肘关节膨大、关节间隙变窄 |
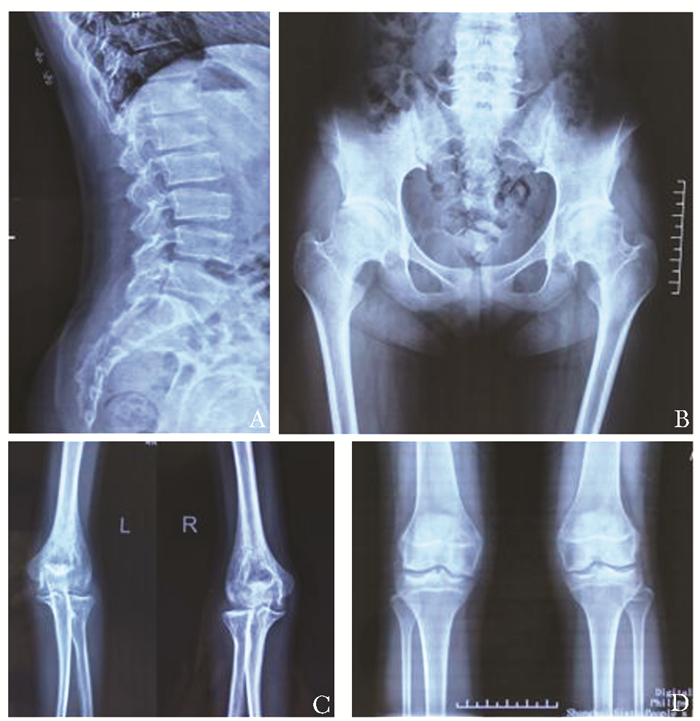
|
| 图 4 家系3先证者影像学检查 Figure 4 Imaging features of the proband in family 3 A:胸腰椎椎体扁平,椎体前缘鱼嘴样改变;B:骨盆平片;C:双肘关节膨大、关节间隙变窄;D:双膝关节膨大 |
|
| 图 5 家系4先证者影像学检查 Figure 5 Imaging features of the proband in family 4 A:胸腰椎椎体扁平,椎体前缘鱼嘴样改变;B:双髋关节膨大、关节间隙变窄;右髋关节半脱位 |

|
| 图 6 家系4妹妹影像学检查 Figure 6 Imaging features of the proband's sister younger in family 4 A:(Ⅱ2)胸腰椎椎体扁平,椎体前缘鱼嘴样改变;B:双膝关节骨质疏松伴关节间隙狭窄;C:双髋关节膨大、关节间隙变窄; D:双手平片 |
家系1先证者骨密度检查:L1-4 0.891 g/cm2(Z值-1.0),股骨颈0.674 g/cm2(Z值-0.6),全髋0.716 g/cm2(Z值-0.8)。家系2先证者骨密度检查:L1-4 0.688 g/cm2(Z值-1.6),股骨颈0.433 g/cm2(Z值-1.4),全髋0.470 g/cm2(Z值-1.2)。家系3先证者骨密度检查:L1-4 1.112 g/cm2(Z值+0.9),股骨颈0.769g/cm2(Z值-0.7),全髋0.800g/cm2(Z值-0.8)。家系4先证者(姐姐)骨密度:L1-4 0.773 g/cm2(Z值-1.4),但股骨颈和全髋部无法检测;先证者妹妹骨密度:L1-4 1.383 g/cm2(Z值+1.3),股骨颈和全髋部无法检测。
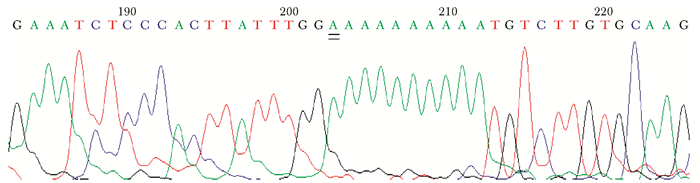
基因突变检测家系1先证者:WISP3基因外显子5发生重复插入碱基A(c.624dupA),造成纯合插入突变位点(p.Cys209MetfsX21),其为一个新的突变位点。这个突变使编码半胱氨酸的密码子变成编码甲硫氨酸的密码子,导致氨基酸编码错误,且由于移码突变,最终导致氨基酸编码终止在p.230位置。经过Mutation Taster验证突变位点(p.Cys209MetfsX21)属于致病位点(图 7)。同时发现其父母外显子5上发生杂合插入。
|
| 图 7 家系1先证者WISP3基因密度 Figure 7 Mutation in WISP3 of the proband in family 1 在WISP3外显子5位点突变c.624dupA |
家系2先证者:WISP3基因发生复合杂合突变。外显子3发生错义突变(c.131G>A)(p.Arg44His),导致编码精氨酸密码变成编码组氨酸;外显子4发生无义突变(c.348C>A)(p.Tyr116X),导致编码酪氨酸密码成为终止密码,导致肽链合成提前终止;内含子4靠近4号外显子处杂合突变,导致剪切突变(c.589+2T>C),其中突变位点p.Tyr116X为新发现位点。经过Mutation Taster和PolyPhen-2验证c.131G>A和c.348C>A位点均属于致病位点。同时,在该先证者父亲发现WISP3基因外显子3发生错义突变(p.Arg44His),外显子4发生无义突变(p.Tyr116X);该先证者母亲发现WISP3基因内含子4靠近4号外显子处发生剪切突变(c.589+2T>C)。根据该疾病的遗传方式和临床表现,父亲未发病,考虑来自母亲的另一突变位点c.589+2T>C也是致病位点。先证者2条染色体携带了3个突变位点,导致发病(图 8)。

|
| 图 8 家系2先证者WISP3基因突变 Figure 8 Mutation in WISP3 of the proband in family 2 在3号外显子发生错义突变(杂合突变)(c.131G>A);4号外显子发生无义突变(杂合突变)(c.348C>A);4号内含子靠近4号外显子处发生剪切突变(c.589+2T>C) |
家系3先证者:WISP3基因发生复合杂合突变。外显子3发生错义突变(c.342T>G)(p.Cys114Trp),导致编码半胱氨酸密码变成编码色氨酸;外显子5发生错义突变(c.667T>C)(p.Cys223Arg),导致编码半胱氨酸密码变成编码精氨酸。其中突变位点p.Cys114Trp为新发现位点。经过Mutation Taster验证该位点属于致病位点(图 9)。同时,在该先证者父亲发现WISP3基因外显子3存在杂合错义突变位点(p.Cys114Trp),该先证者母亲发现WISP3基因外显子5存在杂合错义突变位点(p.Cys223Arg)。

|
| 图 9 家系3先证者WISP3基因突变 Figure 9 Mutation in WISP3 of the proband in family 3 在3号外显子发生错义突变(c.396T>G);5号外显子发生错义突变(c.721T>C) |
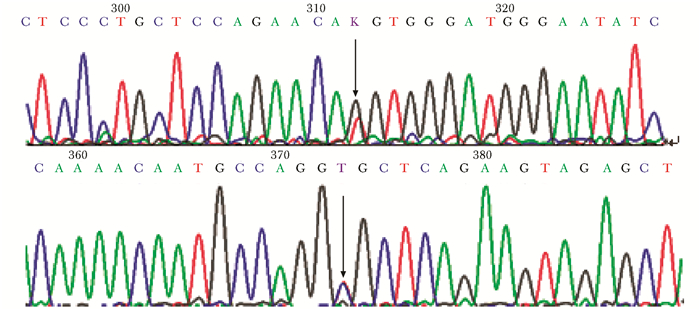
家系4:先证者(姐姐)和先证者妹妹均发生WISP3基因复合杂合突变。在外显子5处发生错义突变(c.667T>G)(p.Cys223Gly),导致编码半胱氨酸密码变成甘氨酸;在内含子4靠近外显子4处发生剪切位点突变(c.589+2T>C),其中突变位点p.Cys223Gly为新发位点(图 10)。同时,在该先证者父亲发现WISP3基因外显子5处发生错义突变(c.667T>G),该先证者母亲发现WISP3基因在内含子4靠近外显子4处发生剪切位点突变(c.589+2T>C)。
|
| 图 10 家系4先证者WISP3基因突变 Figure 10 Mutation in WISP3 of the proband and her younger sister in family 4 在外显子5发生错义突变(c.667T>G); 在内含子4靠近外显子4处发生剪切位点突变(c.589+2T>C) |
PPD为幼年起病,以双手近端指间关节肿胀为突出表现,逐渐出现外周大小关节进行性受累,三分之一患者伴有脊柱异常出现短躯干畸形。外周大小关节均可受累,依次累及双手小关节、髋、膝、踝、腕、肩等,早发骨关节炎改变是致残的主要原因[4, 9]。影像学特点均表现为普遍性扁平椎并椎体终板不规则、骨骺增大、继发性退行性变和关节周围骨质疏松[5, 9]。本研究报道的4个家系患者均表现为随着年龄增长出现的骨痛和关节畸形,同时伴有短躯干脊柱畸形;影像学表现为多个关节受累、关节间隙变窄,脊柱椎体扁平、椎体前缘鱼嘴样改变。而实验室生化检测均无异常表现,分子遗传学检查结果与临床诊断一致。
PPD患者在3岁前常无症状,症状和体征多于3~8岁时出现,因此早期鉴别诊断和确诊困难。由于PPD的临床症状及X线表现与其他骨代谢疾病有类似之处,临床上需要与以下疾病鉴别:(1)幼年型特发性关节炎:该病表现为生长发育迟缓、身高矮小,伴关节疼痛、活动受限。但该病无脊柱骨骺发育不良,多为慢性、对称性多滑膜关节炎,同时伴有关节外表现,虹膜睫状体炎、贫血、外周白细胞和血小板增多,淋巴结肿大等。实验室检查发现血沉、C反应蛋白、类风湿因子、抗核抗体等增高。(2)黏多糖症:该病患者出生时表型正常,多在婴幼儿时期发病。临床上表现为膝关节外翻、关节疼痛,关节畸形、僵硬,脊柱后凸,爪状手,面容丑陋等。骨骼X线检查:脊柱类似PPD病的X表现,胸腰椎椎体扁平,椎体前缘鱼嘴样改变;肋骨脊柱端细小、胸骨端变宽,有飘带样变化等。实验室可发现尿液黏多糖定量阳性、酶活性测定可明确分型。在临床上亦可以通过相关基因分析明确诊断。
1998年,Pennica等[2]首先克隆了WISP3基因,并将其定位于6q22-6q23。1999年Hurvitz等[10]首次明确了PPD是由于Wnt1诱导信号通路蛋白-WISP3基因突变导致,并首次在13例PPD患者中报道了9种突变。WISP3基因含有5个外显子,编码354个氨基酸,约为40 kb的分泌性蛋白,是结缔组织生长因子(connective tissue growth factor, CTGF)CCN家族中的一员[11]。CCN家族包括6个家族成员,分别是CTGF(CCN1)、Cyr61(CCN2)、NOV(CCN3)、WISP-1(CCN4)、WISP-2(CCN5)和WISP-3(CCN6), 由343~381个氨基酸残基构成4个不同的蛋白结构模块, 含有38个保守的半胱氨酸,具有广泛的生物学特性,在细胞的生长、分化、黏附和运动、发育和分化,血管生成、伤口修复、炎性作用以及肿瘤生长等多种生物学过程中起重要作用[12-13]。目前,全球约有57个WISP3基因突变位点被报道,其中14个来自我国报道[14]。突变类型包括外显子缺失、移码突变、无义突变和错义突变等。本次研究报道了4个PPD家系,先证者均有WISP3基因突变。本研究首次在4个先证者中发现WISP3基因的4个新的突变位点:家系1突变位点p.Cys209MetfsX21、家系2突变位点p.Tyr116X、家系3突变位点p.Cys114Trp和家系4的突变位点p.Cys223Gly,并且经过Mutation Taster验证新突变位点均为致病位点。本组病例中,仅1个家系为近亲结婚、为纯合突变,其他家系先证者均为复合杂合突变。本病为隐性遗传病,在临床上对于非近亲婚配后代也需注意其可能是遗传基因突变。
目前,对于WISP3基因突变导致PPD发病机制尚未阐明。早期,国内外认为WISP3基因N末端肽与胰岛素生长因子结合蛋白(insulin growth factor binding protein,IGFBP)依次相连,显示可能与胰岛素样生长因子1(IGF1 insulin-like growth factor 1)相互作用。当WISP3基因突变会增加IGF1的敏感性,从而使关节软骨细胞表型发生改变,导致PPD患者软骨细胞凋亡[15]。之后研究证实WISP3能够诱导IGF1以及软骨细胞的分化表达,例如通过活性氧簇(reactive oxygen species,ROS)[16]。ROS是具有多种细胞功能的信使因子,对细胞增生、分化、凋亡和迁移等都具有非常重要意义[17]。因此,猜测PPD是由于WISP3基因的突变导致了关节软骨的功能丢失和骨基质矿化异常,这些研究认为WISP3基因影响了细胞内ROS的积累,干扰了出生后软骨细胞的稳定性,使未成熟的软骨细胞处于高增生状态,使关节软骨提前退化而导致全身关节畸形、活动受限[4, 6, 18]。还有研究发现,WISP3过表达能抑制骨形态发生蛋白(bone morphogenetic protein, BMP)。Nakamura等[19]通过克隆斑马鱼该基因的同源蛋白发现表达WISP3基因的蛋白通过结合BMP配体抑制了BMP信号通路,和Wnt低密度脂蛋白受体相关蛋白信号通路, 因此推断BMP和Wnt信号通路功能失调是PPD患者软骨发育异常的的原因之一。目前虽然证实WISP3基因与BMP信号通路和Wnt信号通路异常,以及IGF1相关,但关于WISP3基因的功能研究还未明确,本课题组拟进一步开展相关工作。从目前对PPD疾病的认识看,该病除累及骨关节和脊柱之外,无其他重要脏器的受累。对PPD尚无有效的治疗药物,在疾病早期,可使用非甾体抗炎药使患者疼痛减轻,使用硫酸氨糖等软骨保护剂和康复锻炼对于维持关节功能极为重要。在疾病晚期,对于并发椎管狭窄和脊柱后凸的PPD患者可考虑内固定脊柱融合手术;对于髋、膝关节等外周关节严重受累的患者,进行骨切除和关节成形、置换术等外科治疗,可以在一定程度上改善患者的生活质量。
| [1] | Bonafe L, Cormier-Daire V, Hall C, et al. Nosology and classification of genetic skeletal disorders:2015 revision[J]. Am J Med Genet A, 2015, 167A: 2869–2892. |
| [2] | Pennica D, Swanson Ta Fau-Welsh JW, Welsh Jw Fau-Roy MA, et al. WISP genes are members of the connective tissue growth factor family that are up-regulated in wnt-1-transformed cells and aberrantly expressed in human colon tumors[J]. Proc Natl Acad Sci USA, 1998, 95: 14717–14722. DOI:10.1073/pnas.95.25.14717 |
| [3] | Wynne-Davies R, Hall C, Ansell BM. Spondylo-epiphysial dysplasia tarda with progressive arthropathy. A "new" disorder of autosomal recessive inheritance[J]. J Bone Joint Surg Br, 1952, 64: 442–445. |
| [4] | el-Shanti HE, Omari HZ, Qubain HI. Progressive pseudorheumatoid dysplasia:report of a family and review[J]. J Med Genet, 1997, 34: 559–563. DOI:10.1136/jmg.34.7.559 |
| [5] | Rezai-Delui H, Mamoori G, Sadri-Mahvelati E, et al. Progressive pseudorheumatoid chondrodysplasia:a report of nine cases in three families[J]. Skeletal Radiol, 1994, 23: 411–419. |
| [6] | Delague V, Chouery E, Corbani S, et al. Molecular study of WISP3 in nine families originating from the Middle-East and presenting with progressive pseudorheumatoid dysplasia:identification of two novel mutations, and description of a founder effect[J]. Am J Med Genet A, 2005, 138A: 118–126. DOI:10.1002/(ISSN)1552-4833 |
| [7] | Zhou HD, Bu YH, Peng YQ, et al. Cellular and molecular responses in progressive pseudorheumatoid dysplasia articular cartilage associated with compound heterozygous WISP3 gene mutation[J]. J Mol Med (Berl), 2007, 85: 985–996. DOI:10.1007/s00109-007-0193-2 |
| [8] | Yue H, Zhang Z, He JW. Identification of novel mutations in WISP3 gene in two unrelated Chinese families with progressive pseudorheumatoid dysplasia[J]. Bone, 2009, 44: 547–554. DOI:10.1016/j.bone.2008.11.005 |
| [9] | Mampaey S, Vanhoenacker F, Boven K, et al. Progressive pseudorheumatoid dysplasia[J]. Eur Radiol, 2000, 10: 1832–1835. DOI:10.1007/s003300000518 |
| [10] | Hurvitz JR, Suwairi WM, Van Hul W, et al. Muta-tions in the CCN gene family member WISP3 cause progressive pseudorheumatoid dysplasia[J]. Nat Genet, 1999, 23: 94–98. DOI:10.1038/12699 |
| [11] | Sen M, Cheng YH, Goldring MB, et al. WISP3-dependent regulation of type Ⅱ collagen and aggrecan production in chondrocytes[J]. Arthritis Rheum, 2004, 50: 488–497. DOI:10.1002/(ISSN)1529-0131 |
| [12] | Brigstock DR, Goldschmeding R, Katsube KF, et al. Proposal for a unified CCN nomenclature[J]. Mol Pathol, 2003, 56: 127–128. DOI:10.1136/mp.56.2.127 |
| [13] | Brigstock DR. The CCN family:a new stimulus package[J]. J Endocrinol, 2003, 178: 169–175. DOI:10.1677/joe.0.1780169 |
| [14] | Yan W, Dai J, Xu Z, et al. Novel WISP3 mutations causing progressive pseudorheumatoid dysplasia in two Chinese families[J]. Hum Genome Var, 2016, 3: 16041. DOI:10.1038/hgv.2016.41 |
| [15] | Engel J. Role of oligomerization domains in thrombospondins and other extracellular matrix proteins[J]. Int J Biochem Cell Biol, 2004, 36: 997–1004. DOI:10.1016/j.biocel.2003.12.009 |
| [16] | Repudi SR, Patra M, Sen M. WISP3-IGF1 interaction regulates chondrocyte hypertrophy[J]. J Cell Sci, 2013, 126: 1650–1658. DOI:10.1242/jcs.119859 |
| [17] | Miller DS, Sen M. Potential role of WISP3(CCN6) in regulating the accumulation of reactive oxygen species[J]. Biochem Biophys Res Commun, 2007, 355: 156–161. DOI:10.1016/j.bbrc.2007.01.114 |
| [18] | Ekbote AV, Danda D, Kumar S, et al. A descriptive analysis of 14 cases of progressive-psuedorheumatoid-arthropathy of childhood from south India:review of literature in comparison with juvenile idiopathic arthritis[J]. Semin Arthr Rheum, 2013, 42: 582–589. DOI:10.1016/j.semarthrit.2012.09.001 |
| [19] | Nakamura Y, Weidinger G, Liang JO, et al. The CCN family member Wisp3, mutant in progressive pseudorheumatoid dysplasia, modulates BMP and Wnt signaling[J]. J Clin Invest, 2007, 117: 3075–3086. DOI:10.1172/JCI32001 |
| (收稿日期:2017-12-12) |

