糖皮质激素(glucocorticoids,GCs)作为临床上广泛使用的药物,在实际应用中常常超过生理剂量,长期大剂量糖皮质激素的主要不良反应是骨量丢失和骨质疏松症(osteoporosis,OP),导致骨折风险增加,危害巨大。由于其发病机制复杂,尚无疗效确切、针对作用机制的干预措施。目前认为糖皮质激素对成骨细胞的功能抑制与糖皮质激素性骨质疏松症(glucocorticoid induced osteoporosis, GIOP)发病密切相关,但具体的分子机制仍未完全阐明[1]。
近几年的研究发现多种信号分子对成骨细胞的生长、分化、凋亡等起着重要的调控作用。其中Akt信号蛋白广泛存在于真核细胞内,参与细胞生长、存活等众多过程[2]。研究表明,缺乏Akt1的小鼠骨量增长不足,次级骨化中心形成延迟[3]。激活Akt蛋白可促进前体成骨细胞MC3T3-E1增生、分化[4],提示Akt在骨代谢过程中发挥着重要作用,可能在糖皮质激素调节成骨细胞的骨形成中也有着重要地位[5-6]。
基于此,本研究采用体外培养的大鼠原代成骨细胞,给予地塞米松及Akt激动剂SC79单独或联合干预24 h,观察成骨细胞中碱性磷酸酶(alkaline phosphatase,ALP)蛋白的表达和Akt磷酸化的变化,探讨地塞米松对成骨细胞功能的影响及可能的作用机制。
材料与方法 主要材料与仪器出生24 h以内的SD大鼠(不计体质量,不分雌雄,SPF级)由广西医科大学动物实验中心提供。低糖DMEM培养基购自美国Gibco公司;胎牛血清购自Lonsera公司;Ⅰ型胶原酶、胰蛋白酶、地塞米松购自美国Sigma公司;碱性磷酸酶BCIP/NBT染色试剂盒、碱性磷酸酶活性测试盒购自碧云天公司;茜素红S染色液购自北京索莱宝公司;CCK-8试剂购自日本同仁化学公司;一抗兔抗鼠ALP抗体购自美国Abcam公司;一抗兔抗鼠β-actin、t-Akt、p-Akt抗体、Dylight 800抗兔lgG(H+L)购自美国Cell Signaling Technology公司。超净工作台购自苏州净化公司,CO2培养箱、酶标仪购自赛默飞公司,倒置相差显微镜购自Olympus公司,Odyssey红外扫描成像系统购自Li-COR公司。
方法原代成骨细胞提取:新生SD大鼠乳鼠放入盛有75%乙醇的烧杯中浸泡10 min,于无菌条件下取出颅盖骨置入PBS中,剔除附着的血液和结缔组织。PBS清洗3次,将干净的骨片移入4 mL 0.25%胰蛋白酶溶液内,37 ℃消化10 min,血清终止消化,弃去上清液。将骨片剪成1 mm×1 mm的骨粒,加入0.2%Ⅰ型胶原酶5 mL,37 ℃消化2 h,1 000 r/min离心10 min,弃去上清,用含10%的胎牛血清、100 U/mL青霉素、100 mg/L链霉素的培养液重悬沉淀物,200目无菌滤网过滤碎骨片,所得细胞悬液按需密度接种于细胞培养瓶中,置于体积分数5% CO2 37 ℃恒温培养箱中培养。48 h后换液,以后每2天换液1次,细胞长满瓶底80%时,加入0.25%胰蛋白酶消化。采用差速黏除法纯化细胞,纯化后分瓶培养。倒置相差显微镜观察细胞生长状态,碱性磷酸酶染色法及茜素红钙结节染色进行成骨细胞鉴定。
原代成骨细胞鉴定:取生长良好的第3代成骨细胞,调整细胞密度1×105/mL,接种到细胞培养皿中,24 h后吸弃皿内培养液,PBS清洗2次,4%多聚甲醛固定5 min,PBS清洗后用BCIP/NBT染色液避光孵育1 h,PBS清洗3次,显微镜下观察细胞胞内蓝黑色颗粒沉积。茜素红钙结节染色:连续培养细胞21 d,弃去上清液,PBS液清洗2次,95%乙醇固定30 min,PBS冲洗后采用0.2%茜素红染色1 h,PBS液冲洗数次,显微镜下拍照观察。
药物干预:(1)采用不同浓度地塞米松作用于成骨细胞,分为对照组(0 mol/L Dex)、10-8mol/L Dex组、10-7mol/L Dex组、10-6mol/L Dex组干预24 h;(2)Akt激动剂SC79(10 μmol/L)与地塞米松(10-6 mol/L)分别单独或联合干预成骨细胞,分为对照组(0 mol/L Dex,0 mol/L SC79)、SC79组(0 mol/L Dex,10 μmol/L SC79)、Dex组(10-6 mol/L Dex,0 mol/L SC79)、SC79+Dex组(10 μmol/L SC79,10-6 mol/L Dex)干预24 h。
细胞增生检测:将生长良好的第3代成骨细胞按每孔2×103个接种于96孔培养板培养12 h后,细胞分别用含或不含药物的培养液加药处理,干预24 h后,采用cell counting kit-8(CCK-8)试剂盒检测各组成骨细胞增生率。采用酶标仪检测450 nm波长的吸光度(A450)值。每组设5个复孔。
成骨细胞分泌型碱性磷酸酶定量检测:收集加药处理24 h后的细胞培养液进行ALP含量测定,按照ALP试剂盒进行具体操作,在酶标仪检测405 nm波长的吸光度值。将校正后的A值带入标准曲线,得到酶反应生成物的量。根据定义,ALP活性单位指:在25 ℃ pH 9.6条件下,每分钟水解底物p-nitrophenyl phosphate(pNPP)产生1 μmol p-nitrophenyl(pNP)的ALP的量,即1 U=1 μmol/min。经公式ALP值=样品产生pNP的量/样品体积/反应时间,推算定容积样品中ALP的含量。
蛋白表达检测:采用Western blot法,裂解加药处理后的细胞,每个样本每孔加入40 μg蛋白液,经SDS-PAGE胶电泳后转膜,用5%脱脂奶粉室温封闭1 h,ALP(1:500)、p-Akt(1:1 200)、Akt (1:1 200)一抗工作液4 ℃孵育过夜,TBST清洗10 min×3,然后加荧光二抗(抗兔lgG(H+L)抗体1:10 000)室温下摇床孵育60 min,TBST清洗10 min×3,最后经Odyssey荧光扫描成像系统(Li-COR公司)扫描并行灰度值测定。
统计学方法数据采用SPSS 22.0统计软件进行分析,计量资料以均数±标准差(x±s)表示,进行单因素方差分析,两两比较方差齐采用LSD-t检验,方差不齐用Dunnett's T3法,P<0.05为差异有统计学意义。
结果 成骨细胞鉴定成骨细胞培养48 h后,细胞充分伸展,呈三角形、鳞片形、长梭形等(图 1A),ALP染色显示,阳性细胞胞质中有许多蓝黑色颗粒或块状沉淀(图 1B),细胞连续培养21 d后呈现重叠生长,钙结节形成,茜素红染色呈红色(图 1C)。

|
| 图 1 成骨细胞形态及鉴定 Figure 1 Morphology and identification of osteoblasts A:成骨细胞形态(×40); B:碱性磷酸酶染色(×100); C:茜素红染色(×200) |
CCK-8检测细胞增生结果显示,与对照组(A值:0.742±0.022)相比,10-8 mol/L Dex组(A值:0.710±0.055)细胞增生活性差异无统计学意义(P>0.05),10-7 mol/L Dex组(A值:0.598±0.028)和10-6 mol/L Dex组(A值:0.570±0.025)细胞增生活性均明显下降,差异有统计学意义(P<0.05)。与10-8 mol/L Dex组相比,10-7 mol/L、10-6 mol/L Dex组的细胞增生活性均明显下降,差异有统计学意义(P<0.05)。高浓度的地塞米松能明显抑制成骨细胞增生。本研究将具有明显作用的10-6 mol/L地塞米松用于后续实验。
地塞米松对成骨细胞上清液ALP含量的影响采用10-8 mol/L、10-7 mol/L、10-6 mol/L地塞米松干预成骨细胞24 h,ALP含量除10-8 mol/L组(0.326±0.026)外,10-7 mol/L(0.316±0.015)和10-6 mol/L(0.313±0.013)地塞米松组成骨细胞上清液中的ALP值显著下降,与对照组(0.351±0.028)相比,差异有统计学意义(P<0.05)。
地塞米松对成骨细胞ALP和磷酸化Akt的蛋白表达的影响Western blot法检测ALP和磷酸化Akt(p-Akt)蛋白表达结果显示,10-8 mol/L、10-7 mol/L、10-6 mol/L地塞米松组的ALP蛋白表达分别较对照组减少16.2%、24.8%、69.3%,除10-8 mol/L组外,10-7 mol/L和10-6 mol/L地塞米松组的ALP蛋白表达明显低于对照组,差异有统计学意义(P<0.05);10-8 mol/L、10-7 mol/L、10-6 mol/L地塞米松组的p-Akt蛋白表达分别较对照组降低16.9%、34.9%、62.5%,差异均有统计学意义(P<0.05)(图 2、表 1)。

|
| 图 2 不同浓度地塞米松对大鼠成骨细胞ALP、Akt、p-Akt蛋白表达的影响 Figure 2 Effects of different concentrations of dexamethasone on the expressions of ALP, Akt and p-Akt protein in rat osteoblasts Dex:地塞米松;ALP:碱性磷酸酶;p-Akt:磷酸化蛋白激酶B;Akt:蛋白激酶B |
| 组别 | ALP | p-Akt |
| 对照组 | 0.696±0.075 | 0.870±0.070 |
| 10-6mol/LDex组 | 0.213±0.050* | 0.326±0.090* |
| 10-7mol/LDex组 | 0.523±0.097* | 0.566±0.047* |
| 10-8mol/LDex组 | 0.583±0.061 | 0.723±0.061* |
| 与对照组相比,*P<0.05; Dex:地塞米松,ALP:碱性磷酸酶,p-Akt:磷酸化蛋白激酶B | ||
分别用10-6 mol/L地塞米松及Akt激动剂SC79(10 μmol/L)单独或联合干预成骨细胞24 h,检测成骨细胞增生率及细胞上清液中ALP的含量显示。与对照组比较,10-6mol/L地塞米松能明显抑制成骨细胞增生,差异有统计学意义(P<0.05);单纯SC79组、SC79+Dex组的成骨细胞增生均高于单纯Dex组,差异有统计学意义(P<0.05);与对照组相比,单纯Dex组ALP值显著下降,差异有统计学意义(P<0.05);单纯SC79组、SC79+Dex组ALP值均显著高于单纯Dex组,差异有统计学意义(P<0.05)(表 2)。
| 组别 | A450值 | ALP(×0.1 U/mL) |
| 对照组 | 0.717±0.065 | 0.342±0.023 |
| SC79组 | 0.768±0.076# | 0.357±0.029* |
| Dex组 | 0.552±0.052* | 0.294±0.017* |
| Dex+SC79组 | 0.666±0.078# | 0.326±0.022# |
| 与对照组相比,*P<0.05;与Dex组相比,#P<0.05; Dex:地塞米松,ALP:碱性磷酸酶 | ||
Western blot法检测结果显示,与对照组相比,单纯Dex组的ALP和p-Akt蛋白表达明显降低,差异有统计学意义(P<0.05);单纯SC79组的ALP和p-Akt表达增加,差异有统计学意义(P<0.05);与单纯Dex组相比,单纯SC79组、SC79+Dex组的ALP、p-Akt表达明显增加,差异有统计学意义(P<0.05)(图 3、表 3)。
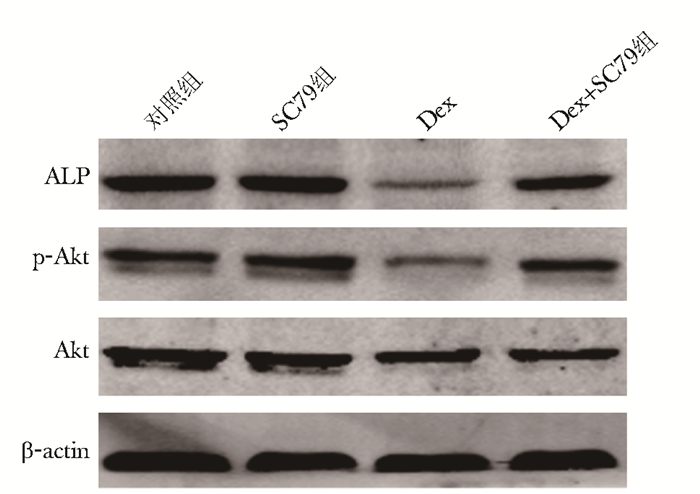
|
| 图 3 地塞米松及SC79对成骨细胞ALP、Akt、p-Akt蛋白表达的影响 Figure 3 Effects of dexamethasone and SC79 on expressions of ALP, Akt and p-Akt protein in osteoblasts Dex:地塞米松;ALP:碱性磷酸酶;p-Akt:磷酸化蛋白激酶B;Akt:蛋白激酶B |
| 组别 | ALP | p-Akt |
| 对照组 | 0.720±0.095 | 0.823±0.055 |
| SC79组 | 0.856±0.065*# | 0.933±0.047*# |
| Dex组 | 0.243±0.041* | 0.336±0.061* |
| Dex+SC79组 | 0.486±0.075*# | 0.646±0.065*# |
| 与对照组相比,*P<0.05;与Dex组相比,#P<0.05; Dex:地塞米松,ALP:碱性磷酸酶,p-Akt:磷酸化蛋白激酶B | ||
糖皮质激素广泛应用于临床多种疾病如感染、免疫系统疾病等的治疗,长期应用糖皮质激素可以引起骨质流失,导致的糖皮质激素性OP越来越受到重视。糖皮质激素性OP发病机制非常复杂,多种细胞包括骨髓基质干细胞、成骨细胞、骨细胞均存在糖皮质激素受体,目前认为糖皮质激素主要是通过影响成骨细胞导致了糖皮质激素性OP的发生[7]。在骨形成过程中,成骨细胞主要负责骨基质的成熟和矿化,成骨细胞的数量和功能对维持正常的骨量起到关键作用。以往研究表明,超生理剂量的糖皮质激素可抑制成骨细胞增生分化及诱导其凋亡,使成骨细胞功能低下,导致成骨不足[8]。本研究观察了不同浓度地塞米松作用于成骨细胞,结果发现10-7mol/L和10-6mol/L的地塞米松对成骨细胞的增生有明显的抑制作用,这与Feng等[9]的研究结果一致。
ALP是成骨细胞矿化早期分泌的一种酶蛋白,可以清除钙化抑制物,水解磷酸酯帮助羟基磷灰石沉淀,促进基质钙化和成骨的顺利进行[10]。ALP表达的高低可以反映成骨细胞矿化能力和骨形成状况。本研究检测了不同浓度地塞米松对成骨细胞产生ALP的影响,结果显示与对照组相比,10-7 mol/L和10-6 mol/L Dex组成骨细胞上清液ALP含量明显减少。进一步采用蛋白免疫印迹法检测地塞米松对成骨细胞ALP蛋白表达的作用,结果显示随着地塞米松浓度的增加,ALP蛋白表达逐渐降低。提示地塞米松可抑制成骨细胞增生和ALP的表达,地塞米松的浓度越大,抑制作用越明显。
Akt,又称蛋白激酶B (protein kenase B,PKB),是一种丝氨酸/苏氨酸蛋白激酶,它是PI3K/Akt信号传导途径中关键的枢纽分子,对细胞生长、分化、代谢有广泛的影响。采用胰岛素样生长因子-1(insulin-like growth factor-1,IGF-1)作用于成骨细胞株MC3T3-E1后发现,Akt的激活对成骨细胞ALP的表达发挥重要的作用[11]。使用PI3K/Akt通路阻断剂LY294002抑制Akt的激活以及Akt基因敲除后,成骨细胞ALP表达和矿化能力明显减弱[12-13]。提示Akt是骨形成重要的调节因子。既往的研究显示,地塞米松在小鼠成骨样细胞MC3T3-E1及小鼠原代细胞均可诱导Akt磷酸化的下调[14]。采用地塞米松干预SD大鼠5周后发现,大鼠成骨细胞中p-Akt蛋白表达明显下调[15]。本研究结果显示,随着地塞米松浓度的增加,成骨细胞中p-Akt蛋白表达逐渐降低,与上述研究相一致。地塞米松下调Akt的磷酸化,可能是其诱导骨形成活性下降的新的机制,但具体作用机制仍不明确。研究发现,地塞米松可上调PI3K的p85调节亚基的表达,过多的p85调节亚基与p85/p110异二聚体竞争细胞膜上IRS-1的结合位点,从而抑制了PI3K的活性,进而影响下游Akt的活化[16]。亦有研究指出,地塞米松能诱导糖皮质激素受体磷酸化,从而下调PI3K/Akt信号[17]。此外,糖皮质激素能从转录水平抑制成骨细胞IGF-1mRNA表达,导致IGF-1水平下降[18],后者能直接影响Akt的活化[19]。在成骨细胞中地塞米松对Akt的抑制效应也可能遵循着相似的机制。
为了进一步验证Akt在地塞米松抑制成骨细胞增生和功能中的作用,本研究将高浓度地塞米松、Akt特异性激动剂SC79单独或联合作用于成骨细胞,结果发现高浓度地塞米松能抑制Akt的磷酸化,抑制成骨细胞的增生和矿化,而Akt特异性激动剂SC79能有效地诱导Akt的激活,减少高浓度地塞米松对Akt的磷酸化的抑制作用,减轻地塞米松对成骨细胞增生和矿化的不良影响,提示Akt参与了地塞米松对成骨细胞功能的影响。
综上所述,本研究采用不同浓度的地塞米松干预离体培养的成骨细胞,结果发现,10-7 mol/L和10-6 mol/L地塞米松能抑制成骨细胞增生,下调Akt蛋白的磷酸化,减少ALP蛋白的表达;使用Akt特异性激动剂SC79激活后可以改善地塞米松对成骨细胞增生的抑制作用,增加成骨细胞ALP的表达,提示Akt可能参与了地塞米松对成骨细胞功能的影响,在糖皮质激素性OP的发病机制中有着重要的作用。Akt有可能成为未来治疗糖皮质激素性OP的新的靶点。
| [1] | 任辉, 魏秋实, 江晓兵, 等. 糖皮质激素性骨质疏松的研究新进展[J]. 中国骨质疏松杂志, 2014, 20: 1138–1142. DOI:10.3969/j.issn.1006-7108.2014.09.024 |
| [2] | Cantley LC. The phosphoinositide 3-kinase pathway[J]. Science, 2002, 296: 1655–1657. DOI:10.1126/science.296.5573.1655 |
| [3] | Ulici V, Hoenselaar KD, Agoston H, et al. The role of Akt1 in terminal stages of endochondral bone formation:angiogenesis and ossification[J]. Bone, 2009, 45: 1133–1145. |
| [4] | Gu YX, Du J, Si MS, et al. The roles of PI3K/Akt signaling pathway in regulating MC3T3-E1 preosteoblast proliferation and differentiation on SLA and SLActive titanium surfaces[J]. J Biomed Mater Res, 2013, 101: 748–754. |
| [5] | Li H, Li T, Fan J, et al. miR-216a rescues dexamethasone suppression of osteogenesis, promotes osteoblast differentiation and enhances bone formation, by regulating c-Cbl-mediated PI3K/AKT pathway[J]. Cell Death Differ, 2015, 22: 1935–1945. |
| [6] | 陈亚辉, 龚忠勤, 崔燎. PI3K/Akt信号通路在骨质疏松病理过程中的作用[J]. 中国骨质疏松杂志, 2015, 21: 356–360. DOI:10.3969/j.issn.1006-7108.2015.03.022 |
| [7] | 曹威, 林华. 糖皮质激素所致骨骼病变研究新进展[J]. 中华骨质疏松和骨矿盐疾病杂志, 2016, 9: 81–87. DOI:10.3969/j.issn.1674-2591.2016.01.014 |
| [8] | Maricic M. Update on glucocorticoid-induced osteoporosis[J]. Rheum Dis Clin N Am, 2011, 37: 415–431. DOI:10.1016/j.rdc.2011.07.003 |
| [9] | Feng Z, Zheng W, Tang Q, et al. Fludarabine inhibits STAT1-mediated up-regulation of caspase-3 expression in dexamethasone-induced osteoblasts apoptosis and slows the progression of steroid-induced avascular necrosis of the femoral head in rats[J]. Apoptosis, 2017, 22: 1001–1012. DOI:10.1007/s10495-017-1383-1 |
| [10] | 张萌萌. 中国老年学学会骨质疏松委员会骨代谢生化指标临床应用专家共识[J]. 中国骨质疏松杂志, 2014, 20: 1263–1272. |
| [11] | Noda T, Tokuda H, Yoshida M, et al. Possible involvement of phosphatidylinositol 3-kinase/Akt pathway in insulin-like growth factor-I-induced alkaline phosphatase activity in osteoblasts[J]. Horm Metab Res, 2005, 37: 270–274. DOI:10.1055/s-2005-861468 |
| [12] | Xi JC, Zang HY, Guo LX, et al. The PI3K/AKT cell signaling pathway is involved in regulation of osteoporosis[J]. J Recept Signal Transduct Res, 2015, 35: 640–645. DOI:10.3109/10799893.2015.1041647 |
| [13] | Kawamura N, Kugimiya F, Oshima Y, et al. Akt1 in osteoblasts and osteoclasts controls bone remodeling[J]. PLoS One, 2007, 2: e1058. DOI:10.1371/journal.pone.0001058 |
| [14] | Komori T. Glucocorticoid signaling and bone biology[J]. Horm Metab Res, 2016, 48: 755–763. |
| [15] | Wang FS, Wu RW, Ko JY, et al. Heat shock protein 60 protects skeletal tissue against glucocorticoid-induced bone mass loss by regulating osteoblast survival[J]. Bone, 2011, 49: 1080–1089. DOI:10.1016/j.bone.2011.08.006 |
| [16] | Giorgino F, Pedrini MT, Matera L. Specific increase in p85alpha expression in response to dexamethasone is associated with inhibition of insulin-like growth factor-I stimulated phosphatidylinositol 3-kinase activity in cultured muscle cells[J]. J Biol Chem, 1997, 272: 7455–7463. |
| [17] | Zhang J, Yao Y, Xiao F, et al. Administration of dexamethasone protects mice against ischemia/reperfusion induced renal injury by suppressing PI3K/AKT signaling[J]. Int J Clin Exp Pathol, 2013, 6: 2366–2375. |
| [18] | Delany AM, Durant D. Glucocorticoid suppression of IGF I transcription in osteoblasts[J]. Mol Endocrinol, 2001, 15: 1781–1789. DOI:10.1210/mend.15.10.0704 |
| [19] | Wang H, Liao S, Geng R, et al. IGF-1 signaling via the PI3K/Akt pathway confers neuroprotection in human retinal pigment epithelial cells exposed to sodium nitroprusside insult[J]. J Mol Neurosci, 2015, 55: 931–940. DOI:10.1007/s12031-014-0448-7 |
| (收稿日期:2017-09-15) |

