骨骼在健康成人中不断地重建,骨形成和骨吸收是骨重建的重要过程,这一过程处于动态平衡状态,从而保持全身骨骼的强度和完整性。骨吸收是通过破骨细胞的活动完成的[1],后者是骨组织中的多核巨细胞,来源于骨髓造血干细胞。在适宜环境刺激下,骨髓造血干细胞分化成具有细胞表型的单核细胞,通过血管系统运输到全身骨组织,最终融合为成熟并具有多核的破骨细胞。已有的研究表明巨噬细胞集落刺激因子(macrophage colony-stimulating factor,M-CSF)和NF-κB受体活化剂配体(receptor activator of NF-κB ligand,RANKL)在促进破骨细胞形成和功能过程中是必需的[2]。随着人们对骨吸收研究的深入,越来越多的研究证实,全身和局部酸化也可作用于破骨细胞,使其增生和活化是发生骨吸收的又一个重要原因[3, 4]。
在前期工作中,本课题组发现酸敏感离子通道在破骨细胞中的表达[5],酸激活的酸敏感离子通道1a(acid-sensing ion channel 1a,ASIC1a)参与细胞Ca2+内流介导细胞的分化[6]。本研究采用体外细胞模型,模拟破骨细胞外酸化环境,探索ASIC1a对破骨细胞增生和骨吸收作用及其机制的影响,为骨质疏松症的防治提供新靶点和理论基础。
材料和方法 材料和试剂携带针对ASIC1a干扰片段的慢病毒由上海吉玛生物技术有限公司构建;小牛血清和α-MEM培养液(美国Gibco公司);RANKL 和M-CSF(美国Peprotech公司);抗酒石酸酸性磷酸酶(tartrate-resistant acid phosphatase,TRACP)染色试剂盒(美国Sigma公司);BCA-200 Protein 分析试剂盒(Pierce公司);NFATc1抗体(Santa Cruz Biotechnology公司)。
实验分组实验分正常组,pH6.0组,siRNA组。
破骨细胞培养根据文献[7],在无菌条件下分离SD大鼠股骨,在超净台剪断两侧骨骺端,用1 mL注射针头将含有双抗的α-MEM培养液轻轻冲洗股骨髓腔,将冲下的骨髓细胞混合液,在200目筛网中过滤后接种到25 mL培养皿中,37 ℃、5% CO2条件下孵育24 h。收集未贴壁的细胞,1500 r/min,离心10 min,用α-MEM培养液重悬细胞沉淀,将5×106 /mL的细胞接种于预先置放骨片的细胞培养皿中。48 h后,用PBS充分冲洗3 次,将未黏附的淋巴细胞和血细胞去除掉。用贴壁的骨髓单核细胞用作细胞的前体细胞。用RANKL (50 μg/L) 和M-CSF(30 μg/L)诱导前体细胞5~6 d。每3 d换液1 次,第6天后,将细胞固定,按Sigma公司说明书进行TRACP染色,树胶封固,显微镜下观察,以3个或3个以上的TRACP(+)多核细胞作为破骨细胞。
siRNA转染大鼠全长ASIC1a cDNA序列从GenBank (U94403)获得,为了稳定敲除ASIC1a基因,慢病毒包装的载体用于感染细胞,根据产品说明,靶向的破骨细胞是被慢病毒感染24~48 h,取干扰效果最好的对数生长期细胞进行随后的实验。
破骨细胞形成和骨吸收功能测定根据文献[8],测定破骨细胞的形成和骨吸收功能,细胞被筛选在培养板中,使用相差显微镜在一个标准的中心区域(3.14 cm2)计数多核细胞。然后用含有Hepes缓冲液的pH6.0细胞外液诱导18 h,细胞用4%的多聚甲醛固定,PBS洗2次,TRACP染色确认破骨细胞的形成。为了测量骨吸收,使用同样的方法,将1×104/mL的细胞重新种植在骨片上,再上述细胞外液诱导18 h,然后通过超声波清洗骨片,用甲苯胺蓝染色确定吸收陷窝,吸收面积Image J软件测量定值进行统计分析。
Western blotting分析提取的蛋白样品加入等体积上样缓冲液和10% DTT,95 ℃加热变性5 min,8% SDS-PAGE电泳(积层胶60 mV,分离胶120 mV)后电转移(100 mA 2 h或60 mA 3 h)至PVDF膜,丽春红染色观察蛋白转移情况。5%脱脂牛奶室温封闭2 h,1∶500加入多克抗隆体(nuclear factor of activated T-cells cytoplasmic 1,NFATc1),4 ℃ 孵育过夜,TBST洗涤10 min,3次。分别加入1∶2 000稀释的辣根过氧化物酶标记的二抗,室温孵育1 h,再TBST洗涤10 min,3次。然后置入含化学发光试剂A、B的水溶液中激发荧光,暗室中压X片,显影、定影。
统计学方法应用SPSS 18.0统计软件分析。计量资料以均数±标准差($\bar x \pm s$)表示,数据采用单因素方差分析,以P<0.05为差异有统计学意义。
结果 阻断ASIC1a对酸诱导破骨细胞形成的影响为了研究ASIC1a介导的胞外酸化诱导对破骨细胞形成的影响,对诱导不同阶段的骨髓单核细胞进行TRACP染色,结果表明接种72 h后出现阳性多核细胞,细胞质呈紫红色,细胞核未着色如空泡样,核膜着色深,细胞核有的聚集在细胞中央。与正常组相比,细胞外pH6.0组破骨样细胞数量明显增加(P=0.000),体积不断增大,形态演变为圆形、长梭形、花瓣形等不规则形状,有些细胞还出现伪足,细胞数量明显增多。与pH6.0组相比,ASIC1-siRNA对酸诱导破骨细胞数量的增加起到明显抑制作用(P=0.000) (图 1)。

|
| 图 1 细胞TRACP染色观察酸对破骨细胞形成 Fig 1 Acidosis-induced osteoclast formation was performed using TRACP staining(×200) A:TRACP染色的破骨细胞; B:显微镜下显示3个核或以上的破骨细胞数量; n=12, 与pH 7.4组比较,#P<0.01;n=12, 与pH 6.0组比较,*P<0.01; M-CSF:巨噬细胞集落刺激因子; TRAP:抗酒石酸酸性磷酸酶 |
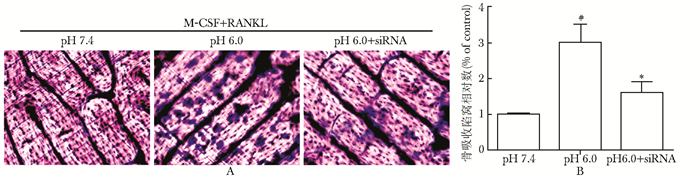
在培养细胞时放入骨片,成熟的破骨细胞会释放出多种酶类,分解骨组织,将骨片甲苯胺蓝染色,从显示陷窝的大小和多少判断其骨吸收能力。细胞外pH 6.0组骨片上形成的破骨细胞多,骨吸收陷窝大,数量多,与正常组相比,pH 6.0组骨吸收能力明显增强(P=0.000)。而ASIC1-siRNA组骨吸收陷窝明显减少,与pH 6.0组相比,明显抑制破骨细胞骨吸收能力(P=0.000) (图 2)。
|
| 图 2 ASIC1a介导酸诱导的破骨细胞骨吸收功能 Fig 2 Bone resorption lacuna stained with toluidine blue(甲苯胺蓝染色, ×200) A:甲苯胺蓝染色破骨细胞骨吸收陷窝;B:骨吸收陷窝相对数量;n=12, 与pH 7.4组比较,#P=0.000;n=12, 与pH 6.0组比较,*P=0.000; ASIC1a:酸敏感离子通道1a |
Western blotting法检测发现,在细胞外无钙条件下,酸诱导的细胞内NFATc1蛋白无明显变化;而在细胞外有钙条件下,酸诱导的NFATc1蛋白表达明显增强,而异性阻断ASIC1a的siRNA组,对酸诱导NFATc1蛋白表达具有明显的抑制作用(图 3)。

|
| 图 3 ASIC1a介导酸诱导破骨细胞骨NFATc1蛋白表达 Fig 3 ASIC1a was involved in acid-stimulated NFATc1 signaling in osteoclastogenesis A:NFATc1蛋白表达;B:NFATc1蛋白相对灰度值; n=12, 与pH 7.4组比较,#P=0.000 ; n=12, 与pH 6.0组比较,*P=0.000; ASIC1a:酸敏感离子通道1a |
骨质疏松症是低骨量及骨组织微结构退变为特征的一种全身性代谢骨病,随着社会老龄化的加深,骨质疏松症在中老年人中渐渐普遍,由于其本身没有特殊的临床表现,而且此病在发展中又是个缓慢的渐进过程,因而直到病发,一直被大多数人所忽视。急待改进和完善有效的预防及治疗方法[9]。因此,探索骨质疏松症的发病机制并且筛选新的抗骨质疏松症靶点对于其防治有重要意义。
破骨细胞是骨吸收的主要功能性细胞,在骨重建过程中以及维持骨量的稳态中发挥重要的作用,目前大多认为破骨细胞起源于造血干细胞,属于单核-巨噬细胞谱系。破骨细胞的前体细胞在一些细胞外物质如细胞因子的直接或间接刺激下,逐渐增生、分化、融合成为具有多核的成熟破骨细胞,对细胞外环境的变化及其敏感[10]。近年来发现,细胞外酸化可明显诱导破骨细胞分化、黏附、迁移及骨吸收作用[11],本研究发现,细胞外液pH 6.0能明显诱导破骨细胞的形成及其骨吸收功能。
近年来,由于ASICs具有广泛的生理学功能和重要的病理学意义而备受研究者关注。ASICs属于DEG/ENaC家族中的一员,到目前为止,已克隆了由4个基因编码(ASIC1、ASIC2、ASIC3、ASIC4)的6个ASICs亚基:ASIC1a、ASIClb、ASIC2a、ASIC2b、ASIC3、ASIC4。它们在体内广泛分布表达,除了对Na+有通透性以外,ASIC1a同聚体通道对Ca2+也有一定的通透性[12],本课题组前期研究发现,ASICs亚基ASIC1a在骨细胞中包括软骨和破骨细胞具有丰富的表达,并发挥重要作用[13]。大量研究表明,Ca2+-NFAT信号途径对破骨细胞的形成和活化具有重要调节作用[12],为了探讨ASIC1a介导酸诱导的NFATc1信号通路在破骨细胞形成和活化中的作用,有研究发现,细胞内Ca2+ 浓度升高,导致对破骨细胞生成的主导性转录调节因子NFATc1激活,是破骨细胞增生与活化中的重要分子事件[14]。本课题组前期研究发现ASIC1a介导破骨细胞内的钙离子,导致NFATc1的激活;本研究发现阻断ASIC1a可明显抑制酸诱导的NFATc1蛋白的表达,提示ASIC1a介导NFATc1的转录在酸诱导的破骨细胞形成与活化中发挥重要作用。
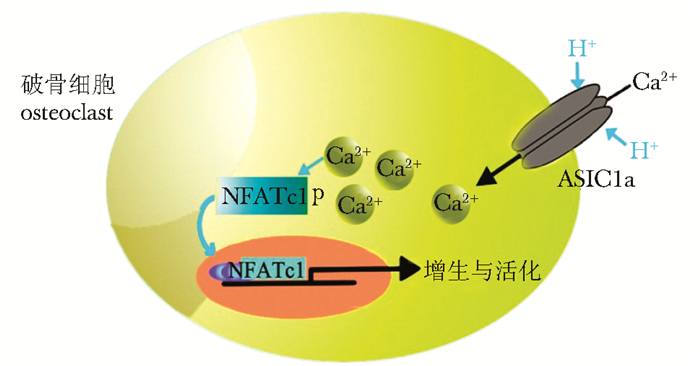
本实验研究ASIC1a对酸诱导的破骨细胞形成和骨吸收的作用。结果显示,阻断ASIC1a对酸诱导的破骨细胞形成和骨吸收具有明显的抑制作用,其机制可能是抑制Ca2+-NFAT信号途径(图 4)。
|
| 图 4 ASIC1a介导酸诱导的破骨细胞形成与活化工作模式图 Fig 4 Schematic diagram of the potential mechanism of ASIC1a involved in acid-induced osteoclast formation ASIC1a:酸敏感离子通道1a |
综上,本研究探索ASIC1a在破骨细胞生物学代谢中的作用,为探讨ASICs对破骨细胞的直接调控作用奠定基础,进而为骨质疏松的防治提供新思路和新靶点。
| [1] | 项守奎,华飞,章振林. 褪黑素与骨质疏松[J]. 中华骨质疏松和骨矿盐疾病杂志,2015,1:58-62. |
| [2] | Kim JH,Kim N. Regulation of NFATc1 in osteoclast differentiation[J]. J Bone Metab,2014,21:233-241. |
| [3] | Ahn H,Kim JM,Lee K,et al. Extracellular acidosis accelerates bone resorption by enhancing osteoclast survival,adhesion,and migration[J]. Biochem Biophys Res Commun,2012,418:144-148. |
| [4] | Ahn H,Kim JM,Lee K,et al. Extracellular acidosis accelerates bone resorption by enhancing osteoclast survival,adhesion,and migration[J]. Biochem Biophys Res Commun,2012,418:144-148. |
| [5] | 陆伟国,袁凤来,王玉,等. 大鼠破骨细胞的诱导及其酸敏感离子通道的表达[J]. 解剖学杂志,2010,33:19-22. |
| [6] | Li X,Xu RS,Jiang DL,et al. Acid-sensing ion channel 1a is involved in acid-induced osteoclastogenesis by regulating activation of the transcription factor NFATc1[J]. FEBS Lett,2013,587:3236-3242. |
| [7] | Shin J, Jang H, Lin J,et al.. PKCβ positively regulates RANKL-induced osteoclastogenesis by inactivating GSK-3β [J]. Mol Cells. 2014, 37:747-752. |
| [8] | 鲁秀敏,苏楠,李福兵,等. 小鼠破骨细胞骨髓诱导模型的建立及功能观察[J]. 第三军医大学学报,2008,30:521-524. |
| [9] | 夏维波,苏华,周学瀛. 维生素D缺乏与骨质疏松[J]. 中华骨质疏松和骨矿盐疾病杂志,2009,2:145-154. |
| [10] | Pereverzev A,Komarova SV,Korcok J,et al. Extracellular acidification enhances osteoclast survival through an NFAT-independent,protein kinase C-dependent pathway[J]. Bone,2008,42:150-61. |
| [11] | Kato K,Matsushita M. Proton concentrations can be a major contributor to the modification of osteoclast and osteoblast differentiation,working independently of extracellular bicarbonate ions[J]. J Bone Miner Metab,2014,32:17-28. |
| [12] | Sherwood TW,Frey EN,Askwith CC. Structure and activity of the acid-sensing ion channels[J]. Am J Physiol Cell Physiol,2012,303:C699-710. |
| [13] | Li X,Xu RS,Jiang DL,et al. Acid-sensing ion channel 1a is involved in acid-induced osteoclastogenesis by regulating activation of the transcription factor NFATc1[J]. FEBS Lett,2013,587:3236-3242. |
| [14] | 张元豫,刘霞,李坤,等. 共培养体系中重组结核杆菌热休克蛋白10对破骨细胞相关基因表达的影响(R68)[J]. 中国骨质疏松杂志,2014, 7:755-760,788. |
| (收稿日期:2015-07-13) |

