骨硬化症(osteopetrosis)是一种以骨吸收障碍、骨密度异常增高为特点的罕见遗传性骨骼疾病,病因为破骨细胞数量不足或功能障碍,由德国放射学家Albers-Schönberg于1904年首次描述[1]。近年来研究显示,骨硬化症致病基因包括氯离子第7通道蛋白(chloride channel 7,CLCN7)、T细胞免疫调节蛋白基因(T-cell immune regulator,TCIRG1)、骨硬化相关跨膜蛋白1 (osteopetrosis associated transmembrane protein1, OSTM1)、碳酸酐酶Ⅱ(carbonic anhydrase Ⅱ, CAⅡ)、核因子κB受体活化因子(receptor Activator for nuclear factor-κ B, RANK)及其配体(RANKL)、组织蛋白酶K (cathepsin K, CTSK)、低密度脂蛋白受体相关蛋白(low density lipoprotein receptor-related protein 5, LRP5) 和NEMO (NF-κB essential modulator)等。根据遗传方式骨硬化症分为常染色体显性遗传骨硬化症(autosomal dominant osteopetrosis, ADO)、常染色体隐性遗传骨硬化症(autosomal recessive osteopetrosis, ARO)及X连锁遗传骨硬化症(X-linked osteopetrosis, XLO)3种类型,其中ADO病情相对较轻,患病率为1/20 000,根据致病基因和临床表现又分为Ⅰ、Ⅱ、Ⅲ 3种亚型。
骨硬化症临床表现具有广泛的异质性[2]。部分患者表现为致命性临床特征,如重度贫血、全血细胞减少、脓毒血症、肝脾肿大等;部分患者症状较轻微或无症状,仅由骨骼影像学检查发现。该病的影像学表现分为中心性骨硬化和弥漫性骨硬化两种类型;椎体呈典型“夹心饼”样改变,四肢干骺端增宽呈“酒瓶征”、髂骨有“骨中骨”现象[2]。尽管骨硬化症临床较少见,但其可能导致多发骨折、骨骼畸形及多系统受累,明显影响患者生活质量,病情严重者还可能危及生命。
由于骨硬化症相对罕见,对疾病的临床表型及遗传学研究相对不足,为此本文作者对1例罕见的骨硬化症患者及其家系进行表型和基因型研究,以深入了解该病的临床特征及发病机制。
对象与方法对象
患者,女,32岁,主诉:骨痛、脊柱活动受限1年,于2016年7月就诊于北京协和医院内分泌科。患者1年前无明显诱因出现脊柱及左髋部疼痛,伴脊柱僵直,腰椎前屈、侧弯受限,否认骨折史,无口干多饮,无尿中排石史。个人史:无特殊。家族史:父母非近亲婚配,否认类似病史。查体:血压110/80 mmHg(1 mmHg=0.133 kPa),心率78次/min,结膜无苍白,未见氟斑牙,粗测视力、听力无异常。肝脾触诊未及肿大。脊柱僵直,颈椎、胸椎及腰椎前屈、侧弯均受限。骨骼无压痛,双肾区无叩痛。
致病基因突变研究
采集患者、父母、弟弟及儿子外周静脉血,提取外周血白细胞基因组DNA(QIAamp DNA Blood Mini试剂盒,德国)。采用二代靶向捕获测序技术,检测致病基因突变。本研究采用的基因芯片涵盖骨代谢疾病相关致病基因700种,包括骨硬化症致病基因CLCN7、TCIRG1、OSTM1、PLEKHM1、LRP5、CTSK、RANK、RANKL、CAⅡ、NEMO等。目标区域碱基覆盖度为98.95%,测序深度达200×。应用SOAPsnp和SAMtools(1.4) 软件分别进行单个核苷酸突变和插入/缺失突变的查询,随后与数据库(NCBI dbSNP,the 1000 Genomes Project, NHLBI)进行比对,查找可能的基因突变。
对于二代靶向测序发现的突变基因,采用Prime 3设计引物(表 1),扩增目的基因所有外显子、外显子和内含子交界区。采用的PCR反应体系共30 μL:Taq mix 15 μL、上下游引物各1 μL、基因组DNA 2 μL和ddH2O 11 μL。PCR反应条件为:预变性95 ℃,3 min;变性95 ℃,30 s;退火58~63 ℃,30 s;延伸72 ℃,1 min,循环35次;总延伸72 ℃, 10 min。PCR扩增产物纯化后,采用Sanger直接测序,测序结果与参考序列NM_001287.5比对,以确定突变位点及类型。并进一步与NCBI SNP、人类基因突变数据库(http://www.hgmd.cf.ac.uk/ac/index.php)进行比对,排除基因多态性位点,并确定其是否为新突变。
| 外显子 | 正向引物(5′→3′) | 反向引物(5′→3′) | 产物长度(bp) | 退火温度(℃) |
| 1 | GCAGAACGGGGTCCTCAG | CTCCAGGACCGAGACACG | 485 | 60 |
| 2 | AGTGAGAATCCACGGAGCAG | TCCCTGTCACCCTCTGCTAA | 203 | 60 |
| 3~4 | TGCTGGGATTGTAGGTGTCA | GTCAGAGGAGGAGGGAGGAG | 549 | 60 |
| 5 | CTGCTGCTGCCAGAGTGAC | TGGGCTCAGGACTTCTGC | 277 | 60 |
| 6 | ATCTGCCAGGCTGGTCTGT | ATTCACCAAGACCCCCAATC | 260 | 60 |
| 7 | ACGTGTCTGCTGCTCTCCTC | GCTCCTGAACCAGCAAAGAG | 245 | 60 |
| 8 | TGTGCTGTTTTACGGCTCAG | CGGTGCTCAGAGACACACAT | 228 | 59 |
| 9 | CACGCCCATGTGTGTCTCT | CCAGGCTGTCCTCAGATGG | 505 | 60 |
| 10~11 | GCAGTTGCTCTCCCTTTCTG | CCCATGGTGGGAAATGAG | 614 | 59 |
| 12 | CGATGGTCCCTGCTGGTC | AACCTGGGCCTTAAGCAAAC | 268 | 60 |
| 13 | TCTGTGGGGACAGCTCTCTT | TCTCTATGGCCACGTCACAG | 228 | 59 |
| 14 | CAGCTTCTCCTGCCATCTG | GGCTGTGGCCTAGGAGTGTA | 249 | 59 |
| 15 | GGCAACAAGAGCAAAACTCC | TAGCCTAAGCGAGCCTCCTG | 371 | 59 |
| 16 | ACAGGGTACACGGCCTCTC | ACTCAGCCAGAAGGCATCAC | 257 | 60 |
| 17 | CCTGGAAGGTGACTGTGAGG | TCCTGCCCTGGGACTTCT | 360 | 60 |
| 18~19 | GCCTCCTCCGTCTGTGTATC | CTGTTTGGAGGCTCACAGG | 517 | 59 |
| 20~21 | GGGTAGGCTCAGGGTTTCTG | AAACCTTGCCGTGTGCTTC | 600 | 61 |
| 22~23 | AAATCTGGCCGGAACAGG | CAGGAGACAGAGTCACCGAGT | 549 | 59 |
| 24 | GAGCCAGCTTGGGTGAGG | GTGCTGGGTCCTGTGCTT | 265 | 61 |
| 25-(1) | AAGCACAGGACCCAGCAC | AGACCACTGCCCACAACAG | 477 | 59 |
| 25-(2) | CTCCCGGAGTCACTGGTTT | CCTTGGAGGTTTTTCTCAGC | 639 | 58 |
| 25-(3) | GGAGAGCAGCTTCACACTGG | ACTCCCTGGGGAGGAAATAC | 633 | 59 |
| 25-(4) | GGCAGAGGCAACTTCAGTG | AGGACACCCCGGACACAG | 747 | 59 |
采用BioEdit(7.0.9.1) 软件分析突变位点在不同物种中的保守性,并采用Polyphen 2(http://genetics.bwh.harvard.edu/pph2/)软件对发生突变的蛋白进行致病性预测。
血生化及骨骼影像学检查
对于携带致病基因突变的患者及其母亲,留取空腹静脉血,行血常规、血气分析、骨转换生化指标等检测。采用罗氏电化学发光免疫分析仪测定血清骨吸收指标β-胶原Ⅰ型胶原交联羧基末端肽(C-terminal crosslinking β-isomerized carboxy-telopeptide of type Ⅰ collagen, β-CTX)、骨形成指标总碱性磷酸酶(alkaline phosphatase, ALP)、25羟维生素D (25 hydroxy vitamin D, 25OHD)、全段甲状旁腺素(intact parathyroid hormone, PTH)的浓度。完成头颅、胸腰椎、骨盆X线检查。采用双能X线骨吸收检测仪(dual energy X ray absorptiometry, DXA, GE Lunar)测量腰椎2-4后前位、股骨颈、大转子及全髋骨密度(g/cm2),并计算Z或T值。
本研究经北京协和医院科研伦理委员会批准,研究前征得患者及其家系成员同意,并签署知情同意书。
结果临床表型
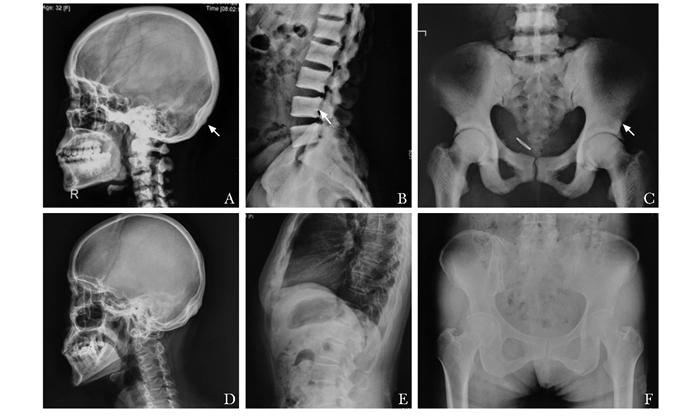
患者血常规、血气分析结果正常。生化检查示血钙、磷水平正常,骨转换生化指标ALP 230 U/L、β-CTX 1.150 μg/L,均轻度升高。患者25OHD水平明显降低(7.6 μg/L)、PTH浓度升高(129.0 ng/L,提示患者存在严重维生素D缺乏,引起继发甲状旁腺功能亢进症的可能)。骨密度检查示患者腰椎2-4、股骨颈、全髋BMD明显升高(Z值分别为13.8、10.4、9.3)(表 2)。X线片显示全身骨质密度增高,胸腰椎呈“夹心饼”样改变,髂骨见“骨中骨”现象(图 1)。
| 指标 | 患者 | 患者母亲 | 参考范围 |
| RBC (×1012/L) | 4.78 | 4.36 | 3.50~5.00 |
| Hb (g/L) | 136 | 136 | 110~150 |
| Cr (μmol/L) | 70 | 52 | 45~84 |
| ALT (U/L) | 8 | 14 | 9~50 |
| 血气pH/HCO3- (mmol/L) | 7.434/22.0 | NA | 7.35~7.45/22.0~27.0 |
| Ca (mmol/L) | 2.28 | 2.48 | 2.13~2.70 |
| P (mmol/L) | 1.01 | 1.35 | 0.81~1.45 |
| ALP (U/L) | 230 | 107 | 50~135 |
| 25OHD (μg/L) | 7.6 | 21.5 | 30~50 |
| 1, 25(OH)2D (ng/L) | 35.51 | NA | 19.6~54.3 |
| β-CTX (μg/L) | 1.150 | 0.931 | 0.26~0.512 |
| PTH (ng/L) | 129.0 | 33.6 | 12.0~65.0 |
| 血气pH/HCO3- (mmol/L) | 7.434/22.0 | NA | 7.35~7.45/22.0~27.0 |
| L2-4 BMD (g/m2) | 2.846 | 0.898 | |
| L2-4 BMD | 13.8* | -2.0** | |
| FN BMD (g/m2) | 2.165 | 0.924 | |
| FN BMD | 10.4* | 0.0** | |
| TH BMD(g/m2) | 2.166 | 0.829 | |
| TH BMD | 9.3* | -1.1** | |
| RBC:红细胞;Hb:血红蛋白;Cr:肌酐;ALT:丙氨酸转氨酶;Ca:血钙;P:血磷;ALP:碱性磷酸酶;25OHD:25羟维生素D;1, 25(OH)2D:1, 25双羟维生素D;β-CTX:β胶原降解产物;PTH:甲状旁腺素;HCO3-:碳酸氢根;L2-4 BMD:腰椎2-4骨密度;FN BMD:股骨颈骨密度;TH BMD:全髋骨密度;*骨密度Z值,绝经前女性采用Z值;**骨密度T值,绝经后女性采用T值 | |||
|
| 图 1 ADO-Ⅱ患者及其母亲骨骼影像学表现 Figure 1 Radiological findings in bone of the patient with ADO-Ⅱ and her mother A:先证者头颅侧位相,箭头示颅骨及颅底骨密度增高;B:先证者胸腰椎侧位相,箭头示椎体骨密度增高,呈“夹心饼”样;C:先证者髂骨正位相,呈“骨中骨”现象;D:先证者母亲头颅; E:先证者母亲胸腰椎骨质疏松; F:先证者母亲左髋臼退行性变;ADO-Ⅱ:常染色体显情遗传骨硬化症Ⅱ型 |
患者母亲血生化检查示β-CTX升高(0.931 μg/L),余生化指标正常。骨密度结果符合骨量减少,X线片示头颅、椎体、骨盆骨质疏松。
致病基因突变
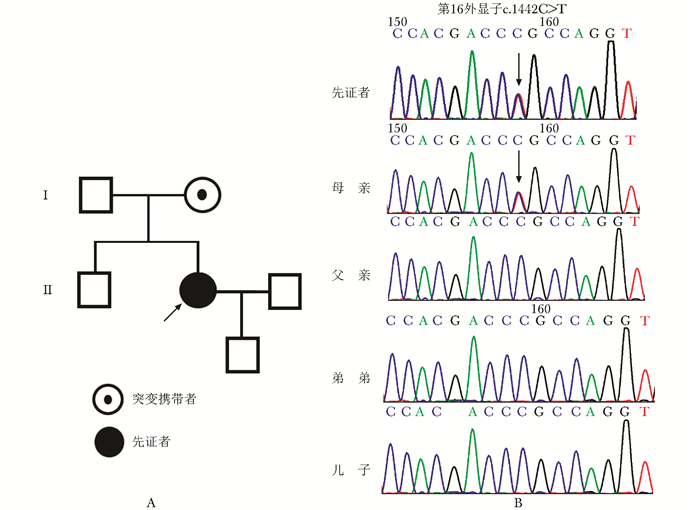
患者CLCN7基因的第16外显子存在c.1442C>T杂合突变,导致编码的CLCN7蛋白第481位氨基酸脯氨酸被亮氨酸替换(p.Pro481Leu)。患者母亲亦存在该位点基因突变,患者父亲、弟弟及儿子均未发现存在上述基因突变(图 2)。
|
| 图 2 ADO-Ⅱ患者家系图及CLCN7基因测序结果 Figure 2 Pedigree of the patient with ADO-Ⅱ and Sanger sequencing results of the CLCN7 gene of the patient A:家系图;B:基因测序结果;测序结果示先证者具有CLCN7第16外显子c.1442C>T杂合突变,患者母亲为突变基因携带者,患者父亲、弟弟及儿子没有致病基因突变;ADO-Ⅱ:常染色体显情遗传骨硬化症Ⅱ型 |
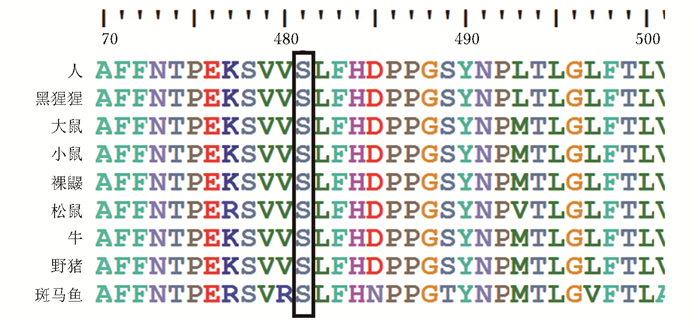
c.1442C>T错义导致481位脯氨酸变为亮氨酸(p.Pro481Leu),该位点脯氨酸在人、黑猩猩、大鼠、小鼠、裸鼹鼠、松鼠、牛、野猪、斑马鱼中高度保守(图 3)。Polyphen2蛋白预测软件评分为0.994,该突变具有较高的致病性。
|
| 图 3 CLCN7第481位脯氨酸在物种进化中的保守性 Figure 3 Sequence conservation of Pro481 in CLCN7 in species |
骨硬化症是罕见的遗传性骨病,本研究对1例表现为骨痛、脊柱活动受限的青年女性患者,进行疾病表现型及致病基因突变检测。结果显示患者骨骼影像学具有椎体“夹心饼”样改变、髂骨呈“骨中骨”等特征性改变,腰椎及股骨近端骨密度异常升高。患者CLCN7基因第16外显子存在杂合性错义突变(c.1442C>T),该突变为首次报道的新突变。患者母亲亦检出该突变,但无骨硬化症相关临床表现。
根据患者典型临床表现及致病基因突变检测结果,提示患者为常染色体显性遗传骨硬化症Ⅱ型,即ADO-Ⅱ型(OMIM 166600)。该病又称为Albers-Schönberg病,是骨硬化症中最常见的类型,由CLCN7基因突变导致氯离子第7通道蛋白异常,破骨细胞不能完成骨吸收作用而致病[3]。CLCN7基因位于16p13.3,具有25个外显子,编码氯离子通道蛋白(chloride channel,CLC)超家族含有805个氨基酸的第7通道蛋白[4]。CLC是由两个同源单体以反向对称结构组成的同源二聚体;每一个单体包含18个膜内的α螺旋体、4个高度保守的Cl-结合位点和两个胱硫醚-β-合酶(cystathionine beta synthase, CBS)结构域[5]。CLCN7位于破骨细胞褶皱缘和溶酶体隔室,主要作用是将破骨细胞内的Cl-运输入细胞囊泡,与H+形成溶骨的酸性环境[6]。CLCN7突变使破骨细胞无法形成酸性微环境,导致骨吸收障碍,引起骨硬化症[7]。CLCN7杂合突变导致病情较轻的ADO-Ⅱ,而纯合或复合杂合突变可能致病情严重的ARO和中间型ARO。对于ADO-Ⅱ,骨吸收障碍可导致BMD增高、骨脆性增加、骨骼畸形,单核巨噬细胞遗传缺陷可致贫血,髓外代偿造血可引起肝脾肿大和溶血,颅神经受压可致视力、听力障碍等表现。
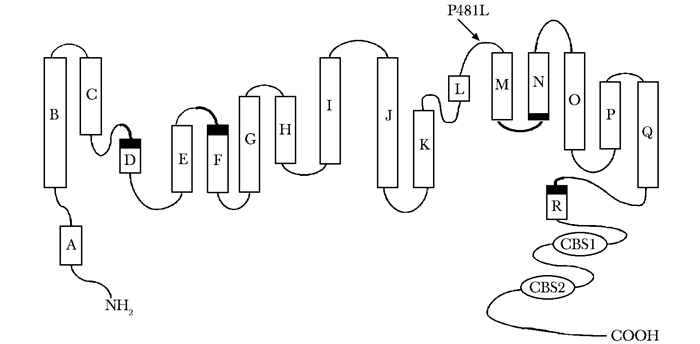
目前已检出导致ADO-Ⅱ的CLCN7基因突变有41种,位于该蛋白不同结构区域,相对集中于H螺旋第313-318位氨基酸和蛋白羧基端的膜内部分[8-11]。文献报道位于D和E螺旋间的G215R是热点突变,该突变可致氢离子排泌到溶酶体的能力降低[12]。研究发现,CLCN7基因位于CBS2结构域的R767W突变是中国ADO-Ⅱ人群的热点突变[13-14]。本研究检出的CLCN7基因突变位于膜内L与M螺旋体之间(图 4),该区域突变未见文献报道。有文献报道1例位于L螺旋体S473N杂合突变的ADO-Ⅱ患者,与本患者突变位置邻近,其临床表现也与本例相似[8],提示发生在此区域的杂合错义突变对氯离子通道蛋白的影响相对较小,主要累及骨骼系统[15]。
|
| 图 4 CLCN7蛋白结构示意图以及突变的蛋白位点 Figure 4 Topological model for the CLCN7 protein and the position affected by the novel mutations A~R:为18个α螺旋;D、F、N、R:螺旋体上黑色标记为Cl-结合位点;黑色箭头:本例新发现突变的蛋白位点 |
本研究患者的母亲带有相同致病基因突变,却无骨硬化症表现,提示该致病基因突变存在外显不全现象。以往研究表明,ADO-Ⅱ表型变异较大,其外显率约66%,动物研究发现,CLCN7基因G215R突变在不同基因背景的小鼠中,其临床表型和疾病严重度明显不同[16],有研究推测可能与甲基化等基因修饰有关[10, 17-18]。ADO-Ⅱ临床表现主要包括病理性骨折、骨坏死或骨髓炎、视力或听力丧失、骨髓造血功能衰竭等[19]。生化检查方面,抗酒石酸酸性磷酸酶5b升高是骨硬化症的特征性表现,并可预测疾病严重程度[8]。有研究报道1个ADO-Ⅱ家系4例患者ALP均“升高”[20];动物实验也发现Balb/c和B6雌性骨硬化症小鼠的β-CTX明显升高[21]。本患者β-CTX明显升高,可能与疾病本身相关,也可能与患者维生素D缺乏,引发继发甲状旁腺功能亢进相关。
ADO-Ⅱ尚无有效的治疗方法。有研究认为高剂量骨化三醇有潜在的激活破骨细胞介导的骨吸收作用,但其对ADO-Ⅱ疗效并不明显[22]。近来研究示干扰素γ可缓解ADO-Ⅱ患者的临床症状,其机制尚不清楚[23]。未来,针对患者CLCN7致病基因突变,研究针对性治疗措施,才可能真正缓解ADO-Ⅱ患者的病情。
由此可见,骨硬化症是一种罕见的遗传性骨骼疾病,本研究发现CLCN7第16外显子的c.1442C>T杂合突变是导致ADO-Ⅱ的新型致病基因突变,可引起患者骨密度异常增高、椎体呈“夹心饼”样改变、骨盆出现“骨中骨”的特征性临床表现。然而,ADO-Ⅱ具有明显的表型异质性和致病基因外显不全。本研究丰富了CLCN7的基因突变谱,有助于提高对骨硬化症的临床表型和发病机制的认识。
| [1] | Sobacchi C, Schulz A, Coxon FP, et al. Osteopetrosis:genetics, treatment and new insights into osteoclast function[J]. Nat Rev Endocrinol, 2013, 9: 522–536. DOI:10.1038/nrendo.2013.137 |
| [2] | Del FA, Cappariello A, Teti A. Genetics, pathogenesis and complications of osteopetrosis[J]. Bone, 2008, 42: 19–29. DOI:10.1016/j.bone.2007.08.029 |
| [3] | Cleiren E, Benichou O, Van Hul E, et al. Albers-Schonberg disease (autosomal dominant osteopetrosis, type Ⅱ) results from mutations in the ClCN7 chloride channel gene[J]. Hum Mol Genet, 2001, 10: 2861–2867. DOI:10.1093/hmg/10.25.2861 |
| [4] | Schmidt-Rose T, Jentsch TJ. Transmembrane topology of a CLC chloride channel[J]. Proc Natl Acad Sci U S A, 1997, 94: 7633–7638. DOI:10.1073/pnas.94.14.7633 |
| [5] | Kornak U, Kasper D, Bosl MR, et al. Loss of the ClC-7 chloride channel leads to osteopetrosis in mice and man[J]. Cell, 2001, 104: 205–215. DOI:10.1016/S0092-8674(01)00206-9 |
| [6] | Graves AR, Curran PK, Smith CL, et al. The Cl-/H+ antiporter ClC-7 is the primary chloride permeation pathway in lysosomes[J]. Nature, 2008, 453: 788–792. DOI:10.1038/nature06907 |
| [7] | Chu K, Snyder R, Econs MJ. Disease status in autosomal dominant osteopetrosis type 2 is determined by osteoclastic properties[J]. J Bone Miner Res, 2006, 21: 1089–1097. DOI:10.1359/jbmr.060409 |
| [8] | Pang Q, Chi Y, Zhao Z, et al. Novel mutations of CLCN7 cause autosomal dominant osteopetrosis type Ⅱ (ADO-Ⅱ) and intermediate autosomal recessive osteopetrosis (IARO) in Chinese patients[J]. Osteoporos Int, 2016, 27: 1047–1055. DOI:10.1007/s00198-015-3320-x |
| [9] | Zeng B, Li R, Hu Y, et al. A novel mutation and a known mutation in the CLCN7 gene associated with relatively stable infantile malignant osteopetrosis in a Chinese patient[J]. Gene, 2016, 576: 176–181. DOI:10.1016/j.gene.2015.10.021 |
| [10] | Bollerslev J, Henriksen K, Nielsen MF, et al. Autosomal dominant osteopetrosis revisited:lessons from recent studies[J]. Eur J Endocrinol, 2013, 169: R39–57. DOI:10.1530/EJE-13-0136 |
| [11] | Zheng H, Shao C, Zheng Y, et al. Two novel mutations of CLCN7 gene in Chinese families with autosomal dominant osteopetrosis (type Ⅱ)[J]. J Bone Miner Metab, 2016, 34: 440–446. DOI:10.1007/s00774-015-0682-2 |
| [12] | Alam I, Gray AK, Chu K, et al. Generation of the first autosomal dominant osteopetrosis type Ⅱ (ADO2) disease models[J]. Bone, 2014, 59: 66–75. DOI:10.1016/j.bone.2013.10.021 |
| [13] | Wang C, Zhang H, He J, et al. The virulence gene and clinical phenotypes of osteopetrosis in the Chinese population:six novel mutations of the CLCN7 gene in twelve osteopetrosis families[J]. J Bone Miner Metab, 2012, 30: 338–348. DOI:10.1007/s00774-011-0319-z |
| [14] | Zhang Z, He J, Zhang H, et al. Identification of the CLCN7 gene mutations in two Chinese families with autosomal dominant osteopetrosis (type Ⅱ)[J]. J Bone Miner Metab, 2009, 27: 444–451. DOI:10.1007/s00774-009-0051-0 |
| [15] | Leisle L, Ludwig CF, Wagner FA, et al. ClC-7 is a slowly voltage-gated 2Cl(-)/1H(+)-exchanger and requires Ostm1 for transport activity[J]. Embo J, 2011, 30: 2140–2152. DOI:10.1038/emboj.2011.137 |
| [16] | Alam I, Mcqueen AK, Acton D, et al. Phenotypic severity of autosomal dominant osteopetrosis type Ⅱ (ADO2) mice on different genetic backgrounds recapitulates the features of human disease[J]. Bone, 2017, 94: 34–41. DOI:10.1016/j.bone.2016.10.016 |
| [17] | Chu K, Koller DL, Snyder R, et al. Analysis of variation in expression of autosomal dominant osteopetrosis type 2:searching for modifier genes[J]. Bone, 2005, 37: 655–661. DOI:10.1016/j.bone.2005.06.003 |
| [18] | Sulewska A, Niklinska W, Kozlowski M, et al. DNA methylation in states of cell physiology and pathology[J]. Folia Histochem Cytobiol, 2007, 45: 149–158. |
| [19] | Waguespack SG, Hui SL, Dimeglio LA, et al. Autosomal dominant osteopetrosis:clinical severity and natural history of 94 subjects with a chloride channel 7 gene mutation[J]. J Clin Endocrinol Metab, 2007, 92: 771–778. DOI:10.1210/jc.2006-1986 |
| [20] | Deng H, He D, Rong P, et al. Novel CLCN7 mutation identified in a Han Chinese family with autosomal dominant osteopetrosis-2[J]. Mol Pain, 2016. DOI:10.1177/1744806916652628 |
| [21] | Palagano E, Slatter MA, Uva P, et al. Hematopoietic stem cell transplantation corrects osteopetrosis in a child carrying a novel homozygous mutation in the FERMT3 gene[J]. Bone, 2017, 97: 126–129. DOI:10.1016/j.bone.2017.01.012 |
| [22] | Teti A, Econs MJ. Osteopetroses, emphasizing potential approaches to treatment[J]. Bone, 2017. DOI:10.1177/1744806916652628 |
| [23] | Alam I, Gray A K, Acton D, et al. Interferon gamma, but not calcitriol improves the osteopetrotic phenotypes in ADO2 mice[J]. J Bone Miner Res, 2015, 30: 2005–2013. DOI:10.1002/jbmr.2545 |
| (收稿日期:2017-04-11) |

