2. 310014 杭州,浙江省人民医院骨质疏松诊治中心;
3. 310014 杭州,浙江省人民医院骨科;
4. 98109 美国西雅图,弗雷德·哈奇逊癌症研究中心 公共卫生科学部;
5. 100730 北京,中国医学科学院 北京协和医学院 北京协和医院放射科
2. Center of Osteoporosis, Zhejiang Provincial People's Hospital, Hangzhou 310014, China;
3. Department of Orthopedics, Zhejiang Provincial People's Hospital, Hangzhou 310014, China;
4. Department of Science of Public Health, Fred Hutchinson Cancer Research Center, Seattle 98109, USA;
5. Department of Radiology, Peking Union Medical College Hospital, Chinese Academy of Medical Science & Peking Union Medical College, Beijing 100730, China
骨质疏松症(osteoporosis,OP)是日益严重的公共健康问题,当前全球已经有超过2亿患者[1]。目前双能X线吸收检测法(dual-energy X-ray absorptiometry, DXA)检测骨密度(bone mineral density, BMD)是临床诊断OP公认的标准[2],也是世界卫生组织(World Health Organization, WHO)唯一推荐使用作为全球诊断OP的统一指标[3]。DXA测量BMD的常规部位包括腰椎、股骨近端,前臂BMD的测量结果也可用于OP的诊断和随访过程中的治疗效果评估[4],也有研究表明前臂BMD测量结果预测前臂骨折的风险优于其他部位BMD测量结果的评估[5-6]。因此,国内外研究者在广泛应用DXA检测腰椎和股骨近端BMD的同时,也不断开展对DXA前臂BMD检测的研究。有研究采用其他方法进行前臂的骨密度测量,数字X射线骨密度检测系统测量前臂桡骨BMD方法便是其中之一。新的BMD测量方法在临床应用前,除技术本身固有的参数评估外,其与临床BMD测量结果的有关参数,如测量精确性、准确性及与已有公认的DXA测量结果的比较如何等方面的评估也至关重要[7-11]。这主要是因为人体BMD年平均变化较小,平均约为1%[12],如没有良好的精确性,是难以检测出这种微小的变化的。本研究对此新型前臂桡骨BMD测量仪就上述测量方面的有关参数进行分析,现报道如下。
对象与方法研究对象
34例志愿者在2017年7月1日至31日于浙江省人民医院应用数字X射线骨密度检测系统及DXA测量前臂的BMD。所有志愿者采集基本资料(年龄、性别、学历等)及骨质疏松相关危险因素(月经情况、骨折病史、吸烟、饮酒等)。测量其身高(cm)、体质量(kg),并计算体质量指数(body mass index,BMI)值等(表 1)。每位受试者均否认前臂骨折外伤史、肿瘤及退行性手腕关节炎等病史。所有受试者在测量前均知情并填写了基本情况问卷。
| 性别 | 例数(n) | 年龄(岁) | 体质量(kg) | 身高(cm) | BMI(kg/m2) |
| 男性 | 18 | 56.2±15.1 | 69.9±9.8 | 167.2±6.0 | 24.9±2.8 |
| 女性 | 16 | 53.6±11.4 | 59.7±8.8 | 155.3±6.1 | 24.8±4.1 |
| 总计 | 34 | 55.0±13.3 | 65.1±10.5 | 161.6±8.5 | 24.9±3.4 |
| BMI:体质量指数 | |||||
前臂桡骨BMD测量方法
所有受试者测量的前臂均选择非优势侧前臂。操作者为长期从事DXA进行BMD检测和经过数字X射线骨密度检测系统培训的临床技师。
DXA测量仪为美国GE Lunar Prodigy(GE Healthcare,Madison,WI)扫描仪,分析软件为13.31版本。具体测量方法为:扫描时受试者静坐于扫描床旁,并将前臂置于扫描床固定装置上,其前臂长轴与前臂固定装置和扫描床长轴平行,扫描起始点定于前臂远端腕部中央,扫描过程中嘱受试者保持静止状态,扫描影像范围从中腕关节至前臂近端,扫描结束时机器自动停止。前臂测量的感兴趣区为桡骨远端1/3处,感兴趣区定位的参照点选取前臂尺桡骨远端交界处[13],测量部位及其感兴趣区定位参照点见图 1A。
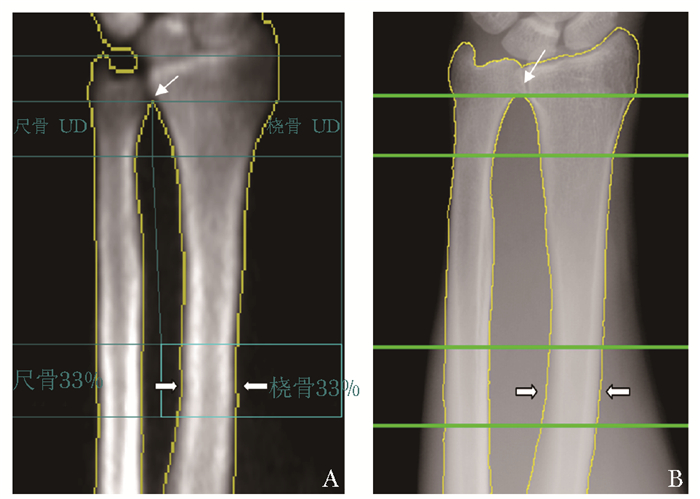
|
|
图 1 测量影像和感兴趣区及其定位参照点
Figure 1 Forearm images and locations of region of interest as well as their reference points
A:DXA;B:数字X射线骨密度检测系统; DXA:双能X线吸收检测法 |
数字X射线前臂骨密度检测系统测量:X线设备为浙江康源医疗器械有限公司的DR6000C数字X-射线机,前臂投照条件:55 kVp,100 mAs,SID=1.0 m,无附加滤波片,平板探测器。所有受试者测量体位及测量感兴趣区均与DXA测量相同(测量部位及感兴趣区定位见图 1B)。该BMD测量仪主要是采用计算机辅助自动分析与X射线放射吸收原理(radiographic absorptiometry, RA)相结合的测量方法,以标准的数字X射线影像设备(digital radiographic, DR)作为图像采集平台,进而采集被诊断骨骼部位的投影医学数字成像和通信(digital imaging and communications in medicine, DICOM)格式图像,然后通过影像归档和通信系统(picture archiving and communication systems, PACS)把数字图像传输到BMD工作站,依据宽频多能X射线对骨骼与软组织的吸收特性与图像灰度值之间所存在的非线性变化关系,通过已知体模运算计算出感兴趣区域的骨骼的BMD[14]。其基本原理,即智能RA(intelligent RA)测量法,是将普通DR采集到的非优势侧前臂骨(桡骨及尺骨)投影的图像,进行降噪预处理,并采用GVF Snake自动分割算法将预处理后的前臂骨骼图像进行分割处理,有效地分割出感兴趣区的骨骼和其周围的软组织区域,之后算出对应的参考模块区域的等效BMD值作为被检测骨骼部位的BMD值[14]。
每例受试者的DXA和数字X射线骨密度检测系统的前臂桡骨测量均为2次,重复测量除重新摆位后外,所有测量参数均及感兴趣区定位与第一次测量参数相同,并均由同一DXA操作技师和放射科技师在同一日内完成。
统计学方法
采用SPSS 15.0统计分析软件,计量资料以均值±标准差(x±s)表示。对于每个患者的两次数字X射线前臂桡骨骨密度检测系统及DXA检测所获得的结果,计算其各自的SD及变异系数(coefficient of variation,CV)。再通过计算均方误差(root mean square SD,RMS-SD)和均方变异系数(root mean square CV,RMS-CV)(RMS-CV=RMS-SD/mean BMD)反映所有受试者在采取两种不同检测方法时的整体的SD及CV。并通过配对t检验,比较两种不同方法获得的BMD的值间差异,以P<0.05为差异有统计学意义。
结果本研究共计纳入研究对象34名,年龄31~81岁,平均年龄(55.0±13.3)岁;其中,男性18名,年龄31~81岁,平均年龄(56.2±15.1)岁;女性16名,年龄38~74岁,平均年龄(53.6±11.4)岁。采用DXA检测获得的平均BMD为(0.924±0.124)g/cm2,RMS-SD及RMS-CV分别为0.019 g/cm2及2.1%。采用数字X射线前臂桡骨骨密度检测系统检测获得的平均BMD为(0.928±0.160) g/cm2,RMS-SD及RMS-CV分别为0.015 g/cm2及1.7%。且该受试人群采用两种方法检测获得的BMD经过配对t检验比较,差异无统计学意义(P>0.05)。采用数字X射线前臂桡骨骨密度检测系统检测获得RMS-SD及RMS-CV均小于DXA检测获得的数据,但两者相比,差异无统计学意义(P>0.05)。
讨论BMD测量精确性和准确性是评估BMD测量质控内容的重要组成部分。良好的测量精确性有助于缩短临床药物疗效观察的时间,BMD测量的精确性高,则最小有意义变化(least significant changes,LSC)就相应的小,依据最小有意义值可进一步分析随访过程中BMD测量结果的不同是生物本身的变化,还是由于测量误差所致;另外,测量的精确性可为确定临床药物治疗效果判定所需的观察例数提供客观的依据,进而有助于节省临床药物治疗效果判定所需的人力和经费。因此,任何DXA仪在进行临床或科研工作的初始期均需其测量的精确性评估[15]。以往也有研究对当时美国GE-Lunar公司生产DXA iDXA机型在我国临床应用前对上述有关测量参数进行了评估[13],同样,本研究在临床应用前对我国新研发的数字X射线前臂桡骨骨密度检测系统的有关测量参数进行评估。本研究评估结果显示,数字X射线骨密度检测系统对前臂桡骨BMD测量的精确性评估结果同以往国内外不同型号DXA前臂桡骨骨密度测量精确性的评估结果相似[16-17]。另外,本研究结果显示,数字X射线前臂骨密度检测系统桡骨BMD检测的RMS-SD和RMS-CV(0.015 g/cm2和1.7%)均小于DXA测量的RMS-SD和RMS-CV(0.019 g/cm2和2.1%)。两者比较差异无统计学意义,虽不足以证明数字X射线骨密度检测系统的精确度优于DXA的精确度,但足以表明数字X射线骨密度检测系统具有良好精确度,可与DXA前臂BMD测量一样进行临床前臂的BMD测量及其结果的评估。
现已公认DXA的前臂BMD测量结果可用于OP的诊断、骨折风险性评估及治疗效果的随访观察[4-6],为进一步评估数字X射线骨密度检测系统前臂BMD测量结果的可行性,本研究以公认的DXA的前臂桡骨BMD测量结果作为参照,分别对34例受试者前臂进行了两种BMD测量方法的比较。结果显示,数字X射线骨密度检测系统测量BMD平均值(0.928±0.160)g/cm2与DXA测量的平均值(0.924±0.124)g/cm2相似,差异无统计学意义(P>0.05)。这两种测量方法测量对临床前臂BMD评估的作用是相似的,另外,上述相似的测量结果也可间接地表明数字X射线骨密度检测系统用于前臂桡骨BMD测量具有与DXA测量类似的准确性。
本研究具有一定的局限性:首先是同DXA前臂桡骨BMD测量感兴趣区比较,数字X射线骨密度检测系统对前臂桡骨BMD测量的感兴趣区仅为桡骨远端1/3处,现有的测量分析软件版本还不能分析桡骨超远端(ultra-distal,UD)BMD,尽管桡骨超远端BMD还不能用于OP的诊断,仅处于研究阶段,但因该部位松质骨丰富,对代谢反应敏感,故笔者建议有必要在今后的升级版本中添加桡骨超远端感兴趣区的测量,并再作相应的进一步评估。其次,本研究样本量有限,虽本研究的样本量足以评估两种测量方法的精确度,但对分析比较两种测量骨密度均值的差异性其样本量相对较小,相应的人群覆盖面也有限,这有待于今后扩大样本进一步研究分析。
综上所述,本研究对数字X射线骨密度检测系统测量前臂桡骨BMD的精确性评估、间接的准确性分析及与已有公认的DXA测量的骨密度均值的比较结果均表明其临床应用是可行的,不失为评估前臂桡骨BMD状况时的一种新选择。这种新型国产前臂骨密度仪在测量方法可靠的基础上,可从价格、维护、技术指导等方面的优势不断扩大其临床应用范围。
| [1] | Reginster JY, Burlet N. Osteoporosis: a still increasing prevalence[J]. Bone, 2006, 38: S4–9. |
| [2] | Baim S, Wilson C, Lewiecki EM, et al. Precision assessment and radiation safety for dual-energy X-ray absorptiometry: position paper of the International Society for Clinical Densitometry[J]. J Clin Densitom, 2006, 8: 371–378. |
| [3] | World Health Organization. Assessment of fracture risk and its application to screening for postmenopausal osteoporosis[R]. Geneva: WHO, 1994. |
| [4] | Baim S, Binkley N, Bilezikian JP, et al. Official Positions of the International Society for Clinical Densitometry and executive summary of the 2007 ISCD Position Development Conference[J]. J Clin Densitom, 2001, 4: 105–110. DOI:10.1385/JCD:4:2:105 |
| [5] | Miller PD, Siris ES, Barrett-Connor E, et al. Predic-tion of fracture risk in postmenopausal white women with peripheral bone densitometry: evidence from the National Osteoporosis Risk Assessment[J]. J Bone Miner Res, 2002, 17: 2222–2230. DOI:10.1359/jbmr.2002.17.12.2222 |
| [6] | Greenspan S, Maitland-Ramsey L, Myers E. Classification of osteoporosis in the elderly is dependent on site-specific analysis[J]. Calcif Tissue Int, 1996, 58: 409–414. DOI:10.1007/BF02509439 |
| [7] | Weinstein M, Fineberg H.Clinical decision analysis[M]. Philadelphia: W.B. Saunders Company, 1980: 131-167. |
| [8] | Bonnick SL, Johnston CC Jr, Kleerekoper M, et al. Importance of precision in bone density measurements[J]. J Clin Densitom, 2001, 4: 105–110. DOI:10.1385/JCD:4:2:105 |
| [9] | Faulkner KG, McClung MR. Quality control of DXA instruments in multicenter trials[J]. Osteoporos Int, 1995, 5: 218–227. DOI:10.1007/BF01774010 |
| [10] | Glüer CC, Faulkner KG, Estilo MJ, et al. Quality assurance for bone densitometry research studies: concept and impact[J]. Osteoporos Int, 1993, 3: 227–235. DOI:10.1007/BF01623825 |
| [11] | Miller CG. Bone density measurements in clinical trials: the challenge of ensuring optimal data[J]. Br J Clin Res, 1993, 4: 113–220. |
| [12] | Forsén L, Berntsen GK, Meyer HE, et al. Differences in precision in bone mineral density measured by SXA and DXA: the NOREPOS study[J]. Eur J Epidemiol, 2008, 23: 615–624. DOI:10.1007/s10654-008-9271-1 |
| [13] | Augat P, Fuerst T, Genant HK. Quantitative bone mineral assessment at the forearm: a review[J]. Osteoporos Int, 1998, 8: 299–310. DOI:10.1007/s001980050068 |
| [14] | 陈建锋, 范运洲, 李鹏, 等. 智能放射吸收法的临床应用—人体手臂骨骨密度的测量及其骨质疏松的评估[J]. 中国医疗设备, 2018, 33: 31–35. |
| [15] | 余卫, 林强, 于晓波, 等. 双能X线骨密度仪iDXA机型测量的精确性评估[J]. 中华放射学杂志, 2009, 12: 1291–1294. DOI:10.3760/cma.j.issn.1005-1201.2009.12.014 |
| [16] | Pearson D, Horton B, Green DJ. Cross calibration of Hologic QDR2000 and GE Lunar Prodigy for forearm bone mineral density measurements[J]. J Clin Densitom, 2007, 10: 306–311. DOI:10.1016/j.jocd.2007.05.003 |
| [17] | Chang YJ, Yu W, Lin Q, et al. Forearm bone mineral density measurement with different scanning positions: a study in right-handed Chinese using dual-energy X-ray absorptiometry[J]. J Clin Densitom, 2012, 15: 67–71. DOI:10.1016/j.jocd.2011.08.005 |
| (收稿日期:2018-02-28) |

