2. 410016 长沙,湖南省人民医院马王堆院区内分泌科;
3. 410011 长沙,中南大学湘雅二医院口腔医学中心
2. Department of Endocrinology, the People' s Hospital of Hunan Province, Changsha 410016, China;
3. Center of Stomatology, The Second Xiangya Hospital of Central South University, Changsha 410011, China
机械力学刺激是维持骨细胞活性的重要调节因子,能够调节成骨细胞的增生、分化及凋亡,促进骨形成[1-4]。在没有力刺激或负重降低的情况下如长期卧床、航天飞行(失重状态)等均可引起骨密度(bone mineral density,BMD)及骨超微结构改变,从而导致骨丢失及骨质疏松的发生[5-6]。在骨组织中,骨细胞及成骨细胞是能够感受外来机械力学刺激,并对此做出应答反应的主要成员。既然力学刺激能够促进成骨细胞的增生分化,那么成骨细胞是如何把力学刺激信号转换为生物化学信号而发生应答效应的呢?虽然研究较多,但具体机制仍不清楚。本研究采用四点弯曲原理设计的细胞加力装置,观察周期性的力学刺激对MG-63成骨样细胞护骨素(osteoprotegrin,OPG)的表达及MAPK信号通路的影响,以及探讨MAPK信号通路在OPG表达中的作用。
材料与方法 材料与试剂DMEM培养液、Trizol、胎牛血清(fetal bovine serum,FBS)购自美国Gibco公司;反转录试剂盒(Revert Aid TM First-Strand cDNA Synthesis kit)购于美国Fermentas公司;人成骨肉瘤MG-63细胞株购自美国培养物保存中心(ATCC号:CRL1427);抗CTGF、ERK1/2、p-ERK(1/2)、p38MAKP、p-p38 MAPK、JNK、p-JNK及抗羊、抗小鼠、抗兔HRP标记的二抗均购自Santa Cruz公司。抗小鼠β-actin抗体购自美国Sigma公司。ERK1/2信号通路的阻断剂PD98059、p38MAPK信号通路的阻断剂SB203580、JNK信号通路的阻断剂SP600125及PI3K信号通路阻断剂LY294002购自Calbiochem公司。
方法细胞培养:人成骨肉瘤MG-63细胞培养用DMEM培养液(内含10% FBS、50 μg/mL抗坏血酸、100 U/mL青霉素、100 μg/mL庆大霉素)培养,每3天换液1次,细胞达汇片后用0.25%胰酶-EDTA消化,按104/cm2密度接种至细胞加力板上。培养48~72h后,进行力学刺激。
干预实验:干预前换无血清含1% BSA的DMEM培养基饥饿24 h,并于干预前1 h加入信号通路阻断剂(50 μmol/L PD98059、30 μmol/L SP600125),然后进行力学刺激3 h,对照组加入DMSO。采用根据四点弯曲原理设计的细胞加力装置对成骨细胞进行力学刺激,该装置已获2项国家专利(专利号01129166.4及ZL01256849.X)。该装置工作时,细胞加力板发生弯曲变形,因而附着在表面的细胞受力而发生形变。根据受力情况分为对照组及加力组(2 000 μstrain,0.2 Hz)。
RT-PCR法检测:各组弃去培养液,用Trizol按操作说明方法提取细胞总RNA,反转录成cDNA产物,保存于-4 ℃。引物通过PCR Designer软件设计,OPG引物序列:上游引物5′-AACCCCAGAGCGAAATAC-3′;下游引物:5′-AAGAATGCCTCCTCACAC-3′,退火温度是57 ℃,产物片段为219 bp,反应30个循环。ACTIN引物序列:上游引物5′-CGGGAAATCGTGCGTGAC-3′;下游引物:5′-CAGGCAGCTCGTAGCTCTT-3′,退火温度是57 ℃,产物片段为115 bp,反应25个循环产物。扩增产物用1.5%的琼脂糖凝胶电泳。电泳产物经紫外透射反射分析仪分析,比较各组条带的平均密度值,并以ACTIN的平均密度值校正,以两者比值表示mRNA相对表达量。
Western blot法检测:检测OPG、p-ERK1/2、p-p38MAPK、p-JNK蛋白表达水平。按照蛋白抽提试剂盒操作要求抽提总细胞蛋白,测蛋白浓度,取50 μg细胞总蛋白在SDS-PAGE胶中进行电泳。电泳后进行转膜,将胶上蛋白转移到PVDF膜上。5%脱脂奶粉封闭1 h,PBS冲洗3遍。一抗4 ℃孵育过夜,PBS冲洗3遍,辣根过氧化物酶标记的二抗室温孵育1 h,PBS冲洗3遍,最后显影洗片。用Image Master VDS成像分析系统行吸光度检测。
统计学方法采用SPSS17.0统计软件处理实验数据,所有结果均以均数±标准差(x±s)表示,组间比较用单因素方差分析,以P<0.05为差异有统计学意义。
结果 机械力学刺激对MG-63成骨样细胞OPG蛋白及mRNA表达的影响Western blot法及RT-PCR检测结果显示,机械力学刺激明显促进了MG-63成骨样细胞OPG蛋白及mRNA的表达,并且呈时间依赖性增加,加力1、3、6及12 h后OPG蛋白表达均明显增加,与对照组(无力学刺激组)相比,差异有统计学意义(P<0.05)。加力3、6、12 h后OPG mRNA的表达明显增加,与对照组相比,差异有统计学意义(P<0.05)(图 1)。
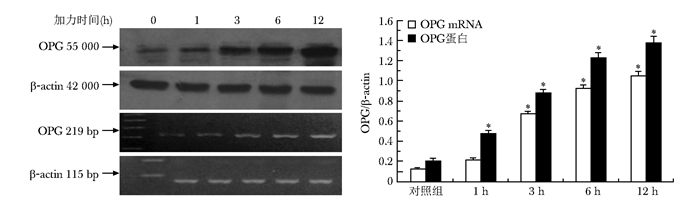
|
| 图 1 机械力学刺激对MG-63成骨样细胞OPG蛋白及mRNA表达的影响 Figure 1 Effects of mechanical stimulation on the expression of OPG protein and mRNA in MG63 cells detected by Western blot OPG:护骨素;与对照组比较,*P<0.05 |
力学刺激可以激活ERK1/2信号通路,10 min开始活化,15 min时又下降到基础水平,继而在30及60 min持续活化,至60 min达到顶峰。力学刺激也可以激活JNK通路,10 min开始活化,15~30 min达高峰,但到60 min降到基础水平。力学刺激不能激活p38MAPK信号通路(图 2~4)。
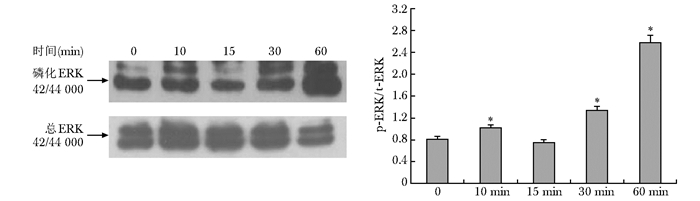
|
| 图 2 机械力学刺激对ERK1/2信号通路的影响 Figure 2 Effects of mechanical stimulation on ERK1/2 phosphorylation detected by Western blot 与对照组比较,*P<0.05 |
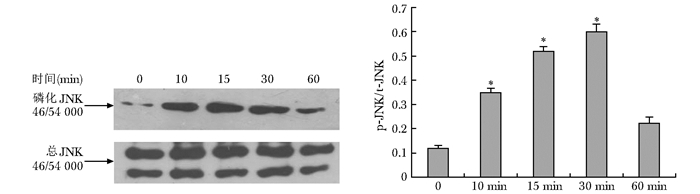
|
| 图 3 机械力学刺激对JNK信号通路的影响 Figure 3 Effects of mechanical stimulation on JNK phosphorylation detected by Western blot 与对照组比较,*P<0.05 |

|
| 图 4 机械力学刺激对p38 MAPK信号通路的影响 Figure 4 Effects of mechanical stimulation on p38 phosphorylation detected by Western blot MAPK:丝裂原活化蛋白激酶 |
应用ERK1/2、JNK信号通路阻断剂后,观察力学刺激对OPG蛋白表达的作用, 发现ERK1/2信号通路阻断剂PD98059阻断了力学刺激对OPG蛋白表达的上调作用。但是JNK信号通路阻断剂SP600125不能阻断这一作用(图 5, 6)。
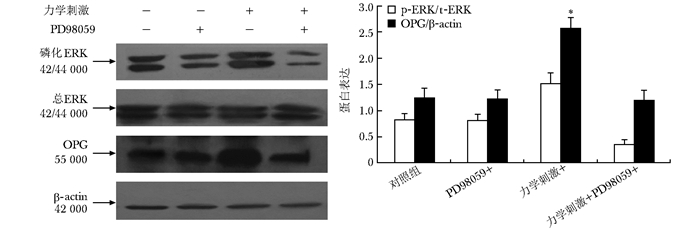
|
| 图 5 ERK1/2通路阻断剂PD98059对力学刺激引起的OPG蛋白表达的影响 Figure 5 Effects of inhibitor of ERK1/2 signal pathway on the expression of OPG protein detected by Western blot OPG:护骨素;与对照组比较,*P<0.05 |
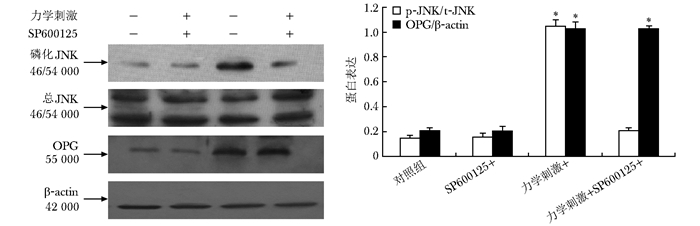
|
| 图 6 JNK通路阻断剂SP600125对力学刺激引起的OPG蛋白表达的影响 Figure 6 Effects of inhibitor of JNK signal pathway on the expression of OPG protein detected by Western blot JNK:C-Jun N末端激酶;OPG:护骨素;与对照组比较,*P<0.05 |
骨代谢包括骨形成与骨吸收,两者要维持动态平衡,一旦平衡被打破,破骨细胞功能亢进,骨吸收超过骨形成,就会导致OP的发生。力学刺激是维持BMD和骨超微结构的重要作用因子,能够使骨骼维持最佳的力学特性,在骨重建以及骨折修复等过程中发挥着重要作用[7-8]。机械力学刺激的大小、频率以及作用方式的不同,对成骨细胞及破骨细胞功能的影响也是不同的。一般认为,在生理强度范围力学刺激可以促进成骨细胞增生分化,增加骨量;相反,超生理强度范围内力学刺激,则会降低骨量。本研究采用了研究学者广泛应用的四点弯曲细胞力学刺激装置,并且早期研究发现,机械应变值为2 000 μstrain,频率为0.2 Hz是较适宜的力刺激强度,能够明显促进成骨细胞的增生[9]。因而本研究将力的频率设定为0.2 Hz,机械应变值设定为2 000 μstrain。近年来许多研究探讨了机械力学刺激在OP中的作用,但作用机制仍不明确。本研究观察了力学刺激对成骨样细胞OPG表达及MAPK信号传导通路的影响。
OPG是一种可溶性分泌蛋白,成骨细胞及骨髓基质细胞均可表达分泌。研究表明,OPG主要生理功能是与细胞核因子-κB受体活化因子(nuclear factor-kappa B receptor activating factor,RANK)竞争性结合细胞核因子-κB受体活化因子配体(nuclear factor-kappa B receptor activating factor ligand,RANKL),防止RANKL与RANK结合过多造成的破骨细胞过度活化,以及抑制前体破骨细胞分化、活化及诱导成熟的破骨细胞的凋亡[10-12]。破骨细胞虽受多种激素和细胞因子调节,而最终效应因子是OPG系统[13]。在很大程度上,骨形成与骨吸收的动态平衡靠可溶性OPG表达调节[14]。Simonet等[15]发现OPG能明显抑制破骨细胞的形成,并引起BMD升高。本研究发现,与对照组相比,加力组OPG蛋白及mRNA的表达均明显升高,并呈时间依赖性增加,这与许多研究结果一致[12-14]。
丝裂原活化蛋白激酶(mitogen-activated pro-tein kinase,MAPK)信号通路是细胞内最重要的信号通路之一,能将多种细胞外刺激产生的信号从细胞膜传递到细胞核内,参与介导细胞增生、分化等多种病理生理过程。MAPK信号系统主要包括细胞外信号调节激酶1/2(ERK1/2)、c-Jun N末端激酶(c-Jun-NH2-terminal kinase,JNK)以及p38MAPK,且其磷酸化水平的高低反映了它们的活化程度。近来研究发现,MAPK信号通路在力学刺激诱导的成骨细胞增生分化中发挥重要作用[16-18]。尤其是ERK1/2信号通路被发现在成骨细胞的多种生理功能过程中起作用[19-21]。Schmid等[22]发现周期性的机械牵张力能够引起成纤维细胞胶原蛋白基因转录及合成,ERK1/2信号通路早期即被活化并当牵张力增加时再次被激活。那么MAPK信号通路是否也参与了力学刺激引起的成骨细胞OPG的表达,目前国内外研究尚不多见。
本研究发现,力学刺激激活了ERK1/2及JNK信号通路,但对p38信号通路没有影响。ERK1/2活化持续时间较长,从10 min开始活化,于15 min时降至基础水平,30~60 min持续活化,并在60 min时到达高峰。而JNK活化时间短暂,15~30 min达高峰,60 min时基本降到基础水平。笔者推测这可能与ERK、JNK信号通路的特点有关。有研究表明,ERK1/2可以通过反馈调控增加(正反馈)或者减弱(负反馈)ERK活性,从而实现对ERK信号强度和持续时间的控制[23]。因而推测ERK1/2 10 min开始活化后15 min降至基础水平,可能与暂时的负反馈调节有关系,但具体机制不明。同时也有研究表明,JNK的适度、暂时活化,引起细胞增生,而剧烈、持续活化则引起细胞死亡[24-26],推测JNK的活化持续时间,可能与细胞外刺激的形式、强度、持续时间等有关系,适宜的细胞外刺激可能引起JNK的短暂活化。本研究发现ERK1/2或JNK可能参与了力学刺激诱导的成骨细胞OPG蛋白的表达,因而用ERK1/2信号通路特异性阻断剂PD98059阻断ERK1/2的活化,结果发现,PD98059阻断了力学刺激引起的ERK1/2的活化,并抑制了力学刺激诱导的OPG的蛋白表达;而本研究用JNK信号通路特异性阻断剂SP600125时发现,SP600125阻断了力学刺激引起的JNK的活化,但对力学刺激诱导的OPG的蛋白表达没有影响。本研究结果表明,机械力学刺激可能通过激活ERK1/2信号通路,引起了MG-63成骨样细胞OPG的表达,而JNK及p38MAPK信号通路没有参与这一过程。因而推测力学刺激可能通过激活ERK1/2信号通路上调了OPG的表达,竞争性地阻断了部分RANKL与RANK的结合,抑制了破骨细胞活化,抑制了骨吸收,从而发挥抗OP的作用。
| [1] | Yoo YM, Kwag JH, Kim KH, et al. Effects of neuropeptides and mechanical loading on bone cell resorption in vitro[J]. Int J Mol Sci, 2014, 15: 5874–5883. DOI:10.3390/ijms15045874 |
| [2] | Matsui H, Fukuno N, Kanda Y, et al. The expres-sion of Fn14 via mechanical stress-activated JNK contributes to apoptosis induction in osteoblasts[J]. J Biol Chem, 2014, 289: 6438–6450. DOI:10.1074/jbc.M113.536300 |
| [3] | Kaneuji T, Ariyoshi W, Okinaga T, et al. Mechanisms involved in regulation of osteo-clastic differentiation by mechanical stress-loaded osteoblasts[J]. Biochem Biophys Res Commun, 2011, 408: 103–109. DOI:10.1016/j.bbrc.2011.03.128 |
| [4] | Schulte FA, Ruffoni D, Lambers FM, et al. Local mechanical stimuli regulate bone formation and resorption in mice at the tissue level[J]. PLoS One, 2013, 8: e62172. DOI:10.1371/journal.pone.0062172 |
| [5] | Lloyd SA, Bandstra ER, Willey JS, et al. Effect of proton irradiation followed by hindlimb unloading on bone in mature mice: a model of long-duration spaceflight[J]. Bone, 2012, 51: 756–764. DOI:10.1016/j.bone.2012.07.001 |
| [6] | Blaber EA, Dvorochkin N, Lee C, et al. Microgravity induces pelvic bone loss through osteoclastic activity, osteocytic osteolysis, and osteoblastic cell cycle inhibition by CDKN1a/p21[J]. PLoS One, 2013, 8: e61372. DOI:10.1371/journal.pone.0061372 |
| [7] | Ruff C, Holt B, Trinkaus E. Who's afraid of the big bad Wolff?: 'Wolff's law' and bone functional adaptation[J]. Am J Phys Anthropol, 2006, 129: 484–498. DOI:10.1002/(ISSN)1096-8644 |
| [8] | Jing D, Baik AD, Lu XL, et al. In situ intracellular calcium oscillations in osteocytes in intact mouse long bones under dynamic mechanical loading[J]. FASEB J, 2014, 28: 1582–1592. DOI:10.1096/fj.13-237578 |
| [9] | 杨敏, 黄凌云, 肖立伟, 等. 力学刺激对MG-63成骨样细胞增生分化的影响[J]. 生物医学工程学杂志, 2012, 29: 894–897. |
| [10] | Boyce BF, Xing L. Biology of RANK, RANKL, and osteoprotegerin[J]. Arthritis Res Ther, 2007, 1: S1. |
| [11] | Hong JS, Santolaya-Forgas J, Romero R, et al. Maternal plasma osteoprotegerin concentration in normal pregnancy[J]. Am J Obstet Gynecol, 2005, 193: 1011–1015. DOI:10.1016/j.ajog.2005.06.051 |
| [12] | Silva I, Branco J. Rank/Rankl/opg: literature review[J]. Acta Reumatol Port, 2011, 36: 209–218. |
| [13] | 赵振英, 刘英杰, 冯文岭. 护骨素和骨质疏松的关系及其研究进展[J]. 华北煤炭医学院学报, 2008, 10: 772–774. DOI:10.3969/j.issn.1008-6633.2008.06.021 |
| [14] | Lacey DL, Timms E, Tan HL, et al. Osteoprotegerin ligand is a cytokine that regulates osteoclast differentiation and activation[J]. Cell, 1998, 93: 165–176. DOI:10.1016/S0092-8674(00)81569-X |
| [15] | Simonet WS, Lacey DL, Dunstan CR, et al. Osteoprotegerin: a novel secreted protein involved in the regulation of bone density[J]. Cell, 1997, 89: 309–319. DOI:10.1016/S0092-8674(00)80209-3 |
| [16] | Galea GL, Meakin LB, Harris MA, et al. Old age and the associated impairment of bones' adaptation to loading are associated with transcriptomic changes in cellular metabolism, cell-matrix interactions and the cell cycle[J]. Gene, 2017, 599: 36–52. DOI:10.1016/j.gene.2016.11.006 |
| [17] | Bin G, Cuifang W, Bo Z, et al. Fluid shear stress inhibits TNF-α-induced osteoblast apoptosis via ERK5 signaling pathway[J]. Biochem Biophys Res Commun, 2015, 466: 117–123. DOI:10.1016/j.bbrc.2015.08.117 |
| [18] | Li M, Wu W, Tan L, et al. Low-magnitude mechanical vibration regulates expression of osteogenic proteins in ovariectomized rats[J]. Biochem Biophys Res Commun, 2015, 465: 344–348. DOI:10.1016/j.bbrc.2015.07.154 |
| [19] | Zhang P, Dai Q, Ouyang N, et al. Mechanical Strain Promotes Osteogenesis of BMSCs from Ovariectomized Rats via the ERK1/2 but not p38 or JNK-MAPK Signaling Pathways[J]. Curr Mol Med, 2015, 15: 780–789. DOI:10.2174/1566524015666150824143830 |
| [20] | Kusuyama J, Bandow K, Shamoto M, et al. Low intensity pulsed ultrasound (LIPUS) influences the multilineage differentiation of mesenchymal stem and progenitor cell lines through ROCK-Cot/Tpl2-MEK-ERK signaling pathway[J]. J Biol Chem, 2014, 289: 10330–10344. DOI:10.1074/jbc.M113.546382 |
| [21] | Matsumoto T. Osteoporosis and Mechano-biosciences[J]. Clin Calcium, 2016, 26: 1717–1727. |
| [22] | Schmid JB, Chen K, Tranquillo RT. Effects of intermittent and incremental cyclic stretch on ERK signaling and collagen production in engineered tissue[J]. Cell Mol Bioeng, 2016, 9: 55–64. DOI:10.1007/s12195-015-0415-6 |
| [23] | 赵明哲, 刘靖华, 李玉花, 等. ERK信号通路的信号转导调控机制[J]. 临床与病理杂志, 2009, 29: 15–19. DOI:10.3969/j.issn.1673-2588.2009.01.004 |
| [24] | 李凯, 曹让娟, 朱志华. JNK信号通路的研究进展[J]. 中国实验诊断学, 2015, 19: 1596–1598. |
| [25] | Cavigelli M, Li WW, Lin A, et al. The tumor promoter arsenite stimulates AP-1 activity by inhibiting a JNK phosphatase[J]. EMBO J, 1996, 15: 6269–6279. DOI:10.1002/embj.1996.15.issue-22 |
| [26] | Kamata H, Honda S, Maeda S, et al. Reactive oxygen species promote TNF alpha-induced death and sustained JNK activation by inhibiting MAP kinase phosphatases[J]. Cell, 2005, 120: 649–661. DOI:10.1016/j.cell.2004.12.041 |
| (收稿日期:2018-06-04) |

