2. 410011 长沙,中南大学湘雅二医院代谢内分泌研究所;
3. 410011 长沙,国家代谢性疾病临床医学研究中心;
4. 08901 New Jersey,Division of Endocrinology,Metabolism & Nutrition,Rutgers University-Robert Wood Johnson Medical School,USA
2. National Clinical Research Center for Metabolic Diseases, the Second Xiangya Hospital, Central South University, Changsha 410011, China;
3. Institution of Metabolism and Endocrinology, Central South University, the second Xiangya Hospital, Central South University, Changsha, 410011, China;
4. Division of Endocrinology, Metabolism & Nutrition, Rutgers University-Robert Wood Johnson Medical School, New Jersey 08901, USA
维生素D(vitamin D,VD)主要包括维生素D2(vitamin D2,VD2)和维生素D3(vitamin D3,VD3)。人体内的维生素D大部分来源于表皮中的7-双氢胆固醇,后者在紫外线曝露下,通过非酶促反应合成D3前体,再经温促反应形成维生素D3。还有小部分维生素D2和维生素D3可通过饮食摄取。体内的维生素D需与维生素D结合蛋白(vitamin D binding protein,DBP)结合,转运至肝脏,经25-羟化酶的作用,转化为25羟维生素D (25 hydroxyvitamin D,25OHD)。25OHD在1-α-羟化酶作用下形成1,25-双羟维生素D[1,25-dihydroxy vitamin D,1,25(OH)2D],成为体内的活性维生素D[1]。25OHD作为活性维生素D的前体形式,是目前公认的反映维生素D营养状态的最佳指标。近年来的研究发现,临床上多种疾病状态如晚期肝病、肾病综合征以及某些危重症等常常伴随体内维生素D营养状态的下降。尽管其具体的机制仍不甚清楚,但DBP水平的变化,造成25OHD结合状态的改变,而引起生物活性25OHD的波动,可能在调节疾病状态下维生素D的功能发挥了重要作用。
DBP和游离25OHDDBP是一种主要由肝脏合成的多态单链血清糖蛋白,用于结合血浆中的25OHD。循环中约85%~90%的25OHD和1,25(OH)2D与DBP紧密结合。另有小部分(约10%~15%)与白蛋白结合,仅有不到1%的维生素D代谢物以非结合的游离形式存在(图 1)。与DBP的结合可保护维生素D免于生物降解、限制过量的维生素D进入靶细胞、以及协助肾脏对维生素D的重吸收等[2]。在经典的游离激素学说假设中,非紧密结合形式的激素才是具有生物学活性的激素[3]。
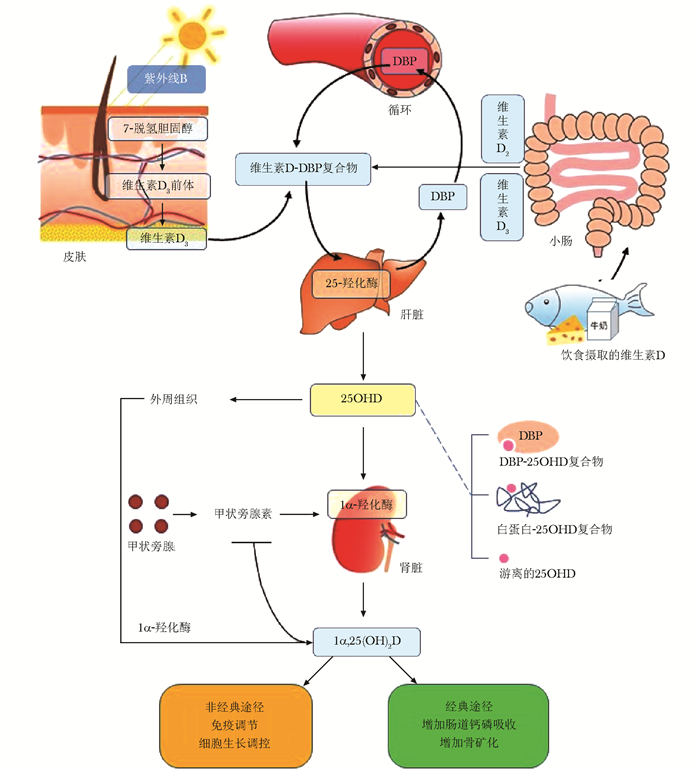
|
| 图 1 维生素D代谢示意图 Figure 1 Vitamin D metabolism DBP:维生素D结合蛋白;25OHD=DBP-25OHD复合物+白蛋白-25OHD复合物+游离的25OHD |
血浆总25OHD的测定方法包括放射免疫分析法(radioimmunoassay,RIA)、化学发光法、高效液相色谱法和液相色谱-质谱法(liquid chromatography-mass spectrometry,LC-MS)。前两种方法由于不仅测量了总25OHD,还测量了其他维生素D代谢产物如24,25(OH)2D等,进而可能高估总25OHD的水平。目前临床上采用的多是化学发光法。而后两种方法,尤其LC-MS可去除其他维生素D代谢物的干扰,区分25OHD2和25OHD3是目前25OHD测定的金标准[4]。
DBP测定早期DBP的测定采用单克隆与多克隆抗体的免疫比浊法。其后,大量研究开始应用双抗体夹心酶联免疫吸附法(enzyme linked immunosorbent assay,ELISA)。DBP的测量结果因抗体来源为单克隆或多克隆而有差异[5]。2015年,Hoofnagle和Nielson将LC-MS用于DBP的测量,该方法通过将血浆蛋白裂解成肽段,达到了更准确的检测和定量[6-7]。尽管如此,目前仍缺乏DBP标准化的测量方法,不同方法和研究中的结果很难进行比较。
影响DBP和25OHD的生理、病理因素不同病理生理条件下,维生素D营养状况指标变化见表 1。
| 病理生理条件 | DBP水平 | 25OHD | 游离25OHD | 第一作者 |
| 黑种人 | 低 | 低 | 正常 | Powe[11]* Aloia[12]** |
| 妊娠 | 高 | 高/正常 | 正常 | Zhang[19]* |
| 绝经 | 低 | 低 | 低 | Pop[17]* |
| 肥胖 | 低/正常 | 低 | 低/正常 | Holmlund-Suila[22]** Walsh[23]** Giudice[25]* |
| 肢端肥大症 | 高 | 正常 | 低 | Altinova[27]* |
| 终末期肝脏疾病 | 低 | 低 | 高/正常 | Lai[28]** Corey[29]** Bikle[30]* |
| 肾病综合征 | 低 | 低 | 正常 | Aggarwal[32]* |
| 原发性甲状旁腺功能亢进 | 低 | 低 | 低/正常 | Wang[36, 37]* Battista[38]* |
| 糖尿病 | 低 | Blanton[39] N/A | ||
| 危重症 | 低 | 低 | 低/正常/高 | Madden[43]* |
| 囊性纤维化 | 低 | 低 | 低 | Lee[44]* |
| 多发性硬化症 | 高/正常 | 高 | 低 | Rinaldi[45]* Behrens[46]* |
| 精神疾病 | 高 | 正常 | 低 | Yee[49]* |
| 口服避孕药 | 高 | 高/正常 | 正常 | Harmon[52]* |
| 手术后 | 低 | 低 | 低 | Waldron[42] N/A Binkley[58]* |
| *计算获得的游离25OHD;**实际直接测量游离25OHD;N/A:没有计算或测量游离25OHD | ||||
近期的研究发现,女性DBP水平与年龄呈负相关,提示年龄可能是影响DBP和25OHD水平的独立因素[8]。在性别方面,尽管有研究发现女性人群中DBP的水平可能对于循环中25OHD的浓度影响不大[9]。但是,另一项评估了100名健康中老年受试者的研究表明,女性的DBP水平比男性的高10%,并且与年龄、体质量、体质量指数(body mass index,BMI)、脂肪量和体脂百分比无关[10]。这可能是高水平雌激素对DBP的影响。
不同种族可导致DBP水平的差异。白种人的等位基因差异可导致DBP浓度的改变,黑种人则不会;利用单克隆抗体ELISA法测定的DBP浓度,黑种人比白种人更低,采用多克隆抗体测量似乎观察不到人种差异。而且两者之间,经计算获得的生物学活性25OHD[11]或直接测量的游离25OHD均无明显差异[12]。但是,一项研究发现,即使采用多克隆抗体直接测量或计算DBP水平,相对于白种人,黑种人的游离25OHD水平仍然是低下的[7]。在黄种人中,DBP基因同样也存在变异性,且与25OHD和维生素D缺乏有关[13]。Li等[14]发现在中国绝经后女性中,具有生物学活性的25OHD是一个独立的决定骨密度的因素,而非总25OHD。
在遗传方面,DBP和25OHD的遗传学效应相当复杂。通过基因测序目前已有超过120种DBP基因的变异性被发现,包括3种已发现的表型变异性:Gc1F、Gc2、Gc1S。这些变异性的存在可以改变血浆25OHD的浓度和亲和力,进而影响25OHD与DBP的结合[15]。近期一项研究发现具有Gc2/Gc2等位基因表型的受试者比Gc1S受试者总25OHD和DBP浓度更低,男性亦比女性低。然而,当比较直接测量的游离25OHD时,这种表型和性别差异明显缩小。在长期补充维生素D后,不同的基因型、性别和年龄对25OHD的影响没有明显差异。由此可见,补充维生素D可能不会影响DBP水平[16]。由于DBP的基因表型影响DBP水平和亲和力,当比较不同种族间维生素D营养状态时,应考虑直接测量游离25OHD的水平。
内分泌激素对DBP的影响雌激素与DBP:雌激素可促进DBP的合成。Pop等[17]观察了165名26~72岁女性受试者发现,绝经前女性比绝经后女性的雌二醇、25OHD和DBP的水平高,而且经计算获得的游离25OHD和具有生物学活性的25OHD也明显偏高。雌激素与DBP水平独立相关。体外试验发现,雌激素可促进雌性动物肝细胞摄取DBP,但对雄性动物的肝细胞无类似作用。提示雌激素对DBP的调控取决于雌激素受体的表达[18]。妊娠期女性DBP因为雌激素的升高而升高,总25OHD也显著增高,而经计算获得的游离25OHD相对稳定[19];但是,总的或者是经计算获得的游离1,25(OH)2D则显著增加[20]。
女性生理周期雌激素的波动似乎对DBP水平没有影响。Franasiak等[21]发现正在行人工助孕的妇女,雌激素在由基线达到峰值过程中,无论是在早期、中期和晚期卵泡相,DBP始终没有变化。
胰岛素与DBP:肥胖人群中普遍存在维生素D缺乏。相比健康人群,肥胖者总的和测量的25OHD均显著降低,且与DBP水平不相关[22]。Walsh等[23]也发现,超重和肥胖人群DBP,总25OHD和实测的游离25OHD也显著下降,但与骨密度和骨转换指标不相关。青少年人群中,肥胖者比正常体质量者DBP水平有所降低,校正体质量因素后,肥胖者胰岛素水平和DBP负相关,提示胰岛素可能抑制DBP的生成[24]。另一项横断面研究发现,尽管总25OHD水平接近,儿童伴有胰岛素抵抗者相比于非胰岛素抵抗者有更高的计算获得的生物学活性25OHD。这也进一步表明了胰岛素抵抗与DBP水平负相关。胰岛素抵抗引起DBP降低,进而改变有生物学活性的游离25OHD的水平[25]。
生长激素与DBP:使用生长激素治疗会增加DBP的水平。Brixen等[26]证实正常男性在使用重组人生长激素初期,会增加血清DBP和IGF-1的水平。Altinova等[27]发现肢端肥大症患者较正常对照者,血清DBP升高,总25OHD正常,而游离25OHD降低。
疾病对DBP的影响终末期肝脏疾病与DBP:终末期肝病患者普遍存在血清25OHD降低,且血清总25OHD的水平与肝病的严重程度负相关。总25OHD的降低主要因为肝硬化患者白蛋白和DBP降低所致,但实测的游离25OHD基本不变[28]。因此,终末期肝病患者通常不会出现继发性甲状旁腺功能亢进[29];其引起的骨病,活检的病理结果更符合骨质疏松而不是骨软化,补充维生素D也不能逆转骨病的进程。Corey等[29]提出在终末期肝病患者中,结合游离25OHD和DBP水平能够更准确地建立维生素D缺乏的诊断。类似的结论在Bikle等[30]的更早期研究中,也得到证实。
肾脏疾病与DBP:对于慢性肾脏疾病的患者(chronic kidney diasease,CKD),无论处在何种阶段,普遍存在总25OHD的降低。在中国南部地区的一项回顾性研究中发现,CKD 4期和5期的25OHD低于CKD3期的患者[31]。Megalin依赖的DBP摄取在CKD患者肾脏中发生改变,可能降低胞内分泌的25OHD向1,25(OH)2D转变,从而引起肾性骨病等并发症[1]。在肾病综合征患者中,DBP经尿液的丢失可能是导致总25OHD降低的重要原因。
然而,近期的研究发现,尽管肾病综合征患者血清DBP较正常对照人群略有下降,但并无统计学意义[32]。造成上述结果矛盾的原因,可能在于疾病的病程、严重程度以及患者体内维生素D的储存状态等[33]。Aggarwal等[32]发现在肾病综合征患者中,经计算获得具有生物学活性的25OHD显著下降,其下降水平与骨密度和骨标志物相关。
另有研究显示,尿液中DBP的丢失,可随蛋白尿治疗的好转而改善,但是蛋白质的丢失与25OHD的改变没有关联[34]。此外,对于类固醇抵抗的肾病综合征患者,尿液中DBP的丢失较类固醇敏感的患者显著增高[35]。
原发性甲状旁腺功能亢进症与DBP:维生素D缺乏或不足在原发性甲状旁腺功能亢进症的患者中非常普遍,具体机制仍不甚清楚。Wang等[36]发现在绝经后原发性甲状旁腺功能亢进症患者中,25OHD、白蛋白和DBP显著降低。此外,原发性甲旁亢患者总25OHD和DBP相比正常人群降低约20%,但两组经计算获得的游离25OHD没有差别[37]。Battista等[38]也发现原发性甲状旁腺功能亢进症患者确实存在低DBP血症。血清DBP水平与游离甲状旁腺激素水平呈负相关(r=-0.383,P<0.01)。在行甲状旁腺切除术3个月后,DBP和总25OHD水平会增加大约20%。这些发现提示,原发性甲状旁腺功能亢进症患者总25OHD的降低,部分原因是由于DBP降低而引起的。
糖尿病与DBP:Blanton等[39]发现1型糖尿病患者较健康人群的血清DBP水平降低,推测1型糖尿病的患者存在维生素D代谢改变,且可能潜在影响疾病的发展。另一项研究表明,相较于正常人,1型糖尿病患者通过尿液丢失的DBP更多,可能导致血清25OHD水平降低[40]。Tian等[41]发现同时伴有肾病或者微量白蛋白尿、大量白蛋白尿的糖尿病患者,DBP水平高于尿蛋白正常的正常人或者糖尿病患者。有研究提出,是否可以考虑将尿液DBP作为早期糖尿病肾病诊断的生化标志物[42]。
危重症与DBP:维生素D可以调节免疫细胞的受体和免疫级联反应。大量研究发现,在脓毒败血症的啮齿动物模型中,25OHD可调节促炎性细菌内毒素的免疫反应。在系统性的炎症反应中,血清DBP水平下降,可能导致总25OHD降低,此时,总25OHD不能很好地反映维生素D营养状态[42]。危重患者或脓毒败血症患者DBP水平进一步降低,伴随总25OHD水平下降,而游离25OHD因DBP得以维持相对稳定。治疗上仅以总25OHD水平作为依据,而不考虑DBP,可能会增加假阴性结果[43]。由此推测,在危重状态下,25OHD结合DBP而非总25OHD是反映维生素D营养状态的更可靠指标。
其他疾病与DBP:囊性纤维化患者同样普遍存在维生素D缺乏。一项研究发现,相较于正常健康人群,囊性纤维化患者可能因为营养不良而导致血清白蛋白和DBP降低,其实测和经计算获得的游离25OHD也显著下降[44]。
维生素D的缺乏可能是促发多发性硬化症的环境危险因素之一。研究发现,多发性硬化症患者DBP高于健康对照者,由此推算其具有生物学活性的25OHD水平可能低于正常人群[45]。然而,另一研究发现,多发性硬化症患者的DBP与正常对照组之间没有差异,仅计算获得的25OHD偏低[46]。相关研究仍需进一步证实。
在其他免疫系统相关的疾病中,DBP可能同样发挥了重要作用。Zhang等[47]发现,与健康对照组比较,牙龈炎患者血清DBP浓度增高,龈沟液局部的DBP浓度降低,与牙周炎的病情相关。此外,DBP与哮喘也存在一定关联,激素抵抗的哮喘患者血清DBP水平较激素敏感性患者显著增高[48]。
精神疾病与DBP:慢性精神病患者总25OHD水平常常降低。Yee等[49]发现一期精神病患者和健康对照人群相比总25OHD没有差异,由于精神病患者的DBP水平增高,其经计算获得的游离25OHD更低。游离25OHD与患者的症状严重程度负有关。Guo等[50]也发现,自闭症患者的血清25OHD水平明显低于正常儿童。
其他因素对DBP的影响一项针对获得性免疫缺陷综合征患者的研究中,采用替诺福韦/拉米夫定/依法韦仑联合抗病毒治疗,分别于研究初始阶段、治疗24周和48周,测定DBP、iPTH和总25OHD,结果总25OHD在抗病毒治疗前后没有改变,而DBP和iPTH则显著增加。由此提示,抗反转录病毒治疗可能使DBP升高,从而降低具有生物学活性的25OHD水平,引起iPTH增加[51]。
服用含有雌激素的避孕药会使总25OHD和1,25(OH)2D浓度增加大约20%;其原因可能在于,口服含有此类药物会增加DBP合成,抑制DBP的降解,造成DBP浓度增加13%~25%[52]。绝经后妇女使用雌激素治疗后,DBP可增加8%,进一步说明外源性雌激素是影响DBP和25OHD水平的重要因素[53]。脑血栓的患者使用阿司匹林后,其DBP水平较治疗前明显增高,但升高的DBP是否会影响总25OHD尚需进一步研究[54]。吸烟者较非吸烟者的DBP水平低,可能与吸烟会下调DBP水平有关,但不能将DBP作为吸烟相关疾病的生物标志物[55]。
操作和手术对DBP的影响Cavalier等[56]发现血液透析有大量的白蛋白、DBP和25OHD的丢失。当有高吸收、高截留量透析时,DBP丢失更加明显。血浆置换在移除循环中病理性蛋白的同时,DBP等生理性蛋白、1,25(OH)2D以及电解质等也在一定程度上被不可避免地移除。尤其是,血浆中的25OHD往往持续性地减少[57]。
手术后患者血清25OHD和DBP通常也是降低的[41]。手术可以改变维生素D状态的指标参数以及其他实验室结果[58]。因此,在血液透析、血浆置换和手术后,血清总25OHD不能有效评估维生素D的营养状态。
结论DBP与总25OHD以及游离25OHD的相互关系非常复杂。不同生理、病理状态以及药物的使用,可能通过改变DBP,影响总25OHD和游离25OHD的水平。临床上对于总25OHD偏低的患者,应该考虑是否存在影响DBP的因素,如果总25OHD水平不足以代表维生素D营养状态,则可能需要测定游离的25OHD或者结合PTH与血钙的水平,做出综合判断。
| [1] | Chun RF, Peercy BE, Orwoll ES, et al. Vitamin D and DBP:the free hormone hypothesis revisited[J]. J Steroid Biochem Mol Biol, 2014, 144(Pt A): 132–137. |
| [2] | Rowling MJ, Kemmis CM, Taffany DA, et al. Megalin-mediated endocytosis of vitamin D binding protein correlates with 25-hydroxycholecalciferol actions in human mammary cells[J]. J Nutr, 2006, 136: 2754–2759. |
| [3] | Yousefzadeh P, Shapses SA, Wang X. Vitamin D binding protein impact on 25-hydroxyvitamin D levels under different physiologic and pathologic conditions[J]. Int J Endocrinol, 2014, 2014: 981581. |
| [4] | Holick MF. Vitamin D status:measurement, interpretation, and clinical application[J]. Ann Epidemiol, 2009, 19: 73–78. DOI:10.1016/j.annepidem.2007.12.001 |
| [5] | Denburg MR, Hoofnagle AN, Sayed S, et al. Comparison of two ELISA methods and mass spectrometry for measurement of vitamin D-binding protein:implications for the assessment of bioavailable vitamin D concentrations across genotypes[J]. J Bone Miner Res, 2016, 31: 1128–1136. |
| [6] | Hoofnagle AN, Eckfeldt JH, Lutsey PL. Vitamin D-binding protein concentrations quantified by mass spectrometry[J]. N Engl J Med, 2015, 373: 1480–1482. |
| [7] | Nielson CM, Jones KS, Chun RF, et al. Free 25-hydroxyvitamin D:impact of vitamin D binding protein assays on racial-genotypic associations[J]. J Clin Endocrinol Metab, 2016, 101: 2226–2234. DOI:10.1210/jc.2016-1104 |
| [8] | Lauridsen AL, Vestergaard P, Hermann AP, et al. Plasma concentrations of 25-hydroxy-vitamin D and 1, 25-dihydroxy-vitamin D are related to the phenotype of Gc (vitamin D-binding protein):a cross-sectional study on 595 early postmenopausal women[J]. Calcif Tissue Int, 2005, 77: 15–22. |
| [9] | Winters SJ, Chennubhatla R, Wang C, et al. Influence of obesity on vitamin D-binding protein and 25-hydroxy vitamin D levels in African American and white women[J]. Metabolism, 2009, 58: 438–442. DOI:10.1016/j.metabol.2008.10.017 |
| [10] | Bolland MJ, Grey AB, Ames RW, et al. Age-, gender-, and weight-related effects on levels of 25-hydroxyvitamin D are not mediated by vitamin D binding protein[J]. Clin Endocrinol, 2007, 67: 259–264. |
| [11] | Powe CE, Evans MK, Wenger J, et al. Vitamin D-binding protein and vitamin D status of black Americans and white Americans[J]. N Engl J Med, 2013, 369: 1991–2000. DOI:10.1056/NEJMoa1306357 |
| [12] | Aloia J, Mikhail M, Dhaliwal R, et al. Free 25OHD and the vitamin D paradox in African Americans[J]. J Clin Endocrinol Metab, 2015, 100: 3356–3363. |
| [13] | Cheung CL, Lau KS, Sham PC, et al. Genetic variant in vitamin D binding protein is associated with serum 25-hydroxyvitamin D and vitamin D insufficiency in southern Chinese[J]. J Hum Genet, 2013, 58: 749–751. DOI:10.1038/jhg.2013.84 |
| [14] | Li C, Chen P, Duan X, et al. Bioavailable 25OHD but not total 25OHD is an independent determinant for bone mineral density in Chinese postmenopausal women[J]. EBioMedicine, 2017, 15: 184–192. |
| [15] | Bhan I. Vitamin D binding protein and bone health[J]. Int J Endocrinol, 2014, 2014: 561214. |
| [16] | Sollid ST, Hutchinson MY, Berg V, et al. Effects of vitamin D binding protein phenotypes and vitamin D supplementation on serum total 25OHD and directly measured free 25OHD[J]. Eur J Endocrinol, 2016, 174: 445–452. |
| [17] | Pop CL, Shapses SA, Chang B, et al. Vitamin D binding protein in healthy pre-and postmenopausal women:relationship with estradiol concentrations[J]. Endocr Pract, 2015, 21: 936–942. |
| [18] | Pirani T, Chen J, Vieira A. Effects of estradiol on the endocytic transport of vitamin D carrier protein in hepatocytes[J]. Biochim Biophys Acta, 2013, 1830: 3421–3426. |
| [19] | Zhang JY, Lucey AJ, Horgan R, et al. Impact of pregnancy on vitamin D status:a longitudinal study[J]. Br J Nutr, 2014, 112: 1081–1087. |
| [20] | Bikle DD, Gee E, Halloran B, et al. Free 1, 25-dihydroxyvitamin D levels in serum from normal sub-jects, pregnant subjects, and subjects with liver disease[J]. J Clin Invest, 1984, 74: 1966–1971. DOI:10.1172/JCI111617 |
| [21] | Franasiak JM, Wang X, Molinaro TA, et al. Free vitamin D does not vary through the follicular phase of the menstrual cycle[J]. Endocrine, 2016, 53: 322–326. |
| [22] | Holmlund-Suila E, Pekkinen M, Ivaska KK, et al. Obese young adults exhibit lower total and lower free serum 25-hydroxycholecalciferol in a randomized vita-min D intervention[J]. Clin Endocrinol (Oxf), 2016, 85: 378–385. DOI:10.1111/cen.2016.85.issue-3 |
| [23] | Walsh JS, Evans AL, Bowles S, et al. Free 25-hydroxyvitamin D is low in obesity, but there are no adverse associations with bone health[J]. Am J Clin Nutr, 2016, 103: 1465–1471. DOI:10.3945/ajcn.115.120139 |
| [24] | Ashraf AP, Huisingh C, Alvarez JA, et al. Insulin resistance indices are inversely associated with vitamin D binding protein concentrations[J]. J Clin Endocrinol Metab, 2014, 99: 178–183. |
| [25] | Miraglia del Giudice E, Grandone A, Cirillo G, et al. Bioavailable vitamin D in obese children:The role of insulin resistance[J]. J Clin Endocrinol Metab, 2015, 100: 3949–3955. DOI:10.1210/jc.2015-2973 |
| [26] | Brixen K, N H, Bouillon R, et al. Effects of short-term growth hormone treatment on PTH, calcitriol, thyroid hormones, insulin and glucagon[J]. Acta Endocrinol (Copenh), 1992, 127: 331–336. |
| [27] | Altinova AE, Ozkan C, Akturk M, et al. Vitamin D-binding protein and free vitamin D concentrations in acromegaly[J]. Endocrine, 2016, 52: 374–379. DOI:10.1007/s12020-015-0789-1 |
| [28] | Lai JC, Bikle DD, Lizaola B, et al. Total 25(OH) vitamin D, free 25(OH) vitamin D and markers of bone turnover in cirrhotics with and without synthetic dysfunction[J]. Liver Int, 2015, 35: 2294–2300. DOI:10.1111/liv.2015.35.issue-10 |
| [29] | Corey RL, Whitaker MD, Crowell MD, et al. Vitamin D deficiency, parathyroid hormone levels, and bone disease among patients with end stage liver disease and normal serum creatinine awaiting liver transplantation[J]. Clin Transplant, 2014, 28: 579–584. |
| [30] | Bikle DD, Halloran BP, Gee E, et al. Free 25-hydroxyvitamin D levels are normal in subjects with liver disease and reduced total 25-hydroxyvitamin D levels[J]. J Clin Invest, 1986, 78: 748–752. DOI:10.1172/JCI112636 |
| [31] | Feng M, Lv J, Huang FT, et al. Predictors of Vitamin D deficiency in predialysis patients with stage 3-5 chronic kidney diseases in Southern China[J]. Niger J Clin Pract, 2017, 20: 1309–1315. DOI:10.4103/njcp.njcp_27_17 |
| [32] | Aggarwal A, Yadav AK, Ramachandran R, et al. Bioavailable vitamin D levels are reduced and correlate with bone mineral density and markers of mineral metabolism in adults with nephrotic syndrome[J]. Nephrology (Carlton), 2016, 21: 483–489. DOI:10.1111/nep.2016.21.issue-6 |
| [33] | Colston K, Williams NJ, Cleeve HJ. Studies on vitamin D binding protein in the nephrotic syndrome[J]. Clin Chem, 1985, 31: 718–721. |
| [34] | Doorenbos CR, de Cuba MM, Vogt L, et al. Antiproteinuric treatment reduces urinary loss of vitamin D-binding protein but does not affect vitamin D status in patients with chronic kidney disease[J]. J Steroid Biochem Mol Biol, 2012, 128: 56–61. DOI:10.1016/j.jsbmb.2011.09.002 |
| [35] | Bennett MR, Pordal A, Haffner C, et al. Urinary vitamin D-binding protein as a biomarker of steroid-resistant nephrotic syndrome[J]. Biomark Insights, 2016, 11: 1–6. |
| [36] | Wang X, Shapses SA, Wei S, et al. Vitamin D-binding protein levels in female patients with primary hyperparathyroidism[J]. Endocr Pract, 2013, 19: 609–613. DOI:10.4158/EP12371.OR |
| [37] | Wang X, Shapses SA, Al-Hraishawi H. Free and bioavailable 25-hydroxyvitamin D levels in patients with primary hyperparathyroidism[J]. Endocr Pract, 2017, 23: 66–71. DOI:10.4158/EP161434.OR |
| [38] | Battista C, Guarnieri V, Carnevale V, et al. Vitamin D status in primary hyperparathyroidism:effect of genetic background[J]. Endocrine, 2017, 55: 266–272. DOI:10.1007/s12020-016-0974-x |
| [39] | Blanton D, Han Z, Bierschenk L, et al. Reduced serum vitamin D-binding protein levels are associated with type 1 diabetes[J]. Diabetes, 2011, 60: 2566–2570. DOI:10.2337/db11-0576 |
| [40] | Thrailkill KM, Jo C-H, Cockrell GE, et al. Enhanced excretion of vitamin D binding protein in type 1 diabetes:a role in vitamin D deficiency?[J]. J Clin Endocrinol Metab, 2011, 96: 142–149. DOI:10.1210/jc.2010-0980 |
| [41] | Tian XQ, Zhao LM, Ge JP, et al. Elevated urinary level of vitamin D-binding protein as a novel biomarker for diabetic nephropathy[J]. Exp Ther Med, 2014, 7: 411–416. DOI:10.3892/etm.2013.1426 |
| [42] | Waldron JL, Ashby HL, Cornes MP, et al. Vitamin D:a negative acute phase reactant[J]. J Clin Pathol, 2013, 66: 620–622. DOI:10.1136/jclinpath-2012-201301 |
| [43] | Madden K, Feldman HA, Chun RF, et al. Critically Ill children have low vitamin D-binding protein, influencing bioavailability of vitamin D[J]. Ann Am Thorac Soc, 2015, 12: 1654–1661. |
| [44] | Lee MJ, Kearns MD, Smith EM, et al. Free 25-hydroxyvitamin D concentrations in cystic fibrosis[J]. Am J Med Sci, 2015, 350: 374–379. DOI:10.1097/MAJ.0000000000000592 |
| [45] | Rinaldi AO, Sanseverino I, Purificato C, et al. Increased circulating levels of vitamin D binding protein in MS patients[J]. Toxins, 2015, 7: 129–137. DOI:10.3390/toxins7010129 |
| [46] | Behrens JR, Rasche L, Gieß RM, et al. Low 25-hydroxyvitamin D, but not the bioavailable fraction of 25-hydroxyvitamin D, is a risk factor for multiple sclerosis[J]. Eur J Neurol, 2016, 23: 62–67. DOI:10.1111/ene.12788 |
| [47] | Zhang X, Meng H, Xu L, et al. Vitamin d-binding protein levels in plasma and gingival crevicular fluid of patients with generalized aggressive periodontitis[J]. Int J Endocrinol, 2014, 2014: 783575. |
| [48] | Jiang H, Chi X, Zhang X, et al. Increased serum VDBP as a risk predictor for steroid resistance in asthma patients[J]. Respir Med, 2016, 114: 111–116. DOI:10.1016/j.rmed.2016.03.011 |
| [49] | Yee JY, Chi X, Zhang X, et al. Association between serum levels of bioavailable vitamin D and negative symptoms in first-episode psychosis[J]. Psychiatry Res, 2016, 243: 390–394. DOI:10.1016/j.psychres.2016.07.003 |
| [50] | Guo M, ZJ, Yang T, et al. Vitamin A and vitamin D deficiencies exacerbate symptoms in children with autism spectrum disorders[J]. Nutr Neurosci, 2018, 16: 1–11. |
| [51] | Hsieh E, Fraenkel L, Han Y, et al. Longitudinal increase in vitamin D binding protein levels after initia-tion of tenofovir/lamivudine/efavirenz among individuals with HIV[J]. AIDS, 2016, 30: 1935–1942. DOI:10.1097/QAD.0000000000001131 |
| [52] | Harmon QE, Umbach DM, Baird DD. Use of estro-gen-containing contraception is associated with increased concentrations of 25-hydroxy vitamin D[J]. J Clin Endocrinol Metab, 2016, 101: 3370–3377. DOI:10.1210/jc.2016-1658 |
| [53] | Rejnmark L, Lauridsen AL, Brot C, et al. Vitamin D and its binding protein Gc:long-term variability in peri-and postmenopausal women with and without hormone replacement therapy[J]. Scand J Clin Lab Invest, 2006, 66: 227–238. DOI:10.1080/00365510600570623 |
| [54] | Li Z, Gao J, Ma Y, et al. Vitamin D-binding protein acts in the actin scavenge system and can have increased expression during aspirin therapy[J]. Curr Neurovasc Res, 2016, 13: 184–192. DOI:10.2174/1567202613666160506125622 |
| [55] | Bortner JD Jr, Richie JP Jr, Das A, et al. Proteomic profiling of human plasma by iTRAQ reveals down-regulation of ITI-HC3 and VDBP by cigarette smoking[J]. J Proteome Res, 2011, 10: 1151–1159. DOI:10.1021/pr100925p |
| [56] | Cavalier E, Torres PU, Dubois BE, et al. Impact of the type of dialysis membranes on the circulating concentration of markers of vitamin D metabolism[J]. Int J Artif Organs, 2017, 40: 43–47. DOI:10.5301/ijao.5000565 |
| [57] | Hiemstra TF, Casian A, Boraks P, et al. Plasma exchange induces vitamin D deficiency[J]. QJM, 2014, 107: 120–130. |
| [58] | Binkley N, Coursin D, Krueger D, et al. Surgery alters parameters of vitamin D status and other laboratory results[J]. Osteoporos Int, 2017, 28: 1013–1020. DOI:10.1007/s00198-016-3819-9 |
| (收稿日期:2018-02-17) |

