2. 350028 福州,福建省立金山医院内科;
3. 350001 福州,福建省立医院心电图室;
4. 350001 福州,福建省立医院急诊科;
5. 364000 福建龙岩,龙岩市第一医院内分泌科;
6. 362000 福建泉州,泉州第一医院城东分院内分泌科;
7. 350001 福州,福建省立医院内分泌科
2. Department of Internal Medicine, Fujian Provincial Jinshan Hospital, Fuzhou 350008, China;
3. Department of ECG, Fujian Provincial Hospital, Fuzhou 350001, China;
4. Department of Emergency, Fujian Provincial Hospital, Fuzhou 350001, China;
5. Department of Endocrinology, the First Hospital, Longyan 364000, Fujian, China;
6. Department of Endocrinology, Chengdong Branch, the First Hospital, Quanzhou 362000, Fujian, China;
7. Department of Endocrinology, Fujian Provincial Hospital, Fuzhou 350001, China
绝经后骨质疏松症是绝经后妇女由于雌激素缺乏引起骨组织结构发生变化及骨量减少,使骨脆性增加而易于骨折,并引起骨痛、骨骼变形的疾病,常可出现一些并发症,严重影响到绝经后妇女的生活质量及身体健康,甚至导致死亡。近年来大量研究发现:乳铁蛋白 (lactoferrin,LF) 可以促进成骨细胞的增生,促进骨形成[1-2],抑制破骨细胞的生成,抑制骨吸收[3]。Naot等[4]发现乳铁蛋白通过上调骨细胞胰岛素样生长因子-1(insulin-like growth factor-1,IGF-1) mRNA的表达,使胰岛素样生长因子-1受体 (insulin-like growth factor-1 receptor,IGF-1R) 与IGF-1结合,使底物受体磷酸化,增加了成骨细胞的增生、分化、存活,从而达到治疗骨质疏松的效果。本研究通过建立去卵巢大鼠骨质疏松模型,给予不同浓度的乳铁蛋白进行干预,旨在探讨乳铁蛋白是否可能通过抑制胰岛素样生长因子结合蛋白-2(insulin-like growth factor binding protein-2,IGFBP-2)、胰岛素样生长因子结合蛋白-4(insulin-like growth factor binding protein-4,IGFBP-4) mRNA水平,促进IGF-1R mRNA水平的表达来改善绝经后骨质疏松,为临床上治疗绝经后骨质疏松症提供思路。
材料与方法 材料50只6月龄清洁级雌性Sprague Dawley大鼠 (SD大鼠)(购置于福建医科大学动物实验中心),实验动物许可证号:SCXK (闽)2012-0001,体质量 (270±20) g,分笼喂养,室温 (20±3)℃,相对湿度为40%~60%,适应性喂养1周,自然饮水、进食 (饲料由福建医科大学动物实验中心提供)。乳铁蛋白 (95%纯度,产于新西兰,购于南京天淳贸易有限责任公司,批号:20130427);Trizol RNA提取试剂盒 (美国Invitrogen),SYBR Premix Ex TaqTM Ⅱ试剂盒 (日本TaKaRa公司),反转录反应试剂盒 (日本TaKaRa公司),IGF-1R、IGFBP2、IGFBP4引物的设计与合成 (日本TaKaRa公司)。
方法动物分组与造模:将50只大鼠采用数字表法随机分为假手术组 (Sham组)10只与去卵巢模型组 (Ovx组)40只,40只去卵巢大鼠又采用数字表法随机分为骨质疏松模型组 (Con组),不同剂量LF治疗组[(0.1 g/kg·d) 组 (LF1),(1 g/kg·d) 组 (LF2),(2 g/kg·d) 组 (LF3)]。Sham组及Ovx组均沿两侧肋下剪开腰肌,各干预组均摘除双侧卵巢后,关闭切口;Sham组大鼠只切除卵巢附近与之等量的脂肪组织后,关闭切口。手术后所有大鼠每天青霉素5万U/只肌注,持续3 d,以预防感染。术后1周给予药物干预治疗,Sham组及Con组每天用2 mL蒸馏水灌胃1次。LF1组:每天用0.1 g/kg的乳铁蛋白溶解于2 mL蒸馏水灌胃1次;LF2组:每天用1.0 g/kg的乳铁蛋白溶解于2 mL蒸馏水灌胃1次;LF3组:每天用2.0 g/kg的乳铁蛋白溶解于2 mL蒸馏水灌胃1次,连续干预24周。治疗24周后,处死各组大鼠,将大鼠右侧股骨和第2~4腰椎、右侧肱骨、右侧胫骨从肌肉上剥离,并将标本分成两份,一份立即经0.9%氯化钠注射液冲洗后置于液氮中用于提取总RNA,另一份经4%多聚甲醛固定包埋制成蜡块,用于制作HE石蜡病理切片。
各组胫骨骺线下干骺端切片HE染色:用二甲苯脱去切片中的石蜡,再经由高浓度到低浓度乙醇,最后入蒸馏水。将已入蒸馏水后的切片放入苏木精水溶液中染色数分钟,后经酸水及氨水中分色,各数秒钟,流水冲洗半小时后入蒸馏水片刻,然后入70%和90%乙醇中脱水各10 min,后入乙醇伊红染色液染色2~3 min,然后常规脱水、透明、干燥、封片。
实时荧光定量PCR检测各组IGF-1R、IGFBP-2、IGFBP-4 mRNA的表达:取新鲜股骨头约100 mg,采用Trizol试剂盒提取总RNA,紫外分光光度计检测总RNA的浓度及纯度,以1%的琼脂糖凝胶电泳进一步分析其纯度及完整性,按照逆转入试剂盒操作步骤,每个标本取1 μg总RNA进行逆转入、扩增,然后严格按照SYBR Premix Ex TaqTM Ⅱ试剂盒的操作步骤检测各组IGF-1R、IGFBP-2、IGFBP-4 mRNA的表达情况。
统计学方法所有数据均采用SPSS19.0统计软件进行分析,计量资料,符合正态分布,方差齐性检验用Levene检验 (检验标准为0.10)。符合方差齐性的各组间样本均数比较采用单因素方差分析 (one-way ANOVA) 及LDS检验,不符合方差齐性检验的资料使用Kruskal-Wallis H检验。同组实验前后比较用配对t检验。数据以均数±标准差 (x±s) 表示。P < 0.05为差异有统计学意义。
结果 去卵巢后大鼠骨组织HE染色变化各组胫骨骺线下干骺端切片HE染色结果显示:Sham组骨小梁排列密集、饱满,间距小,细胞数量多;而Con组骨小梁数量减少、变细、断裂,骨小梁距离增宽,排列稀疏,细胞数量少,骨小梁结构出现较大的空白区域 (图 1),因此表明成功建立去卵巢大鼠骨质疏松模型。而LF1组、LF2组、LF3组介于Sham组和Con组之间,且骨小梁排列紧密程度、骨小梁间距、细胞数量随着乳铁蛋白浓度的增加而增加 (图 1)。
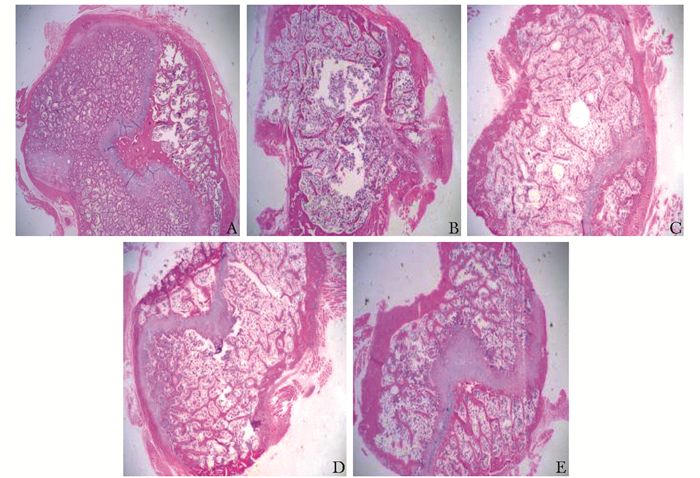
|
| 图 1 大鼠胫骨病理改变 (HE染色,×40) Figure 1 Pathological changes of tibia A:Sham组 (假手术组);B:Con组 (模型组);C:LF1组 (乳铁蛋白0.1 g/kg·d组);D:LF2组 (乳铁蛋白1 g/kg·d组);E:LF3组 (乳铁蛋白2 g/Kg·d组) |
管家基因β-actin和IGF-1R、IGFBP-2、IGFBP-4基因都有较好的扩增曲线和融解曲线,β-actin基因与IGF-1R、IGFBP-2、IGFBP-4融解曲线均可见有特异性扩增产物出现,即出现一个高尖的Tm峰,80~90 ℃可见峰值,在相对应温度未检测到引物二聚体和其他非特异性荧光信号 (图 2A、C、E、G)。β-actin与IGF-1R、IGFBP-2、GFBP-4基因扩增效率较好 (图 2B、D、F、H)。
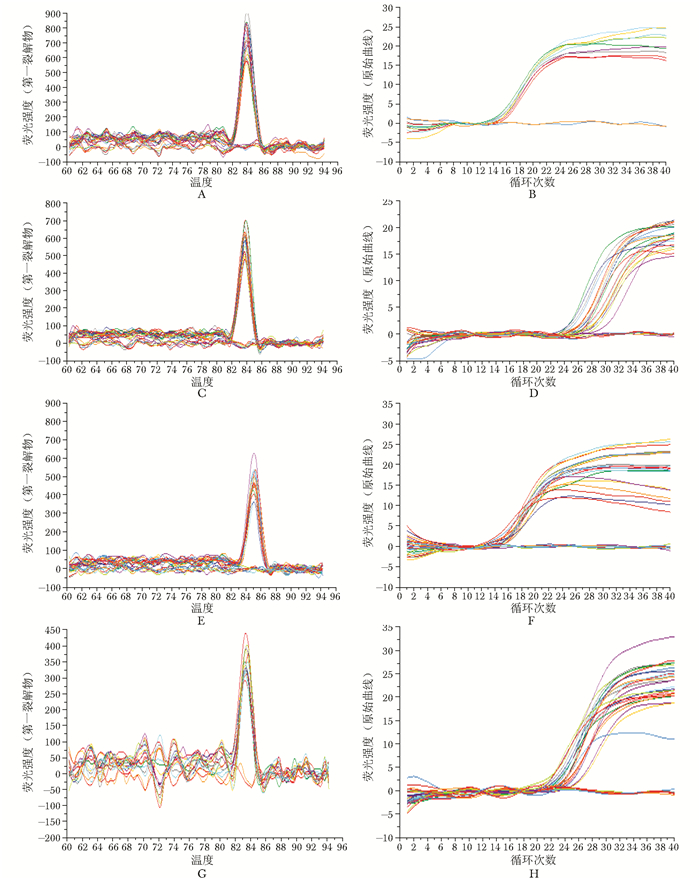
|
| 图 2 β-actin和IGF-1R、IGFBP-2、IGFBP-4基因的扩增曲线和融解曲线 Figure 2 Gene amplification and dissociation cure of β-actin and IGF-1R, IGFBP-2, IGFBP-4 A:β-actin基因融解曲线;B:β-actin基因扩增曲线;C:IGF-1R基因融解曲线;D:IGF-1R基因扩增曲线;E:IGFBP-2基因融解曲线;F:IGFBP-2基因扩增曲线;G:IGFBP-4基因融解曲线;H:IGFBP-4基因扩增曲线 |
与Sham组相比,Con组大鼠骨组织中IGFBP-2、IGFBP-4 mRNA的相对表达量明显增高,而IGF-1R mRNA的相对表达量明显降低,差异有统计学意义 (均P < 0.01);与Con组比较,LF1~3组IGFBP-2、IGFBP-4随着乳铁蛋白的浓度越高下降越明显,差异有统计学意义 (均P < 0.01),而IGF-1R mRNA相对表达量升高,且呈剂量依赖性升高。LF1组IGF-1R mRNA相对表达量虽然高于Con组,但差异无统计学意义 (P > 0.05),LF2组IGF-1R mRNA相对表达量高于Con组,差异有统计学意义 (P < 0.05),LF3组IGF-1R mRNA相对表达量显著高于Con组,差异有统计学意义 (P < 0.01)(表 1)。
| 组别 | n | IGF-1R mRNA | IGFBP-2 mRNA | IGFBP-4 mRNA |
| Con组 | 10 | 1.000±0.00 | 1.000±0.00 | 1.000±0.00 |
| Sham组 | 9 | 5.211±1.38** | 0.240±0.04** | 0.457±0.14** |
| LF1组 | 8 | 1.977±0.55 | 0.085±0.01** | 0.329±0.07** |
| LF2组 | 8 | 3.139±0.53* | 0.013±0.00** | 0.040±0.01** |
| LF3组 | 10 | 3.600±2.46** | 0.012±0.00** | 0.032±0.01** |
| Con组:模型组;Sham组:假手术组;LF1组:乳铁蛋白0.1 g/(kg·d) 组;LF2组:乳铁蛋白1 g/(kg·d) 组;LF3组:乳铁蛋白2 g/(kg·d) 组;与模型组比较,*P < 0.05,**P < 0.01 | ||||
与LF1组比较,LF2组、LF3组大鼠骨组织IGFBP-2、IGFBP-4 mRNA相对表达量均明显降低,IGF-1R mRNA相对表达量均明显升高,差异有统计学意义 (均P < 0.01);与LF2组比较,LF3组大鼠骨组织IGFBP-2、IGFBP-4 mRNA相对表达量均明显降低,IGF-1R mRNA相对表达量明显升高,差异有统计学意义 (均P < 0.01)(表 2)。
| 组别 | n | IGF-1R mRNA | IGFBP-2 mRNA | IGFBP-4 mRNA |
| LF1组 | 8 | 1.000±0.00 | 1.000±0.00 | 1.000±0.00 |
| LF2组 | 8 | 1.649±0.28** | 0.227±0.03** | 0.338±0.11** |
| LF3组 | 10 | 3.600±0.48**## | 0.082±0.02**## | 0.067±0.02**## |
| LF1组:乳铁蛋白0.1 g/kg·d组;LF2组:乳铁蛋白1 g/kg·d组;LF3组:乳铁蛋白2 g/kg·d组;与LF1组比较,**P < 0.01;与LF2组比较,##P < 0.01 | ||||
乳铁蛋白属于转铁蛋白家族成员,为一种铁结合糖蛋白,在中性粒细胞次级分泌颗粒、上皮分泌液及母乳中存在[5]。近些年乳铁蛋白与骨质疏松关系引起研究者的关注。本课题组杜丹丹等[6]发现对去卵巢大鼠,以不同浓度乳铁蛋白干预3个月,呈浓度依赖性地改善其骨量、骨微结构,增加骨形成标志物,减少骨吸收标志物,促进骨形成,减少骨吸收。薛英等[7]予乳铁蛋白干预至6个月,发现其可进一步增加去卵巢大鼠骨密度及改善骨微结构。从而打破破骨细胞与成骨细胞的平衡,并具有乳铁蛋白时间浓度依赖性趋势。然而,目前对于乳铁蛋白对绝经后骨质疏松的作用机制尚无统一定论。
人体骨骼不停地进行着骨代谢和骨转换,骨量和骨密度的稳定靠骨吸收和骨形成二者之间的平衡来维持。目前,有不少研究者认为:体内众多细胞因子及激素影响了破骨细胞与成骨细胞的平衡,并认为众多细胞因子中可能起最主要作用的是包括胰岛素样生长因子结合蛋白 (insulin-likegrowth factor binding proteins,IGFBPS) 中的IGFBP-2、IGFBP-4及IGF-1R在内的IGF-1/IGFBPS系统。胰岛素样生长因子配体 (insulin-like growth factors,IGFS) 在骨代谢中以中间环节的方式间接发挥作用。一些参与骨代谢的激素可通过调节IGFBPS的合成与降解,或通过促进与
抑制成骨细胞分泌IGF-1R来间接影响IGF-1的作用强度。Jehle等研究发现,骨质疏松的发病率与胰岛素生长因子 (insulin-like growth factor,IGF) 系统密切相关,骨质疏松症患者对比同性别、同年龄无骨质疏松者,血清总IGF-1、游离IGF-1、IGFBP-5、IGFBP-3浓度分别下降了29%、73%、52%、10%;而IGFBP-1、IGFBP-6、IGFBP-2、IGFBP-4浓度较正常人分别升高了4.1、2.1、1.8、1.3倍[8]。随着芯片技术的发展,近期有通过芯片研究发现乳铁蛋白上调了人原代成骨细胞IGF-1 mRNA的表达[4],成骨细胞IGF-1表达上调后,与IGF-1R结合,引起胰岛素受体底物1(insulin receptor substrate-1,IRS-1) 磷酸化,在IGF-1与IGFBPS分离而后IGF-1与IGF-1R结合的前提下[9],促进成骨细胞的增生和存活。同时,IGFBPS比IGF-1更加严密调控着成骨细胞的增生与分化[10]。关于IGFBPS与成骨细胞增生和分化的研究不断进行,可以假设,乳铁蛋白促进成骨细胞增生和存活,可能是通过调控IGFBPS表达水平实现的。当然,这个假设需要包括本研究在内的多方面研究以进一步证实。
本课题组通过建立去卵巢大鼠骨质疏松模型,给予不同浓度的乳铁蛋白进行干预,采用实时荧光定量PCR检测骨组织中IGF-1R、IGFBP-2、IGFBP-4 mRNA的表达,结果显示:与Con组比较,LF1-3组大鼠骨组织IGFBP-2、IGFBP-4 mRNA相对表达量均明显降低,IGF-1R mRNA相对表达量均升高。同时本实验发现:乳铁蛋白浓度越高,骨组织IGFBP-2、IGFBP-4 mRNA相对表达量越低,而IGF-1R相对表达量越高。在本课题前期体外试验中已证实,乳铁蛋白可影响到包括IGF-1R、IGFBP-2、IGFBP-4 mRNA在内的IGF-1/IGFBPS系统表达,来改善骨量、骨微结构。由此可以推测在体内乳铁蛋白可能通过抑制去卵巢大鼠骨组织IGFBP-2、IGFBP-4 mRNA的表达,促进其IGF-1R mRNA的表达,从而达到改善骨质疏松的作用。
综上所述,乳铁蛋白可能通过促进IGF-1R mRNA表达,抑制IGFBP-2、IGFBP-4 mRNA表达机制促使成骨细胞增生增多,骨形成增加,并具有浓度依赖性。但乳铁蛋白是否仅仅通过IGF-1/IGFBPS系统,是否还有其他作用途径,还需要通过基因敲除IGF-1R、IGFBP-2、IGFBP-4等IGF-1/IGFBPS系统基因,观察骨密度的改变从而进一步证实,这也是本课题组下一步的研究方向。若能证实这个结果,临床治疗绝经后骨质疏松的药物将更为丰富,可进一步推动绝经后骨质疏松的治疗。
| [1] | Naot D, Grey A, Reid IR, et al. Lactoferrin:a novel bone growth factor[J]. Clin Med Res, 2005, 3 : 93–101. DOI:10.3121/cmr.3.2.93 |
| [2] | Grey A, Zhu Q, Waston M, et al. Lactoferrin potently inhibits osteoblast apoptosis, via an LRP1-independent pathway[J]. Mol Cell Endocrinol, 2006, 25 : 96–102. |
| [3] | Lorget F, Clough J, Oliveira M, et al. Lactoferrin reduces in vitro osteoclast differentiation and resorbing activity[J]. Biochem Biophys Commun, 2002, 296 : 261–6. DOI:10.1016/S0006-291X(02)00849-5 |
| [4] | Naot D, Chhana A, Matthews BG, et al. Molecular mechanisms involved in the mitogenic effect of lactoferrin in osteoblasts[J]. Bone, 2011, 49 : 217–24. DOI:10.1016/j.bone.2011.04.002 |
| [5] | Włodarski K. Lactoferrin—a promising bone-growth promoting milk-derived glycoprotein[J]. Chir Narzadow Ruchu Ortop Pol, 2009, 74 : 257-9–322-3. |
| [6] | 杜丹丹, 蓝旭华, 侯建明, 等. 乳铁蛋白对去卵巢大鼠骨代谢的影响[J]. 福建医药杂志, 2011, 33 : 6–9. |
| [7] | 薛英, 侯建明, 林庆明. 乳铁蛋白对去卵巢大鼠骨密度及M-CSF, IL-6mRNA的影响[J]. 中华骨质疏松和骨矿盐疾病杂志, 2012, 5 : 119–124. |
| [8] | Jehle PM, Schulten K, Schulz W, et al. Serum levels of insulin-like growth factor (IGF)-Ⅰ and IGF binding protein (IGFBP)-1 to-6 and their relationship to bone metabolism in osteoporosis patients[J]. Eur J Intern Med, 2003, 14 : 32–38. |
| [9] | Kawai M, Rosen CJ. The IGF-1 regulatory system and its impact on skeletal and energy homeostasis[J]. Cell Biochem, 2010, 111 : 14–9. |
| [10] | Thomas A, Linkhart, Subburaman Mohan, Daid J. Growth factors for growth and repair:IGF, TGF β and BMP[J]. Bone, 1996, 19 : 1S–12S. DOI:10.1016/S8756-3282(96)00138-X |
| (收稿日期:2016-12-21) |

