女性在绝经后,由于卵巢功能衰退雌激素水平降低,引起骨代谢失衡、骨量减少及骨细微结构破坏,成为骨质疏松症(osteoporosis,OP)的高发人群。 当前,OP的诊断金标准是通过双能X线吸收检测(dual-energy-X-ray absorptiometry,DXA)骨密度(bone mineral density,BMD),但BMD只能反映60%~70%骨强度的变化[1]。由此可见,DXA亦存在一定的缺陷。磁共振波谱成像(magnetic resonance spectroscopy,MRS)能对生物活体进行无创的定量分析,当组织发生病变时,组织的代谢异常往往早于其结构的变化。因此,MRS可应用于OP这种前期症状不明显的疾病的早期预防。 国内外报道已有应用MRS间接评价OP骨强度的报道[2, 3, 4]。骨髓脂肪含量及BMD与患者的年龄、绝经状态、体质量指数(body mass index,BMI)等因素密切相关,但部分文献样本并未区分绝经前后状态[2],亦未校正患者BMI等混杂因素,可能导致研究结果的偏差性。因此,本研究拟通过校正一系列混杂因素采用3.0T 1H-MRS评价绝经后妇女椎体骨髓脂肪含量变化规律,为研究OP诊疗提供一种新的思路。
对象与方法 对象2014年01月至2014年5月,本研究以社区为单位招募符合入选标准的绝经后健康女性42例(年龄46~73岁,绝经年数为1~23年)。入选标准[5]:(1)自然绝经1年以上;(2)无椎体骨折、无肿瘤、放射治疗/化学药物治疗、结核等病史;(3)无服用影响骨代谢的药物(如激素等);(4)无内分泌、与骨代谢相关的病变(如甲状腺功能亢进,Paget病等疾病);(5)无DXA或MRI检查禁忌证(如起搏器植入史等);(6)无子宫、卵巢切除术史。
对受试者行DXA及MRI扫描,并记录身高(cm)、体质量(kg),计算体质量指数(body mass index,BMI),BMI=体质量(kg)/身高2(m2)。并根据DXA扫描结果分为OP组、低骨量组、正常骨量组。受试者知情同意本研究,在2周内完成DXA及MRI检查。
DXA 扫描利用DXA(Prodigy Lunar,GE Healthcare,USA)对受试者腰椎前后位扫描,获取L1-4椎体T分数及BMD均值,BMD结果以g/cm2表示。扫描条件:电压76 kV,电流3 mA。按照世界卫生组织的诊断标准,将T-score≤-2.5定义为OP,将T 分数>-2.5并≤-1.0定义为低骨量[6]。每天早晨在测量受试者之前都要完成1次质量保证测试,每日扫描标准体模,研究期间其测量结果波动在DXA的质控Shewhart图范围内,变异系数(coefficient of variability,CV)为0.4%~0.6%。
MRS扫描采用3.0 Tesla MRI 扫描仪(Magnetom Verio,Siemens Healthcare,Erlangen,Germany)。仰卧位,MRS扫描前先行矢状位、冠状位、轴位T2WI以利于体素块准确定位。1H-MRS扫描参数: MRS 采用单体素点分辨表面波谱(point-resolved spectroscopy sequence,PRESS) 序列,采集部位为L3,体素感兴趣容积(volume of interest,VOI)为15 mm×15 mm×15 mm,分别在VOI 6个方向上添加饱和带避免周围组织干扰。采集数据前进行常规自动预扫描(包括自动匀场),进行不抑水的MRS扫描。参数:TR=3 000 ms,TE=30 ms,波宽2 000 Hz,激励64 次,扫描时间3 min 24 s。
扫描结束后,将数据导入系统自带的新沟通MR图像专用后处理工作站(Syngo Multimodality Workplace,MMWP,版本号Syngo MR B17),对MRS进行波谱后处理和分析:完成图像滤过重建、零填充、相位和基线校正,将波谱原始数据转化为标准谱线,并进行分析得出水峰峰高(4.70 ppm)、脂质峰高[-(CH2)n-,1.30 ppm]。计算骨髓脂质分数(marrow fat fraction,FF),FF=Ifat/(Ifat+Iwater)]×100%,FF表示脂质相对信号强度振幅与总信号强度振幅(水与脂质)的百分比],式中Ifat、Iwater分别指脂质和水峰值。MRS测量的精确性用CV,FF测量的重复性CV为2.29%。
统计学方法根据BMD值将研究对象分为正常骨量组、低骨量组及OP组,对连续性资料采用均值±标准差(x±s)进行统计描述。在校正年龄、绝经年数、BMI后,采用协方差分析探讨FF在不同骨密度组之间是否存在差异;多重比较采用 Bonferroni法对P值法进行矫正。偏相关分析用来分析校正年龄、绝经年数、BMI后FF值与BMD之间的相关性。采用统计分析软件SAS 9.4进行统计分析,P<0.05 为差异有统计学意义。
结果 受试者一般资料表1为正常骨量组、低骨量组及OP组受试者年龄、绝经年龄、身高、体质量、BMI等一般资料情况。年龄、绝经年龄、身高、体质量、BMI在组间比较,差异无统计学意义(P>0.05)。
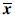 ±s)
Table 1 Baseline characteristics of the subjects(
±s)
Table 1 Baseline characteristics of the subjects(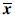 ±s)
±s)
| 组别 | 年龄(岁) | 绝经年龄(岁) | 身高(cm) | 体质量(kg) | BMI(kg/m2) |
| 正常骨量组(n=18) | 60.28±6.96 | 11.22±7.17 | 154.09±6.72 | 56.67±6.40 | 23.88±2.5 |
| 低骨量组(n=13) | 62.77±3.72 | 13.00±4.65 | 157.12±4.31 | 56.85±7.10 | 23.02±2.85 |
| OP组(n=11) | 60.73±3.85 | 11.64±4.63 | 156.95±5.80 | 53.32±5.59 | 21.60±2.03 |
| OP:骨质疏松;BMI:体质量指数 | |||||
正常骨量组、低骨量组及OP组FF及BMD值见表2。方差分析显示,3组间BMD值及FF值差异有统计学意义(F=10.18,P=0.000)。协方差分析调整年龄、绝经年龄及BMI混杂因素后,3组间BMD值差异有统计学意义,将BMD值加以校正,FF组间差异有统计学意义(F=4.14,P=0.005)。采用Bonferroni校正P值,只有正常骨量组与OP组比较,差异有统计学意义(P<0.05)(表3)。各组受试者代表性MRS谱线图见图1(受试者均63岁左右)。
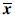 ±s)
Table 2 Comparison of BMD and FF among different
bone mass groups(
±s)
Table 2 Comparison of BMD and FF among different
bone mass groups(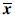 ±s)
±s)
| 组别 | BMD(g/cm2) | FF(%) |
| 正常骨量组(n=18) | 1.17±0.13* | 51.28±11.03* |
| 低骨量组(n=13) | 0.92±0.07 | 59.73±10.09 |
| OP组(n=11) | 0.83±0.05 | 69.96±11.42 |
| BMD数据经年龄、绝经年龄及BMI校正,FF经年龄、绝经年龄及BMI及BMD校正; BMD:骨密度;BMI:体质量指数;FF:脂肪分数; 正常骨量组与OP组比较,*P<0.05 | ||
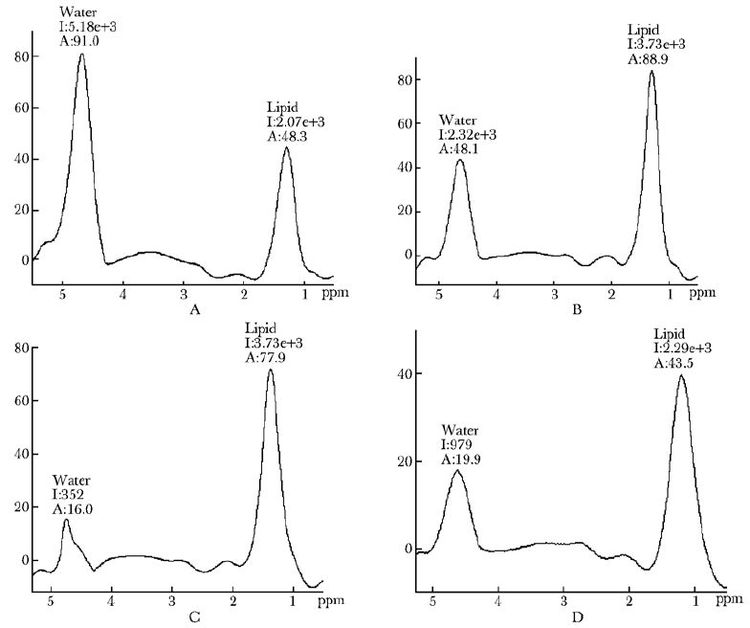
|
| 图1 代表性MRS谱线图 Fig.1 Typical magnetic resonance spectroscopy graphics A:正常骨量组代表; B:低骨量组代表;C:OP组代表;D:BMD与FF相反者代表;OP:骨质疏松; BMD:骨密度; FF:脂肪分数 |
FF与BMD存在中度负相关性(r=-0.557,P=0.000),校正年龄、绝经年龄、BMI混杂因素,其相关性依然存在(r=-0.510,P=0.001)。
讨论BMD是公认能反映骨强度的指标,也是目前用于预测OP性骨折的主要判断因子,但其敏感性和特异性不高[6]。有研究指出,仅用BMD测定值来预测骨折风险将有1/2以上OP性骨折患者被遗漏,特别是绝经后妇女尤其明显。因此,如何发现一个既变化出现较早,又能反映骨量变化/骨质疏松的有效检测方法成为研究的重点,而磁共振波谱则应运而生。磁共振波谱是一种能对生物活体组织代谢、生化环境以及化合物进行无创的定量分析方法,这是借助化合物之间的频率差别的检测技术。过去,对OP的发病机制研究大部分是集中在骨代谢上的,近年来,随着对干细胞研究的深入,骨髓脂肪与骨代谢以及正常造血干细胞之间的交互作用在探索中逐渐显露。
OP组的FF值明显比低骨量组以及正常骨量组高,在矫正年龄和绝经时间、BMI因素后,差异仍有统计学意义(P<0.05)(表1)。在此基础上,探讨FF值对于OP的评估价值,表明FF值判断OP具有一定的准确性,这为MRS应用于OP的临床判断奠定一定基础。
以往研究者在MRS对受试者腰椎骨髓脂肪分数做评估时,以受试者年龄[2]分组、或以性别[3]为分组,研究不同分组FF值的差异性,以探索FF值与OP及其脆性骨折的相关性,雌激素锐减是绝经后骨质疏松的重要原因,早已有研究表明雌激素能通过多个环节影响骨骼的生长和重构,在骨髓间充质干细胞分化时,雌激素通过多种信号通路刺激它向成骨细胞分化,从而促进骨基质的形成,本研究则基于此,着点于绝经后女性的正常骨量组、低骨量组、OP组的差异性与相关性,将性别、未绝经等因素排除。
本研究结果显示,椎体FF值与BMD呈负相关性(r=-0.510),此结果与已有文献报道相似[2, 3, 4, 5],就骨髓脂肪含量同BMD的相关性而言,Griffith等[2]探讨了绝经后女性腰椎骨髓脂肪分数与骨密度T值的相关性,结果两者呈负相关(r=-0.356,P<0.01),李冠武等[5]对31例绝经后女性分为OP组和非OP组的研究显示结果两者呈负相关(r=-0.527,P=0.002)。上述文献中,相关性均比本研究低或者相似,笔者认为这是本研究在分组上与国际上对OP的分组一致,并对年龄、绝经状态、BMI等因素进行校正,这将提高FF与BMD相关性。
国内外研究表明低骨量的发生伴随着骨髓脂肪含量的增多。OP时,骨髓脂肪含量增加对骨强度的弱化作用可能的原因有[7, 8, 9]:(1)骨髓脂肪细胞含量增加,其中饱和脂类增多而不饱和脂类减低,饱和脂肪酸对成骨细胞表现出毒性作用,因而骨形成受损,骨脆性增加;(2)在密闭的骨髓腔内,脂肪细胞增多必然压迫骨微循环血管,使血流量减少,从而导致骨营养不良;(3)脂肪细胞分泌的生长因子和内分泌细胞因子会影响成骨细胞和破骨细胞,抑制成骨细胞分化,增强破骨细胞作用;(4)成骨细胞和脂肪细胞都源于骨髓间充质干细胞,有研究表明骨髓间充质干细胞在向脂肪细胞和成骨细胞分化时存在负相关性,OP时成骨细胞数量及活性都在下降,脂肪细胞同时增多,并促进了成骨细胞的凋亡。MRS不仅能通过半定量测量骨髓脂肪含量,而且骨髓脂肪指标变化可早于骨量的变化,这对于OP及其脆性骨折的发生有积极意义。本研究在国内外研究的基础上,通过对46~73岁绝经后女性的FF值及其BMD分析,为MRS应用于OP早期临床干预及预测脆性骨折提供依据。本研究中骨髓脂肪分数FF值与BMD存在负相关性,这与以往的研究具有一致性,进一步验证了成骨细胞与骨髓脂肪细胞之间具有“ 此消彼长”的关系,印证了OP时骨髓脂肪细胞的增多必然伴随着成骨细胞减少的分子机制。
本研究尚存在一些不足之处:(1)各组研究样本量偏少且跨度较大,与脆性骨折相关性需要长时间的随访验证;(2)按DXA检测要求BMD为L1-4椎体测量均值,而MRS则仅对L3椎体进行采集,并不能完整地代表所有椎体骨髓情况,两者数据采集对象并不完全一致。针对这一缺点,以后可以采用MRI水-脂肪分离评估椎体脂肪含量,该技术可对L1-4同时进行测量。
MRS作为一种无创性的影像学检测方式,应用于OP脆性骨折风险预测已经有初步成果,但仍不全面,在未来的研究中,可以考虑加入其他检测方式以增加其评估的可信度,如加入血液骨代谢指标的检测等。其次,MRS通过检查骨髓间水和脂肪含量的变化,了解患者骨髓的生理及病理变化,这是否可以动态评价干预治疗OP的治疗效果也是一个待探索的领域。总之,MRS如何在OP中的量化评估及对OP治疗效果的动态评估将可能是未来的一个研究方向。
| [1] | Sànchez-Riera L,Carnahan E,Vos T,et al. The global burden attributable to low bone mineral density[J]. Ann Rheum Dis,2014,73:1635-1645. |
| [2] | Griffith JF,Yeung DK,Antonio GE,et al. Vertebral marrow fat content anddiffusion and perfusion indexes in women with varying bone density[J].Radiology,2006,241:831-838. |
| [3] | Shen W,Chen J,Gantz M,et al. MRI-measured pelvic bone marrow adipose tissue is inversely related to DXA-measured bone mineral in younger and older adults[J]. Eur J Clin Nutr,2012,66:983-988. |
| [4] | Griffith JF,Yeung DK,Ma HT,et al. Bone marrow fat content in the elderly:a reversal of sex difference seen in younger subjects[J]. J Magn Reson Imaging,2012,36:225-230. |
| [5] | 李冠武,常时新,鲍虹,等. 骨髓脂肪含量预测骨质疏松性椎体骨折价值的初步应用[J]. 实用放射学杂志,2012,28:74-77. |
| [6] | Manenti G,Capuani S,Fanucci E,et al. Diffusion tensor imaging and magnetic resonance spectroscopy assessment of cancellous bone quality in femoral neck of healthy,osteopenic and osteoporotic subjects at 3T:preliminary experience[J]. Bone,2013,55:7-15. |
| [7] | Gunaratnam K,Vidal C,Boadle R,et al. Gunaratnam K,Vidal C,Boadle R,et al. Mechanisms of palmitate-induced cell death in human osteoblasts[J]. Biol Open,2013,2:1382-1389. |
| [8] | Case N,Thomas J,Xie Z,et al. Mechanical input restrains PPAR gamma 2 expression and action to preserve mesenchymal stem cell multipotentiality[J]. Bone,2013,52:454-464. |
| [9] | Li GW,Tang GY,Liu Y,et al. MR spectroscopy and micro-CT in evaluation of osteoporosis model in rabbits:comparison with histopathology[J]. Eur Radiol,2012,22:923-929. |
| (收稿日期:2015-08-25) |

