2. 272029 济宁,济宁医学院附属医院内分泌科
2. Department of Endocrinology, The Affiliated Hospital, Jining Medical University, Jining 272029, China
动脉钙化是普遍存在于冠心病、糖尿病、慢性肾脏疾病等疾病中的病理现象[1],其细胞学基础是血管平滑肌细胞(vascular smooth muscle cells,VSMCs)的成骨样分化[2]。研究表明,在动脉钙化的过程中,VSMCs分泌大量的骨相关蛋白如碱性磷酸酶(alkaline phosphatase,ALP)、骨钙素(osteocalcin,OCN)、Runt相关转录因子2(Runt related transcription factor 2,Runx2) 和骨形成蛋白-2(bone morphology protein-2,BMP-2) 等而具有成骨细胞的表型[3-4],其确切的机制尚不完全明确。动脉钙化是急性心肌梗死、脑梗死、截肢等发生的独立危险因素。因此,研究动脉钙化的治疗和干预措施具有重要意义。
长链非编码RNA(long non-coding RNA,IncRNA)是近年来发现的、长度超过200个碱基的RNA,该类RNA不编码蛋白,但能够在转录及转录后水平调节蛋白编码基因的表达。研究表明,IncRNA在生长发育、细胞定向分化、亚细胞结构分布、进化选择等方面发挥了重要的调控作用[5]。抗分化非编码RNA(anti-differentiation non-coding RNA,ANCR)是一种包含855个碱基的IncRNA。Kretz等[6]发现ANCR的表达缺失可诱导表皮细胞中分化相关基因的大量表达,从而导致表皮细胞的分化。Zhu等[7]发现ANCR在人成骨细胞分化时的表达显著下降,ANCR可通过募集增强子zeste homolog 2而抑制Runx2的表达,最终抑制人骨细胞的分化。Jia等[8]发现,下调ANCR的表达可以促进牙髓组织干细胞向成骨细胞、脂肪细胞和神经细胞分化。基于以上的研究,可以认为ANCR具有抑制细胞分化的作用。那么ANCR是否也可以影响VSMCs成骨样分化的过程,目前尚不清楚。本研究利用β-GP干预小鼠VSMCs建立动脉钙化的细胞模型,构建ANCR过表达慢病毒载体并感染小鼠VSMCs,探讨ANCR过表达对VSMCs成骨样分化的抑制作用。
材料和方法细胞与主要试剂
小鼠原代VSMCs购于江苏齐氏生物科技有限公司,转染增强剂Polybrene和Ehanced Infecction Solution均购于上海吉凯基因化学技术有限公司,β-GP、茜素红染料均购于美国Sigma公司,胎牛血清(fatal bovine serum,FBS)、DMEM/F12(1:1) 培养基均购于美国Gibco公司,青霉素-链霉素购于美国Genview公司,0.25%胰酶(含EDTA)购于美国Gibco公司,6孔板、细胞培养瓶均购于美国Labserve公司,All-in-One® First-Strand cDNA合成试剂盒和All-in-One® qPCR试剂盒均购于广州复能基因有限公司,小鼠抗小鼠Runt相关转录因子2(Runt related transcription factor 2,Runx2)、骨形成蛋白-2(bone morphology protein-2,BMP-2),核转录因子-kappa B(nuclear factor kappa B,NF-κB) p65抗体均购于美国Abcam公司,HRP标记的山羊抗兔、山羊抗小鼠二抗购于北京中杉金桥生物技术有限公司,小鼠β-actin、Runx2、BMP-2、ANCR引物(引物序列见表 1)均购于生工生物工程(上海)股份有限公司,胞质及核蛋白提取试剂盒购于江苏碧云天生物技术有限公司,ECL化学发光液购于美国Millipore公司。
| 名称 | 引物序列(5′→3′) | |
| Runx2 | 上游引物 | CCGGTCTCCTTCCAGGAT |
| 下游引物 | GGGAACTGCTGTGGCTTC | |
| BMP-2 | 上游引物 | AGCTGCAAGAGACACCCTTT |
| 下游引物 | CATGCCTTAGGGATTTTGGA | |
| ANCR | 上游引物 | GCCACTATGTAGCGGGTTTC |
| 下游引物 | ACCTGCGCTAAGAACTGAGG | |
| β-actin | 上游引物 | TGGCACCCAGCACAATGAA |
| 下游引物 | CTAAGTCATAGTCCGCCTAGAAGCA | |
| Runx2:Runt相关转录因子2;BMP-2:骨形成蛋白-2;ANCR:抗分化非编码RNA | ||
方法
动脉钙化细胞模型的建立:参照笔者以往的研究[9],应用10 mmol/L β-GP干预小鼠的VSMCs建立动脉钙化的细胞模型。小鼠原代VSMCs按5×105/孔接种到6孔板中,加入DMEM/F12(1:1) 完全培养基(含L-谷酰胺、10% FBS、100 U/mL的青霉素和100 μg/mL的链霉素)进行培养,给予10 mmol/L β-GP作为干预。分别在培养第3、6、9、12天收集细胞,qPCR检测Runx2和BMP-2的表达,以验证动脉钙化的细胞模型构建成功;同时qPCR检测ANCR的表达。
慢病毒感染:ANCR过表达慢病毒由上海吉凯基因化学技术有限公司构建,过程简要如下:ANCR过表达的质粒和病毒包装辅助质粒共转染293T细胞,收集细胞上清,收获病毒,离心浓缩,去除杂质,将病毒浓缩与纯化,得到浓度为5×108 TU/mL的慢病毒。得到慢病毒后,将小鼠VSMCs以5×105/孔接种到6孔板中,每孔加入2 mL的DMEM/F12(1:1) 完全培养基进行培养。参照预实验的结果,设定MOI值为100[10]。VSMCs接种12 h后,以Eri.S+5 μg/mL Polybrene为感染条件进行感染,分为2组:阴性病毒组、阳性病毒组,每组设3个平行,48~72 h后观察荧光与细胞状态(图 1)。qPCR检测阴性病毒组和阳性病毒组ANCR的表达情况,以证明感染有效。将实验分为4组,空白组、β-GP组、阴性病毒+β-GP组、阳性病毒+β-GP组,按照相应的组别将不同的细胞按照5×105/孔接种到6孔板中,DMEM/F12(1:1) 完全培养基培养,12 h后,空白组继续DMEM/F12(1:1) 完全培养基培养,β-GP组、阴性病毒+β-GP组、阳性病毒+β-GP组分别在DMEM/F12(1:1) 完全培养基的基础上给予10 mmol/L β-GP干预。干预96 h后收集细胞,qPCR检测Runx2和BMP-2 mRNA的表达,Western blot法检测Runx2、BMP-2和NF-κB p65蛋白的表达;干预21 d后,茜素红染色观察矿化结节的形成。
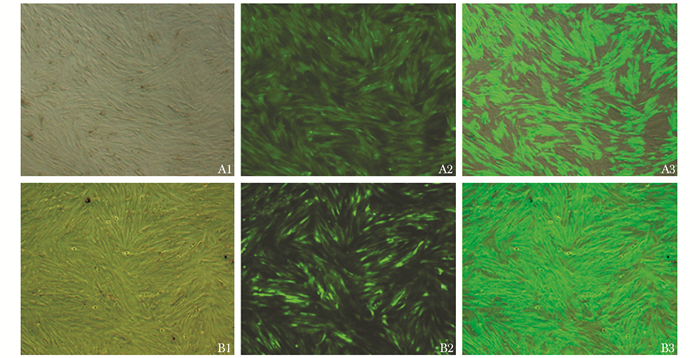
|
| 图 1 慢病毒感染小鼠VSMCs后明视野、荧光和合并后照片(×50) Figure 1 Photos of lentivirus infect VSMCs of mouse (×50) A1:小鼠VSMCs感染阴性病毒后明视野;A2:小鼠VSMCs感染阴性病毒后荧光照片;A3:小鼠VSMCs感染阴性病毒后明视野与荧光合并照片;B1:小鼠VSMCs感染阳性病毒后明视野;B2:小鼠VSMCs感染阳性病毒后荧光照片;B3:小鼠VSMCs感染阳性病毒后明视野与荧光合并照片 |
qPCR:使用Trizol(Life Technology,美国)提取细胞总RNA,取1 μg总RNA,利用All-in-One® First-Strand cDNA合成试剂盒,以25 μL的体系进行反转录,获得相应的cDNA。配制20 μL的实时定量PCR反应体系,每反应管加入cDNA模版2 μL、2×All-in-One® qPCR Mix 10 μL和ROX Reference Dye 0.2 μL,引物终浓度0.2 μmol/L。PCR循环反应条件:95 ℃预变性10 min,95 ℃ 10 s,60 ℃ 20 s,40个循环。Ct值为每个反应管内荧光信号到达设定域值所经历的循环数,用2-△△Ct法计算基因的相对表达水平。
Western blot法检测:待VSMCs干预完毕后,弃去6孔板中的完全培养基,室温下PBS冲洗两次,加入适当体积的胞质/核蛋白提取裂解液(含蛋白酶抑制剂),冰上静置20~30 min(中间间断混匀几次),收集细胞悬液,4 ℃,12 000 r/min,5 min,收集上清于EP管中,使用BCA蛋白浓度测定试剂盒测定蛋白样品的浓度,根据测定的样品的浓度,计算各样品中的总蛋白量,并向各样品中加入相应体积5×loading bufffer混匀,在100 ℃下变性5 min,统一各样品的浓度,-80 ℃保存备用。取20 μg变性蛋白,经10% SDS-PAGE电泳分离后,转印到0.2 μm的PVDF膜上;室温下5%的脱脂奶粉中封闭1 h,用PBS-T(含0.1%的TWEEN-20) 洗涤3次,加入稀释的小鼠抗小鼠Runx2(1:500)、小鼠抗小鼠BMP-2(1:500) 和兔抗小鼠NF-κB p65(1:400) 一抗,4 ℃孵育过夜;PBS-T洗涤3次,分别加入1:2 000稀释的HRP标记的山羊抗小鼠和山羊抗兔的二抗,室温摇床孵育1 h,PBS-T洗3次,PBS洗1次,加入ECL化学发光液(A液:B液=1:1),胶片曝光适当时间后显影、定影,观察条带。
茜素红染色:干预结束后PBS洗涤3遍,使用95%乙醇常温固定10 min,再次用PBS洗涤3遍,加入1%的茜素红,37 ℃温箱孵育1 h,PBS洗涤3遍,显微镜下观察矿化结节的形成,Image J软件进行分析。
统计学方法
实验数据用均数±标准差(x±s)表示,采用SPSS 20.0统计软件统计处理,组间比较应用单因素方差分析。以P<0.05为差异有统计学意义。
结果β-GP刺激VSMCs后对Runx2、BMP-2和ANCR mRNA表达的影响
qPCR结果显示,与空白组相比,在干预第3、6、9及12天,β-GP组Runx2和BMP-2 mRNA水平均显著升高,差异具有统计学意义(P<0.05);ANCR mRNA水平显著降低,差异具有统计学意义(P<0.05)(图 2)。
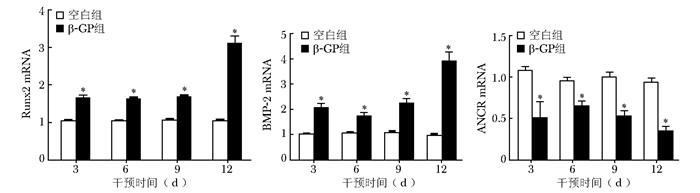
|
| 图 2 β-GP对小鼠VSMCs中Runx2、BMP-2和ANCR mRNA的表达影响 Figure 2 Effect of β-GP stimulating VSMCs of mouse on the expression of Runx2, BMP-2, and ANCR mRNA Runx2:Runt相关转录因子2;BMP-2:骨形成蛋白-2;ANCR:抗分化非编码RNA;与空白组比较,*P<0.05 |
ANCR过表达慢病毒感染VSMCs后对Runx2、BMP-2和ANCR mRNA表达的影响
qPCR结果显示,阴性病毒组和空白组相比,ANCR的表达差异无统计学意义(P>0.05);与空白组和阴性病毒组相比,阳性病毒组ANCR的表达显著升高,差异有统计学意义(P<0.05),证明感染有效(图 3)。与空白组相比,β-GP组、阴性病毒+β-GP组Runx2、BMP-2 mRNA显著升高,差异有统计学意义(P<0.05);与β-GP组相比,阴性病毒+β-GP组Runx2、BMP-2 mRNA水平差异无统计学意义(P>0.05);与β-GP组和阴性病毒+β-GP组相比,阳性病毒+β-GP组Runx2、BMP-2 mRNA水平显著降低,差异具有统计学意义(P<0.05)(图 4)。
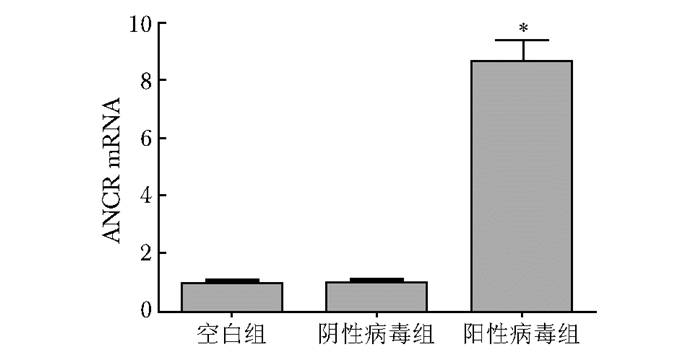
|
| 图 3 ANCR过表达慢病毒感染小鼠VSMCs后各组ANCR mRNA相对表达结果 Figure 3 Effect of lentivirus infecting VSMCs of mouse on the expression of ANCR mRNA ANCR:抗分化非编码RNA;与空白组和阴性病毒组比较,*P<0.05 |
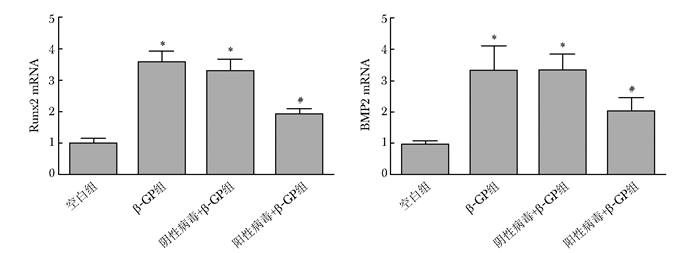
|
| 图 4 ANCR过表达慢病毒感染小鼠VSMCs后对Runx2和BMP-2 mRNA表达的影响 Figure 4 Effect of lentivirus infecting VSMCs of mouse on the expression of Runx2 and BMP-2 mRNA ANCR:抗分化非编码RNA; VSMCs:血管平滑肌细胞; Runx2:Runt相关转录因子2;BMP-2:骨形成蛋白-2;与空白组比较,*P<0.05;与β-GP、阴性病毒+β-GP组比较,#P<0.05 |
ANCR过表达慢病毒感染VSMCs后对矿化结节形成的影响
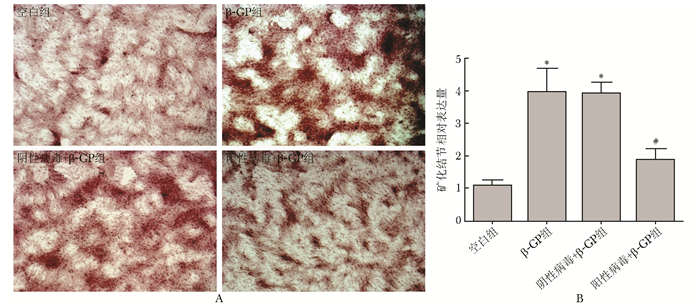
β-GP刺激VSMCs后,能形成明显的矿化结节。而ANCR过表达慢病毒感染VSMCs后,与空白组相比,β-GP组、阴性病毒+β-GP组有典型的钙化结节形成,差异具有统计学意义(P<0.05);与β-GP组、阴性病毒+β-GP组相比,阳性病毒+β-GP钙化结节的形成显著减少,差异具有统计学意义(P<0.05)(图 5)。
|
| 图 5 ANCR过表达慢病毒感染小鼠血管平滑肌细胞后对矿化结节形成的影响 Figure 5 Effect of lentivirus infecting VSMCs of mouse on the expression of matrix mineralization of different groups A:ANCR过表达慢病毒感染小鼠血管平滑肌细胞后行茜素红染色显微镜下图片;B:ANCR过表达慢病毒感染小鼠血管平滑肌细胞后行茜素红染色定量分析结果; ANCR:抗分化非编码RNA;VSMCs:血管平滑肌细胞; 与空白组比较,*P<0.05;与β-GP、阴性病毒组比较,#P<0.05 |
ANCR对VSMCs中NF-κB信号通路的影响
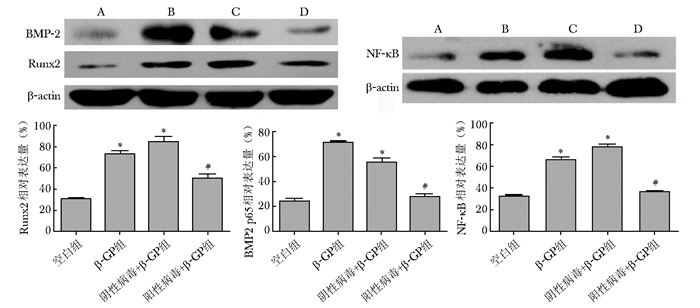
Western blot检测结果显示, 与空白组相比较,β-GP组和阴性病毒+β-GP组Runx2、BMP-2和NF-κB p65的蛋白水平表达显著增加,差异具有统计学意义(P<0.05);与β-GP组、阴性病毒+β-GP组相比,阳性病毒+β-GP组Runx2、BMP-2和NF-κB p65的蛋白水平表达显著降低,差异具有统计学意义(P<0.05)(图 6)。
|
| 图 6 ANCR过表达慢病毒感染小鼠血管平滑肌细胞后对Runx2、BMP-2和NF-κB p65蛋白相对表达量的影响 Figure 6 Effect of lentivirus infecting VSMCs of mouse on the expression of β-actin, Runx2, BMP-2, and NF-κB p65 A:空白组;B:β-GP组;C:阴性病毒+β-GP组;D:阴性病毒+β-GP组;ANCR:抗分化非编码RNA; VSMCs:血管平滑肌细胞; Runx2:Runt相关转录因子2; BMP-2:骨形成蛋白-2;NF-kappa B:核转录因子-kappa B;与空白组比较,*P<0.05;与β-GP、阴性病毒组比较,#P<0.05 |
传统观点认为动脉钙化是“被动的”磷酸钙结晶沉积,是机体衰老的一种表现;而现在的研究表明,动脉钙化是类似于骨形成的一种主动调节过程,它受一些激素和细胞因子的调控[11]。本研究首次证明lncRNA-ANCR在动脉钙化中发挥了重要的负性调控作用。
动脉钙化的发生是VSMCs进行成骨样分化的过程。在此过程中,VSMCs中Runx2、BMP-2、细胞核因子-κB受体活化因子配基(RANKL)、ALP、OCN等[12-15]成骨细胞标志性分子的表达显著升高,并形成类似于成骨过程中的基质小泡,聚集钙离子,形成钙化中心,进而形成钙化结节[16]。在本研究中,β-GP刺激后的小鼠VSMCs中Runx2、BMP-2的表达显著升高并伴有矿化结节的形成,证明动脉钙化的细胞模型建立成功。为了探讨ANCR是否参与了动脉钙化的发病过程,以β-GP刺激VSMCs,分别在3、6、9、12 d检测ANCR的表达,结果显示ANCR在上述不同时间点的表达较对照组均显著下降,提示ANCR与动脉钙化的发病有关。为了进一步明确ANCR在动脉钙化中的作用,构建了ANCR过表达慢病毒并感染了小鼠VSMCs,qPCR的结果显示,阳性病毒感染后的小鼠VSMCs中ANCR的表达是显著升高的,证明ANCR过表达慢病毒感染有效。进一步的qPCR和Western blot均证明,ANCR过表达可显著降低β-GP刺激的小鼠VSMCs中Runx2、BMP-2的表达,提示ANCR可抑制VSMCs的成骨样分化;进一步的茜素红染色证明了ANCR过表达可显著抑制β-GP刺激的小鼠VSMCs中矿化结节的形成。本研究结果证明,ANCR是动脉钙化发生过程中的关键性抑制因子。
NF-κB是Rel家族的转录因子,哺乳动物细胞中有5种NF-κBRel:RelA(P65)、RelB、C-Rel、P50、P52,它们通过形成同源或异源二聚体以启动不同的基因转录。NF-κB参与了包括炎症、脂质代谢、肿瘤、自身免疫等多种疾病的发生、发展过程[17]。目前已经证实,NF-κB与动脉钙化的发生密切相关[18-19],抑制NF-κB信号通路可削弱动脉钙化的进程。最常见的NF-κB是由p50和p65组成的异源二聚体,在静息状态下NF-κB在胞质中存在,当受到刺激因子活化后NF-κB的p65亚基会发生核内转位,因此细胞核内NF-κB p65的表达水平是反映NF-κB信号通路活化水平的重要标志。NF-κB复合物进入核内,并参与增殖、凋亡和血管生成相关的基因的表达并激活其转录。本研究为了探讨ANCR调控VSMCs成骨样分化的可能机制,检测了ANCR过表达的VSMCs核内NF-κB p65的表达。结果显示,ANCR过表达可以显著减少β-GP刺激后的小鼠VSMCs中NF-κB的活化水平。本研究结果显示:ANCR过表达的小鼠VSMCs中NF-κB的活化水平下降伴随着Runx2和BMP-2表达的下降,同时ANCR过表达的小鼠VSMCs中矿化结节显著减少。本研究结果提示:ANCR通过抑制NF-κB的活化水平而降低小鼠VSMCs中Runx2和BMP-2的表达并最终抑制小鼠VSMCs的成骨样分化。Feng等[20]研究发现,TNF-α可以通过NF-κB信号通路上调Runx2和BMP-2的表达而促进人牙髓干细胞的成骨样分化。本研究结果与该研究发现一致,即NF-κB调控Runx2和BMP-2的表达是成骨样分化这一进程中的重要事件。然而,Hou等[21]利用大鼠VSMCs建立动脉钙化细胞模型,发现姜黄素抑制VSMCs成骨样分化的作用与NF-κB信号通路无关。笔者认为产生这一差异的原因有两个:(1) 不同种属间成骨样分化调控的具体机制可能不同;(2) 在小鼠VSMCs成骨样分化的过程中,Runx2和BMP-2可能受多个信号通路的调控,ANCR过表达可通过抑制NF-κB的活化而下调Runx2和BMP-2的表达。其具体的分子机制尚需进一步研究。
综上所述,本研究成功构建了动脉钙化细胞模型并证明ANCR可能是动脉钙化中的关键性负性调节因子;ANCR可能通过削弱NF-κB信号通路抑制β-GP刺激的小鼠VSMCs成骨样分化,但是ANCR抑制NF-κB的具体机制仍不明确。ANCR能否作为治疗动脉钙化的新靶点,尚需进一步的研究。
| [1] | Johnson RC, Leopold JA, Loscalzo J. Vascular calcification:pathobiological mechanisms and clinical implications[J]. Circ Res, 2006, 99: 1044–1059. DOI:10.1161/01.RES.0000249379.55535.21 |
| [2] | Demer LL, Tintut Y. Vascular calcification:pathobiology of a multifaceted disease[J]. Circulation, 2008, 117: 2938–2948. DOI:10.1161/CIRCULATIONAHA.107.743161 |
| [3] | 王雪鹏, 李茂强, 边振宇, 等. PI3K/Akt信号通路在骨髓间充质干细胞增殖及成骨分化调控中的作用[J]. 中华骨质疏松和骨矿盐疾病杂志, 2014, 3: 250–257. DOI:10.3969/j.issn.1674-2591.2014.03.011 |
| [4] | Steitz SA, Speer MY, Curinga G, et al. Smooth muscle cell phenotypic transition associated with calcification:upregulation of Cbfa1 and downregulation of smooth muscle lineage markers[J]. Circ Res, 2001, 89: 1147–1154. DOI:10.1161/hh2401.101070 |
| [5] | Guttman M, Rinn JL. Modular regulatory principles of large non-coding RNAs[J]. Nature, 2012, 482: 339–346. DOI:10.1038/nature10887 |
| [6] | Kretz M, Webster DE, Flockhart RJ, et al. Suppression of progenitor differentiation requires the long noncoding RNA ANCR[J]. Genes Dev, 2012, 26: 338–343. DOI:10.1101/gad.182121.111 |
| [7] | Zhu L, Xu PC. Downregulated LncRNA-ANCR promotes osteoblast differentiation by targeting EZH2 and regulating Runx2 expression[J]. Biochem Biophys Res Commun, 2013, 432: 612–617. DOI:10.1016/j.bbrc.2013.02.036 |
| [8] | Jia Q, Chen X, Jiang W, et al. The regulatory effects of long noncoding RNA-ANCR on dental tissue-derived stem cells[J]. Stem Cells Int, 2016, 2016: 3146805. |
| [9] | Liang QH, Jiang Y, Zhu X, et al. Ghrelin attenuates the osteoblastic differentiation of vascular smooth muscle cells through the ERK pathway[J]. PLoS One, 2012, 7: e33126. DOI:10.1371/journal.pone.0033126 |
| [10] | 张燕燕, 李亭伟, 王莎莎, 等. 慢病毒载体感染人主动脉血管平滑肌细胞的效率[J]. 济南大学学报:自然科学版, 2016, 30: 190–194. |
| [11] | Demer LL. Cholesterol in vascular and valvular calcification[J]. Circulation, 2001, 104: 1881–1883. |
| [12] | 覃春美, 魏晓, 龚财判, 等. 血管钙化大鼠肾动脉BMP2/Smad1/Runx2信号通路的表达[J]. 四川大学学报:医学版, 2016, 47: 180–183. |
| [13] | Li M, Wu P, Shao J, et al. Losartan inhibits vascular calcification by suppressing the BMP2 and Runx2 expression in rats in vivo[J]. Cardiovasc Toxicol, 2016, 16: 172–181. DOI:10.1007/s12012-015-9326-y |
| [14] | Zhao YG, Meng FX, Li BW, et al. Gelatinases promote calcification of vascular smooth muscle cells by up-regulating bone morphogenetic protein-2[J]. Biochem Biophys Res Commun, 2016, 470: 287–293. DOI:10.1016/j.bbrc.2016.01.067 |
| [15] | Nie B, Zhou SQ, Fang X, et al. The function and meaning of receptor activator of NF-kappaB ligand in arterial calcification[J]. J Huazhong Univ Sci Technolog Med Sci, 2015, 35: 666–671. DOI:10.1007/s11596-015-1487-1 |
| [16] | Wu M, Rementer C, Giachelli CM. Vascular calcification:an update on mechanisms and challenges in treatment[J]. Calcif Tissue Int, 2013, 93: 365–373. DOI:10.1007/s00223-013-9712-z |
| [17] | Mitchell S, Vargas J, Hoffmann A. Signaling via the NFkappaB system[J]. Wiley Interdiscip Rev Syst Biol Med, 2016, 8: 227–241. DOI:10.1002/wsbm.2016.8.issue-3 |
| [18] | Kageyama A, Matsui H, Ohta M, et al. Palmitic acid induces osteoblastic differentiation invascular smooth muscle cells through ACSL3 and NF-kappaB, novel targets of eicosapentaenoic acid[J]. PLoS One, 2013, 8: e68197. DOI:10.1371/journal.pone.0068197 |
| [19] | Freise C, Kim KY, Querfeld U. A lindera obtusiloba extract blocks calcium-/phosphate-induced transdifferentiation and calcification of vascular smooth muscle cells and interferes with matrix metalloproteinase-2 and metalloproteinase-9 and NF-kappaB[J]. Evid Based Complement Alternat Med, 2015, 2015: 679238. |
| [20] | Feng X, Feng G, Xing J, et al. TNF-alpha triggers osteogenic differentiation of human dental pulp stem cells via the NF-kappaB signalling pathway[J]. Cell Biol Int, 2013, 37: 1267–1275. DOI:10.1002/cbin.v37.12 |
| [21] | Hou M, Song Y, Li Z, et al. Curcumin attenuates osteogenic differentiation and calcification of rat vascular smooth muscle cells[J]. Mol Cell Biochem, 2016, 420: 151–160. DOI:10.1007/s11010-016-2778-y |
| (收稿日期:2016-11-24) |

