2. 200241 上海,华东师范大学体育与健康学院
2. School of Physical Education and Health, East China Normal University, Shanghai 200241, China
长期以来,骨重塑一直被视为由内分泌和旁分泌调控主导的过程。近年来,神经元信号调控对骨骼质量调节的重要性有了更多认识[1],发现骨骼内环境稳态也受到中枢和外周神经的控制,由此提出了一种新的神经系统—骨骼联系,并于20世纪80年代首次描述为神经成骨网络主题的概念[2]。研究表明,骨代谢受到中枢介导的神经元通路的直接控制,感觉和自主神经纤维均支配骨组织,包括肾上腺素(epinephrine, E)、去甲肾上腺素(noradrenaline, NE)、物质P(substance P, SP)、降钙素基因相关肽(calcitonin gene-related peptide, CGRP)、血管活性肠肽(vasoac-tive intestinal peptide, VIP)和神经肽Y(neuropeptide Y, NPY)在内的许多神经递质和神经肽的存在,从而支持脑和骨之间的直接信号传导系统[3]。其中最为重要的一类为NPY系统,同时也作为治疗骨质疏松、提高骨修复的潜在靶点。NPY是具有骨稳态调节功能的神经递质,并与靶器官上的特异性受体结合调节骨代谢,在骨组织中通过成骨细胞表面的Y1起作用;在下丘脑中的Y2通过交感神经介导,最终调节骨代谢[4]。运动作为一种最常见的干预手段,在改善成骨细胞活性,调节下丘脑分泌中都具有显著的效果,而运动如何对NPY进行调控,如何影响其受体的表达,尚未见相关报道,本文通过对现有研究进行综合述评,探讨运动对NPY及其相关受体的影响,以期为运动改善骨代谢提供新的思路。
NPY和NPY受体NPY是一种广泛分布于哺乳动物体内的神经肽物质,于1982年从猪脑中首次分离出来,神经肽Y家族(NPY family)包括3个成员:NPY、肽YY(peptide YY, PYY)和胰多肽(pancreatic polypeptide, PP),均由36个氨基酸多肽和1个羧基酰胺组成,NPY与PYY(70%)和PP(50%)具有高度的序列特性[5]。NPY作为一种重要的促食欲因子,位于人体染色体的7p15.1位点,由3个内含子和4个外显子构成[6],相对分子质量为4 200。由中枢神经系统(central nervous system, CNS)和外围神经系统(peripheral nervous system, PNS)的神经元产生,并广泛存在于交感神经纤维和副交感神经纤维内。在CNS中,NPY存在于下丘脑、大脑皮质、脑干、纹状体和边缘结构等区域中,在下丘脑弓状核的表达量最高,尤其是在弓状核和下丘脑腹内侧以及一些非神经元位点具有高表达水平[7]。在PNS的交感神经系统中,当出现神经刺激时,NPY会与NE共同储存并共同释放。有趣的是,骨骼中的成骨细胞以及脂肪细胞也都可产生NPY[1, 8]。下丘脑中NPY对调节外周成骨细胞和破骨细胞活性具有重要作用,NPY敲除小鼠中观察到增加的成骨细胞活性,而对NPY敲除小鼠的下丘脑中进行补充NPY却不会出现原有的正常骨代谢水平。对野生型小鼠脑室内注射NPY,又会导致松质骨体积显著减少;同时还发现,下丘脑中NPY过表达现象,不仅会降低矿物结合速率,还可降低成骨细胞活性高达7倍之多,尤以皮质骨和松质骨表面的变化显著;相反的是,种系NPY敲除小鼠显示骨量增加,成骨细胞活性升高[1],说明过量的NPY对骨骼起到负性调控作用。
NPY作为保守型神经肽,对饮食摄入、能量平衡、血管和免疫功能、痛觉和压力反应等进行严格的调控[9]。其发挥生物学功能的主要原因是与其相应的受体结合。Y受体(Y receptors)亚型是7跨膜受体结合抑制G蛋白,NPY通过G蛋白偶联受体(G protein coupled receptors, GPCRs)发挥作用,其受体主要包括:Y1、Y2、Y4、Y5和Y6共5种,且每个受体在CNS和PNS的分布不同,其受体参与的生理调节功能也各有千秋[6, 9, 10-12](表 1),已有研究显示,Y受体信号传导通过诱导细胞外调节激酶(extracellular signal-regulated kinase, ERK)的磷酸化刺激丝裂原活化的蛋白激酶(mitogen-activated protein kinase, MAPK)途径[3]。在5个已知的Y受体中,Y2敲除小鼠出现骨合成代谢反应,Y4敲除小鼠却无明显的骨代谢性变化,由此揭示不同Y受体对骨形成的特异性控制。NPY通过受体相互作用直接调节骨细胞活性,其中Y1和Y2对小鼠骨量的影响尤为重要。研究显示,Y1和Y2是调控骨稳态的关键因素,可维持骨形成和骨动态的平衡过程[13]。
| 受体 | 生理过程 |
| Y1 | 心血管调节作用;神经内分泌调节;神经形成;骨内稳态;焦虑与沮丧行为的调控;惊厥控制;血管生成;免疫系统调控;能量代谢 |
| Y2 | 骨内稳态;焦虑调控;心血管调节作用;能量代谢 |
| Y4 | 心血管调节作用;饮食调控;能量代谢 |
| Y5 | 惊厥控制;血管生成;能量代谢 |
| Y6 | 能量代谢 |
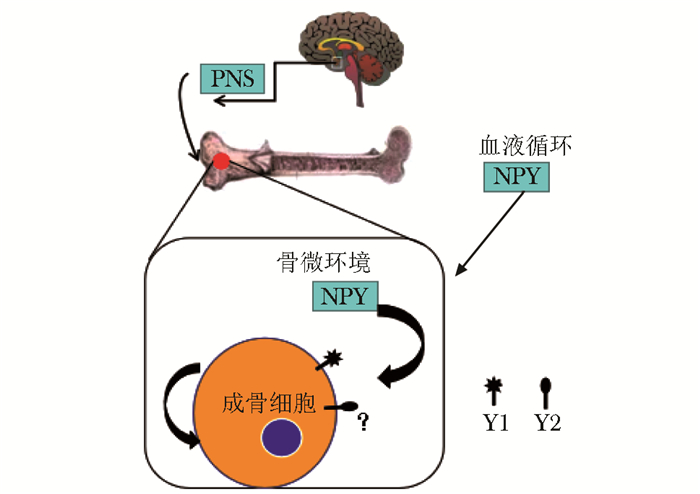
早期研究表明,NPY免疫反应阳性纤维存在于骨组织中,包括骨膜和骨髓中的细胞,尤其是血管壁相关的组织,对于改善骨中血管具有相关调节作用,而不是骨细胞活性的变化[14],随后证实NPY与骨膜和骨衬细胞代谢有关[7],在NPY治疗成骨细胞系中,NPY可抑制环磷酸腺苷(cyclic adenosine monophosphate, cAMP)对甲状旁腺素(parathyroid hormone, PTH)的反应,与NPY对其他系统中cAMP的抑制作用一致,揭示了NPY通过与骨细胞上的Y受体结合,进而调节成骨细胞活性的可能机制。在骨组织中,高水平的NPY持续不断地降低成骨细胞活性;相反,NPY表达减弱或受体信号丢失,在皮质骨和松质骨中可增加成骨细胞的活动和骨质量。成骨细胞Y1和中枢Y2具有相似的抑制骨形成功能[1]。NPY及其受体在体内调节成骨细胞和破骨细胞水平,进一步支持骨重建的稳态性质,以及神经肽Y中Y1和Y2作为“骨骼神经调节器”的功能[15]。关于骨中的Y受体的研究指出,Y1在人成骨细胞和人骨肉瘤来源的细胞系中表达,另一项研究报道小鼠的Y1在骨髓细胞中表达[16-17]。说明Y1可通过下丘脑改变骨细胞的表达,骨细胞自身也可分泌NPY对Y1进行调节;而条件性敲除Y2可引起骨量升高,关于Y2的表达只可来自于下丘脑的分泌,换言之,NPY通过下丘脑中Y2进行骨量调节[9]。NPY存在于成骨细胞,骨细胞和破骨细胞中[1]。鉴于成骨细胞中Y1的存在,外周NPY以旁分泌/自分泌的方式在骨细胞中起作用。此外,在成骨细胞和骨细胞中,骨骼中不存在NPY和Y2之间的表达,表明NPY系统通过双分泌效果对Y1起作用,NPY通过单一分泌刺激对Y2起作用,进而直接刺激成骨细胞的代谢作用(图 1)。
NPY还会通过调节小鼠骨髓细胞的cAMP、护骨素(osteoprogerin, OPG)和NF-κB受体活化因子配体(receptor for activation of nuclear factor kappa B ligand, RANKL)表达,直接作用于破骨细胞,调节骨吸收[4],多数研究者认为,NPY是抑制骨吸收。小鼠口服Y1拮抗剂后出现骨量增加,骨显微观察发现成骨细胞活性显著提高,但骨吸收也有所增加[18]。尽管种系Y1-/-小鼠破骨细胞数量无变化,但破骨细胞表现出增加的趋势。Y1抑制小鼠骨髓细胞中异丙肾上腺素和PTH诱导破骨细胞的发生,异丙肾上腺素和PTH通过cAMP /蛋白激酶A(protein kinase, PKA)途径,刺激骨髓基质细胞上的β-肾上腺素受体,引发RANKL产生,抑制破骨细胞分化。独立NPY不影响破骨细胞的形成,也不影响不同信号途径转导的或可溶性RANKL诱导的破骨细胞形成。在体外研究中,短时间内的NPY直接抑制成骨细胞的RANKL表达。表明NPY治疗骨髓间充质干细胞(bone mesenchymal stem cells, BMSCs)可导致OPG表达的瞬时增加,抑制RANKL激活破骨细胞发生的诱饵受体,也说明NPY对骨吸收调节的作用,至少部分地由成骨细胞行为改变介导[3-4]。
Y1对骨代谢的调节据报道,Y1存在于人成骨细胞和骨肉瘤来源的细胞系和小鼠骨髓细胞中。虽然研究没有检测到原代鼠成骨细胞培养物或长骨中的Y受体转录物,但在野生型小鼠培养的基质细胞中证实了Y1的存在,而不是其他Y受体(Y2、Y4、Y5和Y6)。Y1位于染色体4q31.3-32上,通过PCR mRNA分析和免疫组织化学测定法等方法对Y1进行定位,发现Y1在多种组织和器官中分布[6]。Y1在CNS中被广泛表达,其中下丘脑的室旁核(paraudio videoentricular nuclei, PVN)浓度最高,Y1在中枢Y2和骨细胞之间存在神经介导的连接,Y1缺失会出现骨量上调和骨形成增加现象[7]。同时Y1也可在CNS以外的骨髓基质细胞和骨组织细胞中进行表达,条件性敲除下丘脑中的Y1,其中的骨内稳态并未改变。种系Y1缺乏,引起成骨细胞活性广泛的升高,导致更多的皮质骨和松质骨积累。与下丘脑特异性Y2的合成代谢作用相反,PVN中Y1缺失不会改变骨内稳态。骨骼变化中,下丘脑Y1对种系Y1缺失无重要作用[1];Y1-/-小鼠的骨量增加是骨转换改变的结果,其中成骨细胞和破骨细胞指数均有所增加,说明Y1的中心机制存在于骨中。此外,成骨细胞的Y1可直接参与种系Y2敲除小鼠的骨合成代谢表型的发展。在没有中枢神经输入的情况下,从Y2敲除小鼠分离出的骨髓基质干细胞培养,显示骨祖细胞数量增加和骨组织矿化水平提高[19]。这些均说明Y1具有骨细胞自身分泌的效果,NPY通过Y1对骨细胞的直接作用。
Y2对骨代谢的调节Y2是由中央调控路径到骨,Y2在下丘脑、海马和脑干等区域表达,占NPY结合率的2/3左右,弓状核的80% NPY同时表达Y2,是CNS中最丰富的Y受体[20]。在外周组织中,Y2在白色和棕色脂肪组织、肝脏、肌肉、脾脏和肠道以及支配大肠和小肠的结节神经节神经元上表达,但在成骨细胞中不表达[19]。Y2敲除会引起成骨细胞活性升高,骨量上调;而与Y2缺陷小鼠相比,Y4缺失和PP配体的Y4过表达在转基因小鼠中不影响骨量[15],均说明Y2可抑制骨形成。与野生型小鼠相比,Y2-/-小鼠远端股骨的骨小梁体积、厚度和数量显着增加相关[21]。Y2-/-模型评估骨骼活动发现,Y2-/-小鼠远端股骨显示高出野生型小鼠2倍的松质骨体积和骨形成速率,除了破骨细胞数量的适度升高外,骨吸收参数基本不变,骨整体向成骨扩增的方向发展[7]。由于Y2不被成骨细胞表达,并且下丘脑特异性Y2缺失小鼠与种系缺失的小鼠显示相同的骨合成代谢表型,Y2缺失导致的合成代谢不是通过骨转换特性,而是通过神经机制介导。体外培养Y2-/-下的BMSCs分析显示,骨祖细胞数量增加[2]。而在野生型BMSCs中检测到Y1的表达,其他受体均未表达,所以Y2被认为是负责NPY在下丘脑控制骨量中的关键因子,而不是由于外周通路[22]。
Y2不会由成骨细胞表达初步得到共识,而针对来自小鼠颅盖骨的MC3T3-E1成骨细胞研究中发现,在成骨细胞分化条件下发生Y2 mRNA表达,除了通过下丘脑Y2的骨形成中心控制外,发现了Y2的存在,如果进一步证明成骨细胞中存在Y2,NPY系统的骨稳态调节的复杂性将进一步提高[2]。而对于绝经后的雌激素缺乏,导致破骨细胞增生和松质骨损失的重塑失调现象,研究指出下丘脑Y2介导的成骨细胞骨形成反应与性类固醇信号传导无关。在雄性和雌性小鼠中,Y2的特异性可抑制性腺切除术引起的骨丢失,这为治疗骨质疏松症提供了新的途径[3]。
NPY与骨修复探讨NPY在骨修复中的作用逐渐成为研究的热点。已有研究发现,植入感觉神经能够明显修复骨缺损,骨再生区域中SP、CGRP和NPY含量明显增加[23]。骨修复过程主要分为:血肿和炎性反应;软骨愈伤组织形成;硬质愈伤组织形成;骨重塑期。在骨折初始阶段NPY升高,参与骨折血肿炎性反应和骨痂形成;在炎性反应期,NPY可通过免疫细胞包括:白细胞、抗原呈递细胞和巨噬细胞的受体起作用[24];NPY在骨折愈合的整个过程呈升高趋势,对骨折中晚期对骨重塑的调节更为显著[25]。NPY有助于改善脑-骨折联合损伤患者的骨愈合,其中联合损伤患者的NPY水平升高,直接刺激间充质干细胞(mesenchymal stem cells, MSCs),促进其向成骨分化[22]。在骨折情况下,愈合组织中NPY阳性纤维的数量增加;Y1和Y2在炎性反应期,Y1表达在骨和DRG神经元中触发,Y1缺失显示骨修复过程延迟现象;而在骨化阶段,Y2反应仅限于下丘脑中[9]。对C57BL/6小鼠构建骨缺损模型,在骨愈合评估中发现,在术后第1天的股骨缺损小鼠中,NPY mRNA的表达比假手术小鼠高2.5倍,Y1 mRNA的表达在前3 d比假手术小鼠高2倍,且在骨骼中未检查到Y2 mRNA的表达。在骨微环境中,Y1调节巨噬细胞、树突状细胞和T细胞活性,同时调节炎性细胞的运输。由于在假手术小鼠中没有观察到相似现象,结果表明NPY系统对骨损伤具有特异性的响应,并且在炎性反应中发挥作用[9],及NPY-Y1系统参与到骨修复的骨化过程中。
运动对NPY介导的骨代谢干预运动可提高神经系统敏感性和下丘脑生理功能,改变NPY水平及其基因表达,对患有自主神经功能障碍的Ⅰ型糖尿病患者进行运动干预,可显著提高E、NE和NPY水平[26],但由于位置的不同,其相对的表达量也各不一致,下丘脑的NPY变化中发现,有氧运动后,大鼠的弓状核NPY基因表达和蛋白水平明显下降,大强度的自由跑轮运动,下丘脑NPY水平显著升高;在外周血浆中,一次性运动后,肥胖大鼠各时间段血浆NPY显著下降,中等强度运动可抑制NPY的分泌,长时间大强度会刺激NPY分泌[27-28]。由于下丘脑NPY内分泌量受到运动强度的干预,从而进一步打破原有的骨重建平衡状态,提高成骨细胞活性,并相对性抑制破骨细胞活性。研究显示,骨重建涉及时间、空间和数量上的紧密平衡,对骨骼进行的机械作用(包括体质量变化),可能在协调骨重塑中起重要作用,对同一区域的骨组织,成骨细胞需要3个月来重建,而破骨细胞只需要2~3周[3]。而NPY在整体水平还是细胞水平,都是抑制骨形成,在低强度、中等强度和高强度运动下,NPY mRNA的表达水平各不相同[29]。目前的研究中,运动对NPY在血管、神经、肌肉和胰腺中的探讨相对较多,运动通过NPY调节cAMP、OPG和RANKL的表达量,虽没有直接的研究报道指出,但根据已有运动的介导,推测认为,长期运动会削弱NPY在骨组织中的水平,提高OPG、RANKL的表达,抑制NF-κB受体活化因子(receptor for activation of nuclear factor kappa B, RANK)水平,使得骨代谢向成骨细胞生成,关于运动对骨中Y1和Y2的表达调节,认为NPY通过Y1和Y2的下调,改善骨转换,使骨量上调和骨形成增加,但其中具体的含量表达变化仍需要进一步验证。
展望关于NPY的讨论,主要集中于能量代谢环节,也有少部分关注于情绪情感行为、焦虑和压力应对等方面。虽然现有的研究支持NPY及其Y1和Y2对骨的调控作用,但仍然存在几个问题需要进一步探讨:(1)NPY及其受体对骨影响是否具有核心枢纽的功能。目前多是从骨的周围组织分析NPY及其受体的调控,包括肌肉、血管、脂肪组织和胰腺等,虽然也会间接性改善骨代谢,但其具体的机制尚不明确;(2)Y1和Y2生物学功能多样,包括肥胖控制、饮食摄入和肿瘤治疗等,现在已有研究者提出将Y1和Y2作为骨愈合和骨肿瘤等骨疾病的靶点,一个新的治疗靶点提出涉及到多个方面,如何更好的提高骨健康,同时减弱对其他机体组织的影响,仍然需要进一步的论证;(3)选择何种运动干预方式更为准确。NPY及其受体在多种组织的表达必然存在一个此消彼长的过程,运动的性质、强度、频率以及时间如何界定也需要大量的证实。明确上述问题将会有助于阐明NPY及Y受体对骨改善的机制研究,也为其指出药物靶点和非药物干预手段。
| [1] | Shi YC, Baldock PA. Central and peripheral mechanisms of the NPY system in the regulation of bone and adipose tissue[J]. Bone, 2012, 50: 430–436. DOI:10.1016/j.bone.2011.10.001 |
| [2] | Franquinho F, Liz MA, Nunes AF, et al. Neuro-peptide Y and osteoblast differentiation-the balance bet-ween the neuro-osteogenic network and local control[J]. FEBS J, 2010, 277: 3664–3674. DOI:10.1111/j.1742-4658.2010.07774.x |
| [3] | Lee NJ, Herzog H. NPY regulation of bone remodel-ling[J]. Neuropeptides, 2009, 43: 457–463. DOI:10.1016/j.npep.2009.08.006 |
| [4] | 于小奎, 朱兵. 神经肽Y对骨代谢调节的研究进展[J]. 中国骨质疏松杂志, 2013, 12: 1323–1326. |
| [5] | Larhammar D. Evolution of neuropeptide Y, peptide YY and pancreatic polypeptide[J]. Regul Peptides, 1996, 62: 1–11. DOI:10.1016/0167-0115(95)00169-7 |
| [6] | Sousa DM, Herzog H, Lamghari M. NPY signalling pathway in bone homeostasis:Y1 receptor as a potential drug target[J]. Curr Drug Targets, 2009, 10: 9–19. DOI:10.2174/138945009787122888 |
| [7] | Wong IP, Zengin A, Herzog H, et al. Central regulation of bone mass[J]. Semin Cell Dev Biol, 2008, 19: 452–458. DOI:10.1016/j.semcdb.2008.08.001 |
| [8] | Qi Y, Fu M, Herzog H. Y2 receptor signalling in NPY neurons controls bone formation and fasting induced feeding but not spontaneous feeding[J]. Neuropeptides, 2016, 55: 91–97. DOI:10.1016/j.npep.2015.09.009 |
| [9] | Alves CJ, Alencastre IS, Neto E, et al. Bone injury and repair trigger central and peripheral NPY neuronal pathways[J]. PLoS One, 2016, 11: 1–17. |
| [10] | 胡春燕, 李英文. 神经肽Y(NPY)的生理功能研究进展[J]. 生物学杂志, 2011, 28: 66–68. |
| [11] | Reichmann F, Holzer P. Neuropeptide Y:A stressful review[J]. Neuropeptides, 2016, 55: 99–109. DOI:10.1016/j.npep.2015.09.008 |
| [12] | Liu S, Jin D, Wu JQ, et al. Neuropeptide Y stimul-ates osteoblastic differentiation and VEGF expression of bone marrow mesenchymal stem cells related to canonical Wnt signaling activating in vitro[J]. Neuropeptides, 2016, 56: 105–113. DOI:10.1016/j.npep.2015.12.008 |
| [13] | Catak Z, Aydin S, Sahin I, et al. Regulatory neuropeptides (ghrelin, obestatin and nesfatin-1) levels in serum and reproductive tissues of female and male rats with fructose-induced metabolic syndrome[J]. Neuropeptides, 2014, 48: 167–177. DOI:10.1016/j.npep.2014.04.002 |
| [14] | Ahmed M, Bjurholm A, Kreicbergs A, et al. Neuropeptide Y, tyrosine hydroxylase and vasoactive intestinal polypeptide-immunoreactive nerve fibers in the vertebral bodies, discs, dura mater, and spinal ligaments of the rat lumbar spine[J]. Spine, 1993, 18: 268–273. DOI:10.1097/00007632-199302000-00016 |
| [15] | Elefteriou F. Regulation of bone remodeling by the central and peripheral nervous system[J]. Arch Biochem Bioph, 2008, 473: 231–236. DOI:10.1016/j.abb.2008.03.016 |
| [16] | Nakamura M, Sakanaka C, Aoki Y, et al. Identifica-tion of two isoforms of mouse neuropeptide Y-Y1 receptor generated by alternative splicing. Isolation, genomic structure, and functional expression of the receptors[J]. J Biol Chem, 1995, 270: 30102–30110. DOI:10.1074/jbc.270.50.30102 |
| [17] | Togari A, Arai M, Mizutani S, et al. Expression of mRNAs for neuropeptide receptors and beta-adrenergic receptors in human osteoblasts and human osteogenic sarcoma cells[J]. Neurosci Lett, 1997, 233: 125–128. DOI:10.1016/S0304-3940(97)00649-6 |
| [18] | Sousa DM, Baldock PA, Enriquez RF, et al. Neuropeptide Y Y1 receptor antagonism increases bone mass in mice[J]. Bone, 2012, 51: 8–16. DOI:10.1016/j.bone.2012.03.020 |
| [19] | Lundberg P, Allison SJ, Lee NJ, et al. Greater bone formation of Y2 knockout mice is associated with increased osteoprogenitor numbers and altered Y1 rece-ptor expression[J]. J Biol Chem, 2007, 282: 19082–19091. DOI:10.1074/jbc.M609629200 |
| [20] | Lin S, Boey D, Couzens M, et al. Compensatory changes in[125I]-PYY binding in Y receptor knockout mice suggest the potential existence of further Y receptor(s)[J]. Neuropeptides, 2005, 39: 21–28. DOI:10.1016/j.npep.2004.10.002 |
| [21] | Baldock PA, Sainsbury A, Couzens M, et al. Hypothalamic Y2 receptors regulate bone formation[J]. J Clin Invest, 2002, 109: 915–921. DOI:10.1172/JCI0214588 |
| [22] | Gu XC, Zhang X B, Hu B, et al. Neuropeptide Y accelerates post-fracture bone healing by promoting osteogenesis of mesenchymal stem cells[J]. Neuropep-tides, 2016, 60: 61–66. DOI:10.1016/j.npep.2016.09.005 |
| [23] | 邹振吕. 大鼠骨折愈合过程中神经肽SP、NYP及其受体NK1、NPYR1表达关系的初步研究[D]. 广州: 南方医科大学, 2015. |
| [24] | Schmidt-Bleek K, Schell H, Schulz N, et al. Inflammatory phase of bone healing initiates the regenerative healing cascade[J]. Cell Tissue Res, 2012, 347: 567–573. DOI:10.1007/s00441-011-1205-7 |
| [25] | Long H, Ahmed M, Ackermann P, et al. Neuropep-tide Y innervation during fracture healing and remodeling. A study of angulated tibial fractures in the rat.[J]. Acta Orthopaed, 2010, 81: 639–646. DOI:10.3109/17453674.2010.504609 |
| [26] | Sundkvist G, Bramnert M, Bergström B, et al. Plasma neuropeptide Y (NPY) and galanin before and during exercise in type 1 diabetic patients with autonomic dysfunction[J]. Diabetes Res Clin Pr, 1992, 15: 219–226. DOI:10.1016/0168-8227(92)90028-P |
| [27] | 田应池, 汪军, 胡爱武. 运动对肥胖大鼠血浆和下丘脑NPY蛋白及其基因表达的影响[J]. 北京体育大学学报, 2009, 1: 62–64. |
| [28] | 张丽红, 甘春龙, 衣雪洁. 神经肽Y与肥胖的关系及其在运动减肥中的应用[J]. 成都体育学院学报, 2008, 34: 72–76. |
| [29] | Han D, Kim S, Cho B. mRNA Expression on neuropeptide Y (NPY) to exercise intensity and recovery time[J]. J Phys Ther Sci, 2011, 23: 781–784. DOI:10.1589/jpts.23.781 |
| (收稿日期:2017-08-16) |