骨质疏松性椎体压缩性骨折 (osteoporotic vertebral compression fractures,OVCF) 是骨质疏松症最常见的并发症之一[1]。随着社会老龄化,骨质疏松症 (osteoporosis,OP) 的发病率逐年上升,OVCF发生率也随之增加。传统保守治疗OVCF往往不能改善椎体后凸畸形[2],且增加了卧床时间,肺部感染、褥疮、泌尿系感染、静脉血栓等并发症发生率较高,长期卧床进一步加重了骨量丢失,易出现新的OVCF[3]。自经皮椎体成形术 (percutaneous vertebroplasty,PVP)[4]及经皮椎体后凸成形术 (percutaneous kyphoplasty,PKP)[5]问世以来,这两种方法已成为治疗OVCF安全有效的手段,但骨水泥渗漏仍是PVP和PKP术中最常见的并发症之一。笔者回顾性研究2014年1月至2016年3月进行的311例PKP术,对其中渗漏情况进行统计分析。
对象与方法 对象对昆山市中医医院脊柱骨科2014年1月-2016年3月接受PKP治疗的311例OVCF患者进行回顾性研究,其中男性54例,女性257例,年龄48~91岁 (平均年龄68.5岁),单节段手术259例,双节段手术45例,三节段手术7例,共涉及370个椎体。所有患者术前均有不同程度的胸、腰背部疼痛,部位与影像学检查一致。所有患者术前均行X线片及MRI检查,部分行CT检查,术后均行X线片检查。术前生化检查未见明显手术禁忌证。
手术方法患者俯卧位,常规监护生命体征,C臂机透视下定位伤椎,以伤椎椎弓根体表投影的外上缘作为穿刺点标记,消毒铺巾。以1%利多卡因经皮肤直至椎弓根后侧逐层浸润麻醉,尖刀在标记点切一5 mm小口,将椎体穿刺针通过椎弓根插入椎体内,侧位透视下针尖达椎体后1/3处拔出针芯,穿入导针,建立好工作通道后拔出导针,丝攻攻入椎体前1/3部位后拔出,经工作通道送入球囊,注入碘海醇造影剂扩张球囊,恢复椎体高度,抽出造影剂,退出球囊,调配骨水泥,装入推杆内,将拉丝期骨水泥经推杆注入椎体,待骨水泥凝固后拔出工作通道。患者优先考虑双侧注射,如患者耐受性较差、注射节段多、穿刺困难则选择单侧注射。全程C臂机透视监测,术毕切口覆盖无菌敷料。
术后处理术毕观察患者生命体征稳定后,返回病房,卧床休息,常规予以抗骨质疏松治疗。次日允许患者佩戴腰围下地活动,术后3 d内行X线复查。
评价方法根据检查结果,将所有患者分成骨水泥渗漏组和无骨水泥渗漏组。收集两组患者性别、年龄、受伤至手术间隔时间、同时手术椎体数、伤椎部位、穿刺方式、骨水泥注入量等数据,分析可能影响骨水泥渗漏的因素。
统计学方法应用SPSS 23统计软件,计数资料采用χ2检验,计量资料以均数±标准差 (x±s) 表示,两组间比较采用t检验;采用单因素和多因素Logistic回归分析导致椎体成形术后骨水泥渗漏的危险因素,以P<0.05为差异有统计学意义。
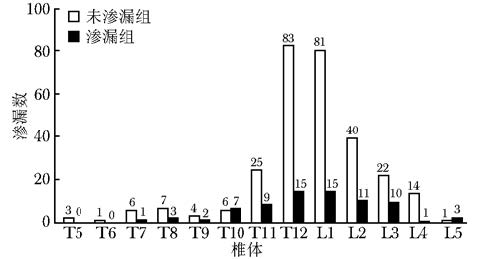
结果 一般情况311例患者手术椎体为370个,患者一般资料见表 1。370个椎体中骨水泥未渗漏293个 (79.2%),渗漏77个 (20.8%)(图 1)。77个出现骨水泥泥渗漏椎体中68个椎体为单处渗漏,9个椎体为两处渗漏,椎体渗漏按照Yeom分型C型 (图 2, 3)52个、Yeom B型 (图 4)9个、Yeom S型 (图 5)5个,椎弓根内 (针道)(图 6) 渗漏20个。所有患者均未出现因穿刺或骨水泥渗漏导致的神经症状,1例患者因肺气肿穿刺时出现气胸,术后出现胸闷、呼吸费力等症状,经保守治疗好转,其余患者未出现胸闷、心慌、气促、呼吸困难等症状。
| 组别 | 椎体数 | 性别 | 年龄 (岁) | 同时手术椎体数 | 部位 | 受伤至手术时间 (d) | 穿刺方式 | 骨水泥注 入量 (ml) | |||||||
| 男 | 女 | 单节 | 多节 | 胸椎 | 胸腰段 | 腰椎 | <15 | 15~60 | >60 | 单边 | 双边 | ||||
| 未渗漏组 | 293 | 54 | 239 | 70.06±7.86 | 206 | 87 | 27 | 229 | 37 | 205 | 65 | 23 | 77 | 216 | 4.04±0.98 |
| 渗漏组 | 77 | 14 | 63 | 68.44±8.57 | 55 | 22 | 13 | 50 | 14 | 48 | 18 | 11 | 32 | 45 | 4.55±0.94 |
| P | 0.960 | 0.154 | 0.847 | 0.094 | 0.757 | 0.009 | 0.000 | ||||||||
|
| 图 1 PKP术中椎体骨水泥渗漏椎体分布 Figure 1 Distribution of vertebrae with cement leakage in PKP PKP:经皮椎体后凸成形术 |
|
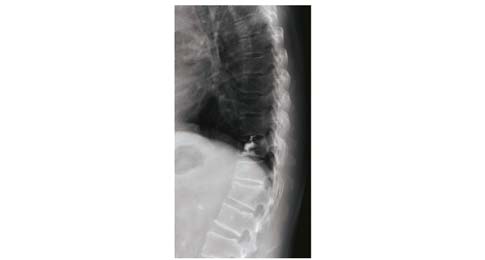
| 图 2 T10骨折Yeom C型渗漏 Figure 2 Bone cement leakage of Yeom type C in T10 with fracture 患者为64岁男性 |
|
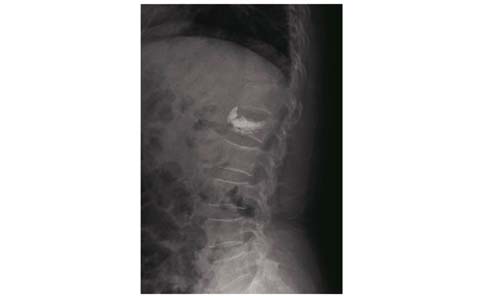
| 图 3 L1骨折Yeom C型渗漏 Figure 3 Bone cement leakage of Yeom type C in L1 with fracture 患者为78岁女性 |
|
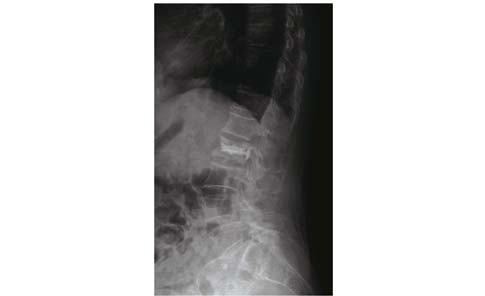
| 图 4 L2骨折Yeom B型渗漏 Figure 4 Bone cement leakage of Yeom type B in L2 with fracture 患者为76岁女性 |
|
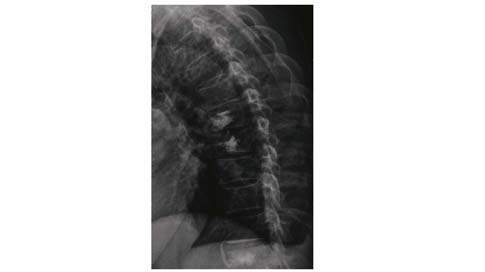
| 图 5 T12骨折Yeom S型渗漏 Figure 5 Bone cement leakage of Yeom type S in T12 with fracture 患者为61岁男性 |
|
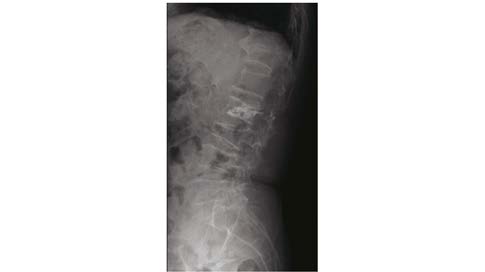
| 图 6 L2骨折椎弓根内渗漏 Figure 6 Bone cement leakage in vertebral pedicle in L2 with fracture 患者为70岁女性 |
性别、年龄、骨折部位、同时手术椎体数与骨水泥渗漏无相关性 (P>0.05),而穿刺方式、受伤至手术时间、骨水泥注入量与骨水泥渗漏有相关性 (P<0.05)(表 2)。
| 因素 | 回归系数 | 回归系数标准误 | χ2值 | 自由度 | P | OR | 95% CI |
| 年龄 | 0.022 | 0.015 | 2.152 | 1 | 0.143 | 1.022 | 0.993~1.052 |
| 性别 | 0.017 | 0.332 | 0.003 | 1 | 0.960 | 1.017 | 0.531~1.948 |
| 受伤至手术时间 | 0.010 | 0.004 | 6.953 | 1 | 0.014 | 1.010 | 1.002~1.018 |
| 同时手术椎体数 | 0.137 | 0.212 | 0.408 | 1 | 0.519 | 1.147 | 0.756~1.739 |
| 骨折部位 | 0.010 | 0.025 | 0.142 | 1 | 0.707 | 1.010 | 0.962~1.059 |
| 穿刺方式 | -0.691 | 0.267 | 6.545 | 1 | 0.010 | 0.501 | 0.297~0.845 |
| 骨水泥注入量 | -0.428 | 0.127 | 11.532 | 1 | 0.00 | 0.652 | 0.509~0.835 |
将单因素有相关性的几个因素进行多因素Logistic回归分析,结果显示骨水泥注入量与骨水泥渗漏相关 (P<0.05),而受伤至手术时间、穿刺方式与骨水泥渗漏无相关性 (P>0.05)(表 3)。
| 因素 | 回归系数 | 回归系数标准误 | χ2值 | 自由度 | P | OR | 95% CI |
| 受伤至手术时间 | 0.007 | 0.004 | 3.320 | 1 | 0.068 | 1.007 | 0.999~1.014 |
| 穿刺方式 | 0.111 | 0.446 | 0.061 | 1 | 0.804 | 1.117 | 0.466~2.676 |
| 骨水泥注入量 | -0.434 | 0.195 | 4.954 | 1 | 0.026 | 0.648 | 0.442~0.950 |
随着社会老龄化,OVCF发生率逐渐上升,往往给老年患者生活带来严重影响。PVP、PKP能让OVCF患者早期活动,减少并发症发生,已被临床广泛接受。
骨水泥渗漏是PVP、PKP中最常见的并发症之一[6],多为椎旁、椎间隙、椎管内、椎体周围静脉渗漏及远隔器官栓塞。Yeom等[7]根据骨水泥渗漏的部位将其分为3种类型:B型 (椎基底静脉渗漏), 骨水泥沿椎基底静脉渗漏到椎体后缘,硬膜的前方;C型 (骨皮质缺损渗漏),骨水泥沿病变椎体骨质皮质缺损渗漏,可发生在病变椎体周围的任何位置;S型 (节段静脉渗漏),骨水泥沿椎间静脉渗漏。椎体骨皮质破损者出现骨水泥渗漏的概率较高[8]。Hulme等[9]发现骨水泥渗漏在PVP中多发生在椎管及硬膜外区域,而PKP中多发生于椎间隙及椎体周围。骨水泥渗漏与椎体骨壁裂口呈明显相关性[10],由于OVCF椎体骨皮质存在骨折线,球囊的使用增大了OVCF椎体中的骨折裂缝,增加了椎间隙及椎体周围骨水泥渗漏的风险[3]。但总体来说PKP的渗漏率低于PVP[11],其原因可能是由于PKP中球囊扩张后形成的空腔,使得骨水泥注入时的压力较小[12]。而椎弓根内 (针道) 渗漏与医源性操作有关,均于推杆内骨水泥未完全推注入椎体时发生,与骨水泥凝固前未采取旋转推杆或更换空推杆有关。骨水泥注入量、骨水泥在椎体内填充百分比与临床止痛效果无直接关系[13],而骨水泥注入量与渗漏发生率呈正比[14],所以术中不必强求骨水泥充分填充。尽管大部分的骨水泥渗漏是无症状的,但是否存在长期影响目前仍不确定。有研究表明,椎间盘内骨水泥渗漏可能会对椎间盘或邻近椎体机械负荷造成影响[15],Lin等[16]随访报道椎间盘内骨水泥渗漏者邻近椎体再骨折率明显高于无渗漏者,也有动物实验研究表明,骨水泥渗漏至椎间隙会导致椎间盘退变加重,这会对于患者长期的疗效产生不良影响[17]。除此之外,骨水泥渗漏也会给患者造成下肢瘫痪、心肺栓塞等严重后果,甚至造成生命威胁,临床报道屡见不鲜[18-24]。
考虑到PKP渗漏率更小,除骨折压缩明显者及部分陈旧性骨折,笔者在临床治疗OVCF更倾向于选择PKP。本研究共有311例患者370个椎体,发生骨水泥渗漏73例77个椎体,渗漏率为20.8%,其中有68个椎体为单处渗漏,9个椎体为两处渗漏,渗漏部位从多到少依次为Yeom C型52个 (椎旁、椎前、椎间盘内)、Yeom B型9个 (椎管内)、Yeom S型5个 (椎前静脉、椎旁静脉),20个椎体出现椎弓根内 (针道) 渗漏,未出现远隔器官栓塞,所有渗漏均未造成患者明显不适症状,术中、术后未采取特殊措施处理骨水泥渗漏。单因素Logistic回归分析结果显示,性别、年龄、骨折部位、同时手术椎体数与骨水泥渗漏无相关性,而穿刺方式、受伤至手术时间、骨水泥注入量与骨水泥渗漏有相关性,将单因素有相关性的几个因素进行多因素Logistic回归分析,结果显示骨水泥注入量与骨水泥渗漏相关,而受伤至手术时间、穿刺方式与骨水泥渗漏无相关性。因缺乏完善的受伤椎体CT资料,本研究未能对椎体裂缝与骨水泥渗漏相关性进行验证。因此在本回顾性研究中,骨水泥注入量是影响OVCF骨水泥渗漏的主要因素。骨水泥注入越多,出现渗漏的概率越高,究其原因可能是骨水泥注入量增加后椎体内压力增大,一旦骨折存在裂缝,更容易出现渗漏。研究结果也显示单侧穿刺比双侧穿刺更容易出现骨水泥渗漏,其原因可能为单侧穿刺时穿刺点偏外、角度偏大,穿刺针破坏椎弓根内壁方面风险增加,同时为了使骨水泥尽可能填充于椎体中央,骨水泥注入较多,导致骨水泥更易于渗漏。也有可能双侧椎弓根入路能够将骨水泥更为均匀的注射入受伤椎体内,分两次注射降低了注射压力,减少了骨水泥渗漏风险[25]。
总结相关文献及以往经验,笔者认为可以采取以下预防措施有效防止骨水泥渗漏:(1) 术前完善CT及MRI等影像学检查,明确责任椎体,充分了解椎体的损伤情况,如发现骨皮质破损者操作须细致谨慎。(2) 清晰的术中影像必不可少,如术中显影不清,盲目穿刺,必然增加骨水泥渗漏的风险[26],一旦发生渗漏也可能无法清晰显示,对于严重骨质疏松者尤须重视,如借助术中CT则有助于减少骨水泥渗漏发生[23]。(3) 术前阅片了解待穿刺椎体椎弓根情况,注意椎弓根管径大小及走向,严格掌握穿刺技术,减少反复穿刺,尽量避免损伤椎弓根内侧壁,尤其是与椎体连接部位,如果穿刺靠内,在不穿破椎弓根内侧皮质前提下尽量少调整穿刺方向,避免骨水泥沿穿刺通道向椎管渗漏,因L1、L2椎体椎弓根直径小于其他椎体,L1、L2骨折行PKP操作须更细致;有研究表明PKP单侧穿刺与双侧穿刺在伤椎椎体前缘高度恢复效果、手术时间及术后腰痛视觉模拟评分 (visual analogue scale, VAS) 改善方面效果无明显差异,但脊柱生物力学平衡及避免邻近椎体再骨折方面,骨水泥双侧均匀填充有明显优势[27]。因此术中尽可能行双侧穿刺,如存在穿刺困难,单侧穿刺亦无不可。(4) 由于骨质疏松患者骨皮质薄,丝攻及导针如力量及深度控制欠佳易导致椎体前侧骨皮质破裂而出现骨水泥外渗,球囊扩张后,以细导针探查椎体前侧是否有破损,如有破损可以少量明胶海绵填塞。(5) 有研究表明高黏度骨水泥能有效降低骨水泥渗漏率[28-29],术前应充分了解不同厂家骨水泥的特性,选用熟悉的高黏度的骨水泥产品;注意骨水泥注入时间及注入量,对椎体皮质无破损者宜在湿砂期或拉丝早期推注,而对椎体皮质有破损者宜在拉丝后期或团状早期推注[30]。(6) 骨水泥推注时注意控制速度,常规每推注0.5 mL进行一次透视,如发现有渗漏迹象,建议每推注0.2 mL透视,一旦发现渗漏存在,如存在向椎管内渗漏倾向或骨水泥注入量已达1.5 mL及以上,即停止渗漏侧骨水泥注入,如骨水泥量不足1.5 mL,可待骨水泥进一步凝固后再行推注。(7) 骨水泥注入量、骨水泥在椎体内填充百分比与临床止痛效果无直接关系[13],无须刻意追求尽量多的骨水泥填充,一般胸椎3 mL以内,腰椎5 mL以内即可。(8) 骨水泥注入完成后,旋转推杆或替换空推注器置入通道可防止椎弓根内骨水泥尾巴的形成。
| [1] | Borgstrom F, Zethraeus N, Johnell O, et al. Costs andquality of life associated with osteoporosis-related fractures in Sweden[J]. Osteoporos Int, 2006, 17 : 637–650. DOI:10.1007/s00198-005-0015-8 |
| [2] | Rho YJ, Choe WJ, Chun YI. Risk factors predicting thenew symptomatic vertebral compression fractures after percutaneous vertebroplasty or kyphoplasty[J]. Eur Spine J, 2012, 21 : 905–911. DOI:10.1007/s00586-011-2099-5 |
| [3] | 张军, 左春光, 王新虎, 等. PKP治疗不同时期骨质疏松性椎体压缩骨折的结果比较[J]. 实用骨科杂志, 2013, 19 : 196–201. |
| [4] | Galibert P, Deramond H, Rosat P, et al. Preliminary note on the treatment of vertebral angioma by percutaneous acrylic vertebroplasty[J]. Neurochirurgie, 1987, 33(2) : 166–168. |
| [5] | Garfin SR, Lin G, Lieberman I, et al. Retrospective analysis of the outcomes of ballon kyphoplasty to treat vertebral body compression fracture refractory to medical management[J]. Eur Spine J, 2001, 10 : S7–S8. |
| [6] | Phillips FM, Todd WF, Lieberman I, et al. An in vivo comparison of the potential for extravertebral cement leak after vertebroplasty and kyphoplasty[J]. Spine, 2002, 27 : 173–178. |
| [7] | Yeom JS, Kim WJ, Choy WS, et al. Leakage of cement percutaneous transpedicular vertebroplasty for painful osteoporotic compression fractures[J]. J Bone Joint Surg Br, 2003, 85 : 83–89. DOI:10.1302/0301-620X.85B1.13026 |
| [8] | 郑毓嵩, 张勇, 林金, 等. 椎体成形术骨水泥渗漏的相关危险因素分析[J]. 中华创伤杂志, 2015, 31 : 312–316. |
| [9] | Hulme PA, Krebs J, Ferguson SJ, et al. Vertebroplasty and kyphoplasty:a systematic review of 69 clinical studies[J]. Spine, 2006, 31 : 1983–2001. DOI:10.1097/01.brs.0000229254.89952.6b |
| [10] | Nieuwenhuijse MJ, Van Erkel AR, Dijkstra PD. Cement leakage in percutaneous vertebroplasty for osteoporotic vertebral compression fractures:identification of risk factors[J]. Spine J, 2011, 11 : 839–848. DOI:10.1016/j.spinee.2011.07.027 |
| [11] | Taylor RS, Taylor RI, Fritzell P. Balloon kyphoplasty and vertebroplasty for vertebral compression fractures:a comparative systematic review of efficacy and safety[J]. Spine, 2006, 31 : 2747–2755. DOI:10.1097/01.brs.0000244639.71656.7d |
| [12] | McCall T, Cole C, Dailey A. Vertebroplasty and kyphoplasty:a comparative review of efficacy and adverse events[J]. Curr Rev Musculoskelet Med, 2008, 1 : 17–23. DOI:10.1007/s12178-007-9013-0 |
| [13] | 郑召民, 李佛保. 经皮椎体成形术和经皮椎体后凸成形术一问题与对策[J]. 中华医学杂志, 2006, 86 : 1878–1880. |
| [14] | Jin YJ, Yoon SH, Park KW, et al. The volumetric analysis of cement in vertebroplasty:relationship with clinical outcome and complications[J]. Spine, 2011, 36 : E76l–E772. |
| [15] | Guan HQ, Yang HL, Mei X, et al. Early or delayed operation, which is more optimal for kyphoplasty? A retrospective study on cement leakage during kyphoplasty[J]. Int J Care Injured, 2012, 43 : 1698–1703. DOI:10.1016/j.injury.2012.06.008 |
| [16] | Lin EP, Ekholm S, Hiwatashi A, et al. Vertebroplasty:cement leakage into thedisc increased the risk of new fracture of adjacent vertebral body[J]. Am J Neuroradiol, 2004, 25 : 175–180. |
| [17] | 倪才方, 赵辉, 陈珑, 等. 两种骨水泥渗漏对椎间盘影响的实验研究[J]. 中华骨科杂志, 2007, 4 : 263–267. |
| [18] | Matouk CC, Krings T, TerBrugge KG, et al. Cement embolization of a segmental artery after percutaneous vertebroplasty:a potentially catastrophic vascular complication[J]. Int Neuroradiol, 2012, 18 : 358–362. DOI:10.1177/159101991201800318 |
| [19] | Ina T, Ulrich G, Jürgen R, et al. First report of a life-threatening cardiac complication after percutaneous balloon kyphoplasty[J]. Spine (Phila Pa1976), 2013, 38 : E316–E318. DOI:10.1097/BRS.0b013e318281507a |
| [20] | Jun HY, Jong WK, Hyun OP, et al. Intracardiac foreign body (bone cement) after percutaneous vertebroplasty[J]. Korean J Thorac Cardiovasc Surg, 2013, 46 : 72–75. DOI:10.5090/kjtcs.2013.46.1.72 |
| [21] | Sean MB, Andrew DL, David AC. Sacral radiculopathy due to cement leakage from percutaneous sacroplasty, successfully treated with surgical decompression[J]. J Neurosurg:Spine, 2013, 3 : 1–5. |
| [22] | Gursukhman SS, Christopher KK, Katherine ES, et al. Neurological deficit due to cement extravasation following a vertebral augmentation procedure[J]. J Neurosurg:Spine, 2013, 5 : 1–10. |
| [23] | Julien P, Gabrielle WD, Emmanuel C, et al. Incidence of pulmonary cement embolism after real-time CT fluoroscopy-guided vertebroplasty[J]. J Vasc Interv Radiol, 2013, 24 : 1853–1860. DOI:10.1016/j.jvir.2013.05.048 |
| [24] | Bhide RP, Barman A, Varghese SM, et al. A rare presentation of subacute progressive ascending myelopathy secondary to cement leakage in percutaneous vertebroplasty[J]. Am J Phys Med Rehabil, 2014, 93 : 431–436. DOI:10.1097/PHM.0000000000000028 |
| [25] | 李菊根, 廖壮文, 范子文, 等. 单侧与双侧椎弓根入路椎体成形术治疗高龄骨质疏松性椎体压缩骨折的临床疗效比较[J]. 中国微创外科杂志, 2013, 13 : 531–533. |
| [26] | 史腾, 苏祥正, 周亮, 等. 经皮椎体成形术骨水泥渗漏相关因素分析[J]. 解放军医学院学报, 2014, 35 : 1093–1096. |
| [27] | 潘爱星, 杨晋才, 海涌, 等. 单侧与双侧穿刺经皮椎体后凸成形术治疗骨质疏松性椎体压缩骨折的对比研究[J]. 中国骨与关节杂志, 2016, 5 : 44–47. |
| [28] | Habib M, Serhan H, Marchek C, et al. Cement leakage and filling pattern study of low viscous vertebroplastic versus high viscous confidence cement[J]. SAS J, 2010, 4 : 26–33. DOI:10.1016/j.esas.2010.01.001 |
| [29] | Bhatia C, Barzilay Y, Krishna M, et al. Cement leakage in percutaneous vertebroplasty:effect of preinjection gelfoam embolization[J]. Spine (Phila Pa 1976), 2006, 31 : 915–919. DOI:10.1097/01.brs.0000209307.03930.38 |
| [30] | 刘洋, 李明辉, 梅红军. 经皮椎体成形术后骨水泥渗漏的回顾性分析及预防策略[J]. 中国骨质疏松杂志, 2013, 19 : 375–380. |
| (收稿日期:2016-08-18) |

