2. 212001 镇江,江苏大学附属医院骨科
2. Department of Orthopedics, the Affiliated Hospital of Jiangsu University, Zhenjiang 212001, Jiangsu, China
铁离子作为人体必需的微量元素,发挥着重要的生物学功能,如红细胞的正常功能、氧化代谢、免疫应答等都需要铁离子参与,因此机体内铁离子变化影响着机体的正常功能。当体内铁离子积聚过多即“铁过载”与铁缺乏均会对细胞、组织产生不利影响。
近年来,随着对铁代谢研究的不断深入,许多研究表明体内铁代谢与骨代谢有着密切联系,体内铁的动态平衡影响着骨代谢及骨矿化的过程,因此铁代谢异常也是导致骨代谢异常的因素之一[1-3]。成骨细胞是骨形成过程中的重要功能细胞,参与骨的修复与重建过程,由其分泌的钙结节和胶原纤维构成骨骼的力学基础。本实验以人成骨细胞 (hFOB1.19) 为研究平台,体外观察铁离子变化包括高铁环境三价铁离子供体枸橼酸铁铵 (ferric ammonium citrate,FAC) 和低铁环境铁离子螯合剂去铁胺 (deferoxamine,DFO) 对成骨细胞 (hFOB1.19) 功能活性的影响,在细胞水平探讨铁代谢与骨代谢之间的关系,为了解铁代谢异常引起的骨代谢异常提供部分实验依据。
材料与方法 主要材料、仪器FAC、DFO、hFOB1.19(购于中科院上海细胞库);DMEM (高糖)/F12(Gibco公司);新生胎牛血清 (FCS,杭州四季青);MTT (碧云天公司);碱性磷酸酶试剂盒 (南京建成公司);细胞凋亡试剂盒 (Invitrogen公司);酶标仪 (BioTek公司);流式细胞仪 (Becton Dickinson公司);PCR仪 (Finnzymes公司)。
实验方法成骨细胞培养:将hFOB1.19放于5% CO2 34 ℃培养箱内培养,细胞培养基为DMEM (高糖):F12=1:1,添加终浓度为10%的胎牛血清及终浓度为0.3% G418。
实验干预组:将不同浓度的FAC、DFO分别加入不同组细胞培养基内,细胞培养,换液时保持培养基内FAC或DFO的浓度不变;枸橼酸铁铵 (FAC) 组:50 μmol/L浓度组,100 μmol/L浓度组,200 μmol/L浓度组;去铁胺 (DFO) 组:5 μmol/L浓度组,10 μmol/L浓度组,20 μmol/L浓度组。实验对照组:细胞培养基内不加入FAC和DFO。
细胞增生检测:96孔板接种细胞,每孔2 000个,每组5孔,24 h后,更换为含不同浓度的FAC (50、100、200 μmol/L) 和DFO (5、10、20 μmol/L) 培养液,干预48 h后,加入MTT液 (5 mg/mL) 20 μL /孔,37 ℃孵育4 h,吸去孔内液体,加入DMSO液体150 μL/孔,振荡10 min,用酶标仪选择570 nm波长测定各孔吸光度值,其值与细胞数量成正比。
碱性磷酸酶活性测定:6孔板中每孔接种1×105/mL个hFOB1.19细胞。48 h后,更换为不同浓度的FAC培养液 (50、100、200 μmol/L) 的和DFO (5、10、20 μmol/L) 培养液。添加10%胎牛血清等体积培养基作为对照组。各为3复孔,继续培养至10 d时,各孔加75 μL裂解液,收集上清,-70 ℃冻存。用BCA试剂盒测总蛋白浓度,用Lab Assay ALP试剂盒测碱性磷酸酶 (alkaline phosphatase,ALP) 含量。用酶标仪选择520 nm波长测定各孔吸光度值 (A值),根据测得A值计算相对的ALP活性。
细胞凋亡检测:成骨细胞以105/mL接种于6孔培养板,加入含10%胎牛血清的DMEM/F12培养液培养。细胞贴壁生长后,换为含不同浓度的FAC (50、100、200 μmol/L) 和DFO (5、10、20 μmol/L) 培养液。继续培养48 h后,用0.25%胰蛋白酶消化并离心收集各组细胞。用预冷的PBS洗涤细胞2次,1×Binding Buffer重新悬浮细胞至1×106/mL;取100 μL细胞至5 mL管;加入5μL Annexin-Ⅴ-FITC和10 μL PI混匀;于室温避光孵育15 min;每管加入400μL 1×Binding Buffer,1 h内用流式细胞仪检测荧光强度。
钙结节检测:采用Von kossa钙化染色法。6孔板每孔接种1×105/mL hFOB1.19细胞。48 h后,更换为含不同浓度的FAC (50、100、200 μmol/L) 和DFO (5、10、20 μmol/L) 培养液。添加含10%胎牛血清等体积培养基作为对照组,各为3复孔。连续作用3 d后各孔细胞用Von kossa钙化液换液,隔天1次,第19天换液2 d后终止培养,Von kossa钙化染色法进行染色。HP I AS2 100高清晰度彩色病理图文报告分析系统计算各样本的钙化面积百分比。
总RNA提取:采用RNAgents Total RNA Isolation System试剂盒提取人成骨细胞总RNA,并用无RNA酶水溶解,取出少量稀释后经紫外分光光度计测定其浓度和纯度,根据测定值调整RNA标本浓度为1 g/L。
RT-PCR:取0.2 mL PCR管,按下列次序加入以下试剂:Nuclease-free water 30 μL、AMV/Tfl 5×Reaction Buffer 10 μL、dNTPs 1、Upstream premium 1 μL、Downstream premium 1 μL、25% MgSO4 2 μL、Amv-reverse transcriptase 1 μL、Tfl DNA poly-merase 1 μL、RNA sample 3 μL,总反应体系为50 μL。引物根据Genebank与Primer 3设计,由上海生工合成,引物序列见表 1。
| 基因 | 引物序列 (5′→3′) | 产物大小 (bp) |
| COL1 | GATGCCAATGTGGTTCGTG | 104 |
| TTCTTGCGGCTGCCCTCT | ||
| BGP | AGGGCAGCGAGGTAGTG | 150 |
| GGCAGCGAGGTAGTGAAGAG | ||
| β-actin | TCCTGTGGCATCCACGAAACT | |
| GAAGCATTTGCGGTGGACGAT | 306 | |
| COL1:Ⅰ型胶原;BGP:骨钙素 | ||
PCR产物鉴定和分析:取PCR扩增产物8 μL和上样缓冲液2 μL点样于1.5%琼脂糖凝胶,100 V电压下电泳0.5 h,于紫外线箱中观察并照相记录。实验重复3次,用Image J图像分析软件对目的基因和参照基因条带吸光度值进行分析。
Western blotting法和非变性凝胶电泳法检测:参照Santa Cruz公司蛋白提取方法,干预人成骨细胞3 d后,收集细胞用RIPA裂解液裂解成骨细胞提取总蛋白,用改良的Lowary法测定蛋白浓度,取细胞蛋白样品50 g上样于6%的非变性凝胶,经电泳分离后,电转移至PVDF膜,封闭后,分别加入一抗COL1(工作浓度1:5 000),辣根过氧化物酶结合的二抗 (工作浓度1:500),37 ℃温育显色。扫描后用Image J图像分析软件对目的基因灰度值进行灰度分析。
统计学方法用SPSS15.0统计软件进行统计分析,实验所得数据用均数±标准差 (x±s) 表示。采用单因素方差分析,方差齐性时用SNK方法进行统计分析,方差不齐性时用Dunnett's T3方法进行统计分析。以P < 0.05为差异有统计学意义。
结果 成骨细胞增生效应MTT法结果显示,FAC干预成骨细胞48 h后,A值随FAC浓度增加而降低,与对照组比较,各浓度组差异有统计学意义 (P < 0.05),该抑制作用具有浓度依赖性,当FAC在200 μmol/L时,对成骨细胞的抑制效应最显著 (P < 0.01)。DFO干预成骨细胞48 h后,与对照组比较,A值在5 μmol/L浓度时升高 (P < 0.05),之后随DFO浓度增加而降低 (P < 0.05),去铁胺在5 μmol/L浓度时对成骨细胞增生有促进作用 (P < 0.05),而在10、20 μmol/L浓度时却抑制成骨细胞增生 (图 1)。
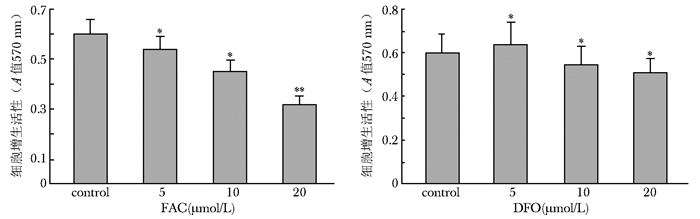
|
| 图 1 不同浓度FAC、DFO对hFOB1.19细胞增活性的影响 Figure 1 Effects of various concentration of FAC and DFO on proliferation of hFOB1.19 cells FAC:枸橼酸铁铵;DFO:去铁胺; 与对照组比较, *P < 0.05,**P < 0.01 |
FAC干预成骨细胞10 d时,与对照组相比,各浓度组差异有统计学意义 (P < 0.05),碱性磷酸酶活性随FAC干预浓度的增加而降低,且在200 μmol/L浓度时ALP活性最低 (P < 0.01)。DFO干预成骨细胞10 d时,碱性磷酸酶活性随DFO干预浓度的增加而升高,其中10 μmol/L浓度组与5 μmol/L浓度组比较,虽有升高但差异无统计学意义 (P > 0.05),20 μmol/L浓度组与对照组比较,ALP活性升高 (P < 0.05),但与5、10 μmol/L浓度组比较ALP活性却降低 (图 2)。
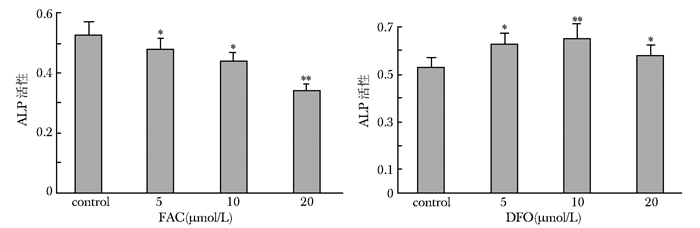
|
| 图 2 不同浓度FAC、DFO对hFOB1.19细胞碱性磷酸酶活性的影响 Figure 2 Effects of various concentration of FAC and DFO on ALP activity of hFOB1.19 cells FAC:枸橼酸铁铵;DFO:去铁胺; 与对照组比较,*P < 0.05,**P < 0.01 |
随FAC干预浓度增加,成骨细胞凋亡率也逐渐增加 (图 3、4),且呈剂量依赖性,各浓度组与对照组比较差异有统计学意义 (P < 0.05)。而DFO在5、10 μmol/L浓度时抑制成骨细胞凋亡 (P < 0.05),在20 μmol/L则促进成骨细胞凋亡 (P < 0.05)。
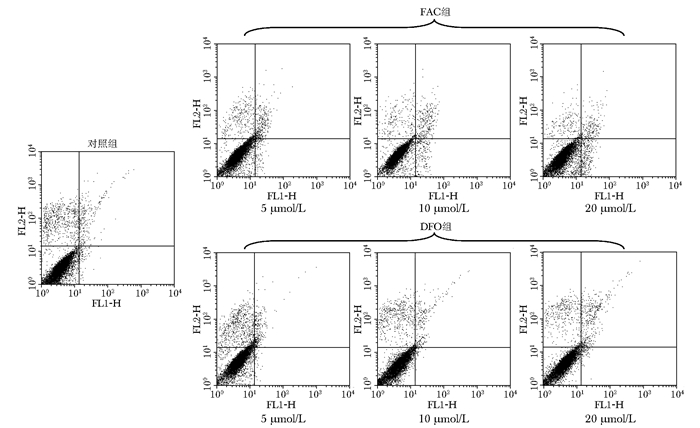
|
| 图 3 不同浓度FAC、DFO诱导成骨细胞凋亡 Figure 3 Osteoblast apoptosis of 2D scatter plot induced by various concentration of FAC and DFO FAC:枸橼酸铁铵;DFO:去铁胺; 左下区域为活细胞 (AnnexinⅤ-/PI-);右下区域为早期凋亡细胞 (AnnexinⅤ+/PI-);右上区域为已死亡细胞 (AnnexinⅤ+/PI+) |
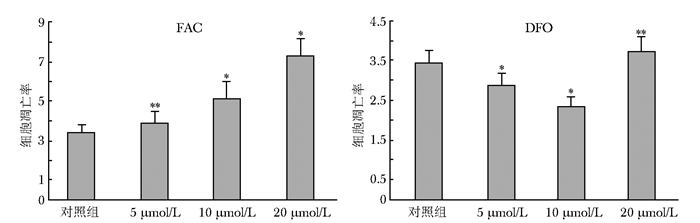
|
| 图 4 不同浓度FAC、DFO对成骨细胞凋亡率影响 Figure 4 Various concentration of FAC and DFO affecting osteoblast apoptosis rate FAC:枸橼酸铁铵;DFO:去铁胺; 与对照组比较,*P < 0.05,**P < 0.01 |
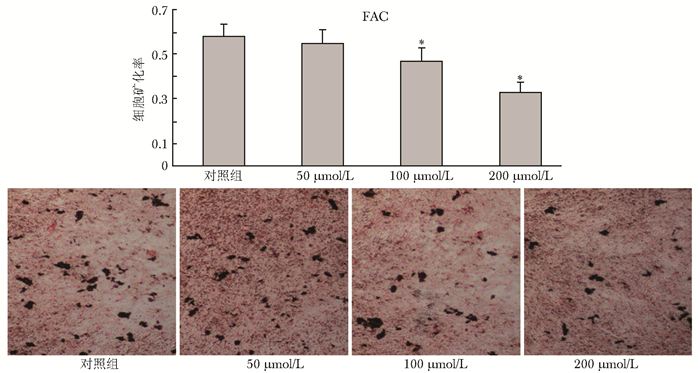
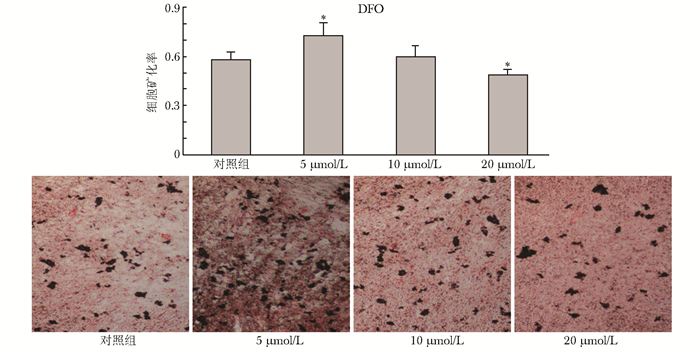
钙结节染色结果显示,随着干预浓度的增加,FAC组成骨细胞矿化能力减弱,钙化面积、钙结节均逐渐减少,且作用强度随FAC浓度增加而增加。DFO组在5、10 μmol/L浓度时使成骨细胞矿化能力增强,钙化面积、矿化钙结节数量均增多,而20 μmol/L浓度时则抑制成骨细胞矿化功能,钙化面积、矿化钙结节数量均减少 (图 5、6)。
|
| 图 5 钙结节Von kossa染色图 (×100) 及不同浓度FAC对成骨细胞矿化面积的影响 Figure 5 Von kossa staining of calcium nodules and the effects of various concentration of FAC on osteoblastic mineralization area FAC:枸橼酸铁铵; 与对照组比较,*P < 0.05 |
|
| 图 6 钙结节Von kossa染色图 (×100) 及不同浓度DFO对成骨细胞矿化面积的影响 Figure 6 Von kossa staining of calcium nodules and the effects of various concentration of DFO on osteoblastic mineralization area DFO:去铁胺; 与对照组比较,*P < 0.05 |
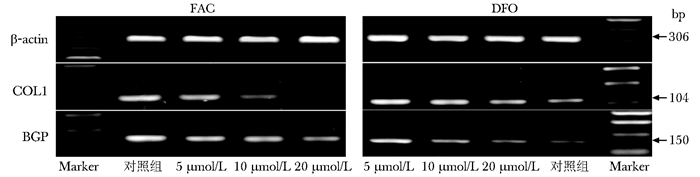
COL1、BGP产物电泳显示,FAC组目的DNA亮度逐渐减弱,目的基因COL1、BGP的吸光度比值呈剂量依赖性降低 (图 7),与对照组比较,差异有统计学意义 (P < 0.05)。DFO组目的DNA亮度逐渐增强,目的基因COL1、BGP的光吸度比值呈剂量依赖性增高 (图 8),与对照比较差异有统计学意义 (P < 0.05)。
|
| 图 7 不同浓度FAC、DFO作用hFOB1.19细胞后β-actin、COL1、BGP PCR产物 Figure 7 β-actin, COL1, BGP PCR expression after various concentration of FAC and DFO on hFOB1.19 cell FAC:枸橼酸铁铵;DFO:去铁胺; COL1:Ⅰ型胶原; BGP:骨钙素 |
|
| 图 8 COL1、BGP基因表达的变化 Figure 8 Changing trend of COL1, BGP gene expression 与对照组比较,*P < 0.05;各浓度组间比较,#P < 0.05 |
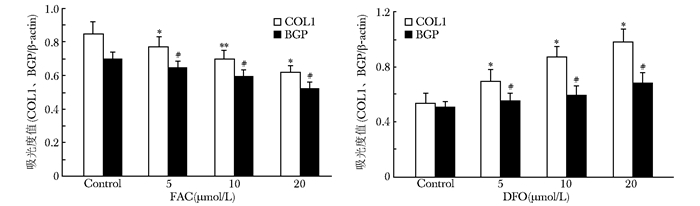
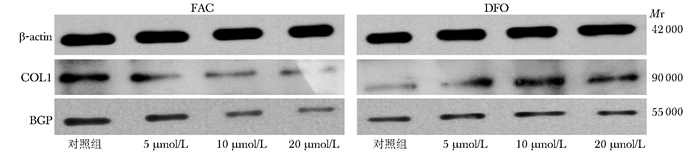
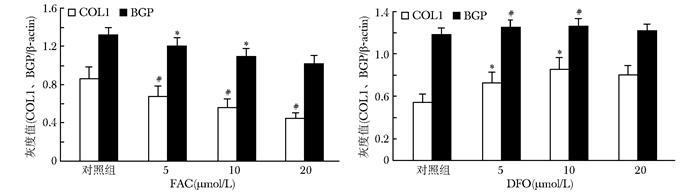
COL1、BGP蛋白电泳显示,FAC组各浓度泳道COL1、BGP蛋白显色深度逐渐减弱,表达的蛋白灰度比值成浓度依赖性降低 (P < 0.05)(图 9)。DFO组各浓度泳道COL1、BGP蛋白显色深度逐渐增强,表达的蛋白灰度比值在5、10 μmol/L浓度时增高,与对照组比较,差异有统计学意义 (P < 0.05),而20与10 μmol/L浓度组灰度值比较,差异无统计学意义 (P > 0.05) (图 10)。
|
| 图 9 不同浓度FAC、DFO作用hFOB1.19细胞后β-actin、COL1、BGP蛋白Western blotting分析 Figure 9 β-actin, COL1, BGP protein expression after various concentration of FAC and DFO on hFOB1.19 cell FAC:枸橼酸铁铵;DFO:去铁胺; COL1:Ⅰ型胶原; BGP:骨钙素;Mr:相对分子质量 |
|
| 图 10 COL1、BGP蛋白表达的变化 Figure 10 Changing trend of COL1, BGP protein expression FAC:枸橼酸铁铵;DFO:去铁胺; COL1:Ⅰ型胶原; 与对照组比较,*P < 0.05;各浓度组间比较,#P < 0.05 |
铁是人体必需的微量元素,对机体代谢发挥着重要的生物学功能。当血液中的铁离子超出转铁蛋白结合能力时,未被转铁蛋白结合的游离铁就会沉积于组织中形成“铁过载”,对细胞、组织产生不利影响。同样当体内铁离子缺乏时也会影响机体部分生理功能如红细胞功能、氧化代谢、免疫应答等,因此维持机体内铁离子动态平衡 (铁稳态) 至关重要。近年来随着对铁代谢研究的不断深入,越来越多的研究表明铁代谢与骨代谢具有明显相关性。2006年Liu等[4]用动物实验研究了骨组织中年龄相关性铁沉积与绝经后骨质疏松的相关性,通过切除大鼠卵巢来建立骨质疏松症模型,给模型大鼠口服铁螯合剂,阻止铁沉积于骨组织,检测铁离子水平变化与骨量丢失之间相关性。结果显示,铁螯合剂能治疗骨量丢失和骨微结构破坏,推测铁螯合剂逆转骨量丢失和骨微结构破坏的机制可能是抑制骨的再吸收。2008年,Kudo等[5]研究了铁过载对雄性大鼠股骨骨矿物质密度的影响。研究结果显示给与注射胶体铁4周后大鼠的股骨骨矿物质密度显著降低。在体外模型试验中,2008年Guggenbuhl等[6]用羟磷灰石结晶构成的羧甲基化聚合球制作模型,拟编织骨的钙化,发现随着体液中铁浓度增加,钙含量呈逐渐减少趋势,提示高铁环境对骨的钙化存在直接抑制作用。
本实验以人成骨细胞 (hFOB1.19) 为研究对象,通过铁离子直接干预成骨细胞并检测成骨细胞在体外高铁环境及低铁环境中细胞功能活性的变化。如果细胞外铁离子环境变化可以引起成骨细胞功能活性的变化,那么通过给体内创造不同的铁离子环境,促进成骨细胞增生,增强成骨细胞功能,便可促进成骨细胞外钙盐沉淀,为骨基质的形成提供物质基础,从而为预防及治疗铁介导的骨异常开辟新的思路。
成骨细胞是骨形成过程中的重要功能细胞,参与骨的修复与重建过程。成骨细胞数量的改变 (细胞增生、凋亡) 是影响骨代谢平衡的重要方面。成骨细胞功能的改变 (碱性磷酸酶活性、矿化功能、分泌Ⅰ型胶原和骨钙素) 是影响骨代谢平衡的关键。本实验通过成骨细胞在离体环境下研究发现:人成骨细胞 (hFOB1.19) 的功能活性在高铁环境下 (枸橼酸铁铵) 受到抑制,导致碱性磷酸酶活性降低,凋亡增加,细胞矿化能力降低,矿化钙结节及矿化面积呈剂量依赖性降低,Ⅰ型胶原及骨钙素在基因及蛋白水平的表达均受到抑制,提示高铁环境下对成骨细胞的成骨功能是不利的,这与国内外研究报道“铁过载”与骨质疏松的观点[6-9]是一致的。
同样在离体成骨细胞实验研究中,2009年Yamasaki等[7]研究了三价铁 (FAC) 对小鼠成骨细胞系MC3T3-E1和胎鼠颅盖骨成骨细胞 (ROB) 细胞增生、分化和矿化的影响,结果显示:FAC能抑制MC3T3-E1细胞活性、降低Ⅰ型胶原mRNA和蛋白质的表达、降低碱性磷酸酶的活性,使ROB细胞矿化过程受阻,且FAC的效应存在剂量依赖性。同年Zarjou等[8]在研究铁抑制成骨细胞活性的机制发现:铁和去铁铁蛋白 (apoferritin) 均可以抑制成骨细胞的矿化。
上述研究在动物及细胞水平的研究表明铁离子与骨代谢有着密切关系,这些研究结果对本实验研究提供了良好的研究背景。本实验在高铁及低铁两种环境下成骨细胞功能活性的变化,从而避免了上述研究仅从高铁环境下对成骨细胞功能活性影响的片面性。本实验研究发现低铁环境 (去铁胺) 对成骨细胞功能活性的影响具有双重效应,低剂量去铁胺对成骨细胞活性有促进作用,而高剂量去铁胺则对成骨细胞活性有抑制效应。实验中低剂量去铁胺 (5~10 μmol/L) 能促进细胞增生,使碱性磷酸酶活性增加,凋亡减少,细胞矿化能力增强,矿化钙结节及矿化面积增加,促进Ⅰ型胶原及骨钙素基因及蛋白的表达。以上结果提示适当的低铁环境有利于成骨细胞的生存和生物学功能的发挥。然而铁毕竟是机体必需的元素之一。研究证实,细胞铁的缺乏或利用度降低会引起细胞核苷酶的活性下降而导致细胞DNA合成障碍。因此极度的低铁环境对成骨细胞也有不良的影响,我们用高剂量去铁胺 (20 μmol/L) 进一步降低成骨细胞的铁离子环境,结果发现,成骨细胞的增生受到抑制,其碱性磷酸酶活性降低,凋亡增加,细胞矿化能力减弱,矿化钙结节及矿化面积减少,Ⅰ型胶原及骨钙素基因及蛋白的表达降低。以上结果提示去铁胺对人成骨细胞 (hFOB1.19) 功能活性的影响具有双面性,包括高剂量时对细胞有毒性作用,甚至导致细胞死亡,而低剂量时对成骨细胞有促进效应。2010年,Abolfazl等[9]去铁胺 (DFO) 干预成骨细胞后发现,DFO能增加钙盐沉积和钙结节形成,提高碱性磷酸酶的活性和促进骨钙素的表达。Abolfazl等[9]研究的结果与本实验研究结果相似,只是所用的细胞种属不同,综合两项研究结果,我们认为,铁离子 (包括枸橼酸铁铵及去铁胺) 作用于不同的种属细胞可能具有相同效应。2009年Kiyoaki等[10]报道铁螯合剂抑制破骨细胞的骨吸收功能,保护骨量丢失。结合本实验结果,提示铁螯合剂 (包括去铁胺) 不仅能促进成骨细胞的成骨功能,还能抑制破骨细胞的骨吸收功能。
总之,本实验研究发现高铁环境抑制成骨细胞活性,不利于成骨细胞的成骨功能;而低铁环境对成骨细胞有双重效应,低剂量去铁胺对成骨细胞活性有促进作用,高剂量去铁胺则对成骨细胞活性有抑制效应。但铁离子如何参与骨代谢,其与骨代谢之间相互作用的具体机制尚不明确,因此进一步研究铁离子与骨代谢的相关机制,可能为铁离子异常导致的骨量减少、骨密度降低提供一种潜在的治疗方法。
| [1] | Li GF, Pan YZ, Sirois P, et al. Iron homeostasis in osteoporosis and its clinical implications[J]. Osteoporos Int, 2012, 23 : 2403–2408. DOI:10.1007/s00198-012-1982-1 |
| [2] | He YF, Ma Y, Gao C, et al. Iron overload inhibits osteoblast biological activity through oxidative stress[J]. Biol Trace Elem Res, 2013, 152 : 292–296. |
| [3] | Xiao W, Beibei F, Guangsi S, et al. Iron overload increases osteoclastogenesis and aggravates the effects of ovariectomy on bone mass[J]. J Endocrinol, 2015, 226(3) : 121–134. DOI:10.1530/JOE-14-0657 |
| [4] | Liu G, Men P, Kenner GH, et al. Age-associated iron accumulation in bone: implications for postmenopausal osteoporosis and a new target for prevention and treatment by chelation[J]. Biometals, 2006, 19 : 245–251. |
| [5] | Kudo H, Suzuki S, Watanabe A, et al. Effects of colloidal iron overload on renal and hepatic siderosis and the femur in male rats[J]. Toxicology, 2008, 246 : 143–147. DOI:10.1016/j.tox.2008.01.004 |
| [6] | Guggenbuhl P, Filmon R, Mabilleau G, et al. Iron inhibits hydroxyapatite crystal growth in vitro[J]. Metabolism, 2008, 57 : 903–910. |
| [7] | Yamasaki K, Hagiwara H. Excess iron inhibits osteoblast metabolism[J]. Toxicol Lett, 2009, 191 : 211–215. DOI:10.1016/j.toxlet.2009.08.023 |
| [8] | Zarjou A, Jeney V, Arosio P, et al. Ferritin-ferroxidase activity: a potent inhibitor of osteogenesis[J]. J Bone Miner Res, 2010, 25 : 164–172. DOI:10.1359/jbmr.091002 |
| [9] | Abolfazl Z, Viktoria J, Paolo A, et al. Ferritin ferroxidase activity:apotent inhibitor of osteogenesis[J]. J Bone Mineral Res, 2010, 25 : 164–172. |
| [10] | Kiyoaki I, Toshio F, Kazuhiro I, et al. Coordination of PGC-1b and iron uptake in mitochondrial biogenesis and osteoclast activation[J]. Nat Med, 2009, 15 : 259–266. DOI:10.1038/nm.1910 |
| (收稿日期:2016-09-13) |

