2. 100035 北京,北京积水潭医院创伤骨科
2. Department of Traumatic Orthopedic, Beijing Jishuitan Hospital, The Fourth Medical College of Peking University, Beijing 100035, China
髋部骨折常见于老年患者,是原发性骨质疏松症中最常见并发症之一,其致死率及骨折后并发症的发生率均高于其他脆性骨折[1]。髋部骨折主要可分为股骨颈骨折和粗隆间骨折,两者的临床表现有很多不同。随着人口老龄化进程的不断加快,髋部骨折的发病率日趋增高。据估测到2050年全世界的髋部骨折人数将达到626万,其中亚洲将占50%以上[1]。随着髋部骨折的增加,骨折后的延迟愈合或不愈合、假体周围再次骨折等亦将增加,有没有较好的指标能预测上述情况的发生成为目前关注的问题。由于影像学表现多较延迟,故可早期反映骨代谢的骨代谢标志物被大家所关注。
骨代谢是个动态的时空耦联的过程,骨转换生化标志物来自小梁骨和皮质骨的骨转换,它们反映了整个骨框架的代谢活动而不是单个细胞代谢或矿化的过程。目前国内外可以通过生物化学检测技术获得的骨代谢指标可分为骨代谢调节激素、细胞与体液因子、骨吸收、骨形成标志物,临床上常用的比较稳定的骨吸收标志物为1型胶原交联羧基末端肽(C-terminal crosslinking telopeptides of type 1 collagen,CTX),骨形成标志物为1型前胶原氨基末端前肽(N-propeptide of type 1 collagen,P1NP)。
目前骨折后骨代谢的变化趋势、变化范围、正常异常界限仍不详,亦无有效的生化标志物可用于监测骨折的严重程度以及愈合情况。本研究观察老年骨质疏松患者髋部骨折后骨转换生化标志物的变化,了解其规律,期望了解髋部骨折后骨代谢指标的变化趋势和程度,并应用于监测骨折的严重程度以及骨折愈合情况,进而能早期发现及治疗骨折不愈合,早期调整治疗方案。
对象与方法对象
138例患者均为北京积水潭医院老年髋部骨折病房住院的老年髋部骨折患者,于2015年5月至2016年11月入院治疗,均为低能量造成的脆性骨折;1周内完成手术,所选取的手术方式包括人工股骨头置换术或空心钉内固定、带锁髓内针内固定术。所有患者均在术前应用双能X线检测仪(dual energy X-ray absorptiometry,DXA)检查骨密度(bone mineral density, BMD),术前及术后40~50 d分别检测空腹血清钙、磷、25羟维生素D(25 hydroxyvitamine D, 25OHD)、碱性磷酸酶(alkaline phosphatase,ALP)、P1NP及CTX。术后均进行了康复指导以及尽早的活动锻炼。
在分组中,术前股骨颈组为股骨颈骨折组,术后股骨颈组为股骨颈骨折人工股骨头置换术组,股骨颈空心钉组为股骨颈骨折闭合复位、空心钉内固定组;粗隆间组为股骨粗隆间骨折闭合复位、髓内钉内固定组。
排除标准:暴力骨折,曾接受过双膦酸盐、活性维生素D、降钙素、雌激素和雌激素受体调节剂等影响骨代谢的药物治疗;继发性骨质疏松,包括甲状旁腺功能减退或亢进、库欣综合征;慢性肝病和血肌酐水平>177 μmol/L的慢性肾病;风湿或类风湿关节炎;近2年患胃溃疡、克罗恩病、节段性小肠炎和慢性痢疾等;非遗传性影响骨密度的神经或肌肉疾病;恶性肿瘤活动期;过早绝经(<40岁);患有皮肤疾病无法接受阳光照射等。
方法
所有患者登记骨折时间以及标本采集时间;所有受试者晨起采集空腹血3 mL,血清经低温离心分离后置于-20 ℃保存,避免样品反复冻融。采用电化学发光免疫(Roche公司COBAS)试剂盒定量测定血清P1NP、CTX、25OHD水平,灵敏度分别为小于5.00、0.07和3.00 μg/L,批间变异系数和批内变异系数均<10%。
BMD测定:所有受试者均行腰椎和健侧髋部DXA(GE Lunar,Madison,WI,USA)检查。
统计学方法
应用IBM SPSS 19统计学软件,计量资料以均数±标准差(x±s)表示,非正态资料以中位数(25%,75%)表示;均值比较采用t检验、配对t检验;骨代谢标志物随骨折后时间的变化与其他参数的关系采用相关性检验及Logistic回归分析;以P<0.05为差异有统计学意义。
结果一般情况
138例老年骨折患者中,女性106例(77%),其中股骨粗隆间骨折51例,股骨颈骨折55例;男性32例(23%),其中股骨粗隆间骨折17例,股骨颈骨折15例;患者年龄65~94岁,平均年龄(79.2±7.1) 岁;平均腰椎L1-4 BMD为(0.90±0.20) g/cm2,腰椎L1-4 T值为-1.70±1.71;平均髋部BMD为(0.67±0.12) g/cm2,髋部T值为-2.30±0.89(腰椎和髋部的BMD进行配对t检验,P=0.000);骨折后1周内完成手术,平均手术时间(4.2±2.6) d,随访时间为术后40~50 d,平均随访时间(46.2±6.0) d(表 1)。
| 骨折类型 | 例数 | 年龄(岁) | BMI (kg/m2) | 钙(mmol/L) | 磷(mmol/L) | ALB (g/L) | HGB (g/L) | HbA1c | 随机GLU(mmol/L) | BUN (mmol/L) | Cr (μmol/L) | BMD-T值 | |
| 女性 | 粗隆间 | 51 | 80.1±6.2 | 23.3±3.5 | 2.32±0.10 | 0.99±0.17 | 40.6±3.9 | 110.9±17.7 | 6.7±1.8 | 9.2±3.6 | 7.2±2.6 | 60.3±17.6 | -2.7±0.7 |
| 股骨颈 | 55 | 78.0±7.2 | 22.3±3.3 | 2.36±0.09 | 0.93±0.16 | 42.0±3.0 | 122.5±10.6 | 6.6±1.9 | 9.0±3.3 | 6.9±2.6 | 59.6±18.0 | -2.5±0.7 | |
| 男性 | 粗隆间 | 17 | 76.1±7.5 | 24.1±3.4 | 2.28±0.09 | 0.92±0.17 | 41.8±2.8 | 126.4±12.3 | 6.3±1.2 | 7.9±2.7 | 7.1±1.6 | 72.7±18.2 | -1.6±0.7 |
| 股骨颈 | 15 | 79.7±5.4 | 23.4±2.9 | 2.36±0.10 | 0.91±0.22 | 41.7±4.0 | 134.0±18.4 | 6.0±0.8 | 7.1±1.5 | 6.8±2.0 | 84.3±23.3 | -1.4±0.9 | |
| BMI:体质量指数;钙为经白蛋白水平校正血钙;ALB:白蛋白;HGB:血红蛋白;HbA1c:糖化血红蛋白;随机GLU:随机静脉血糖;BUN:血尿素氮;Cr:血肌酐;BMD-T值:双能X线髋部骨密度T值;T值:患者与同性别和种族青年人的骨密度参考值比较 | |||||||||||||
P1NP术前术后变化趋势
髋部骨折术后,反应骨代谢合成的指标P1NP出现了明显上升(图 1)。股骨颈骨折人工股骨头置换术组和股骨粗隆间骨折髓内钉内固定组,术后期40~50 d女性患者P1NP上升约3倍,男性患者P1NP上升达到4倍左右(表 2)
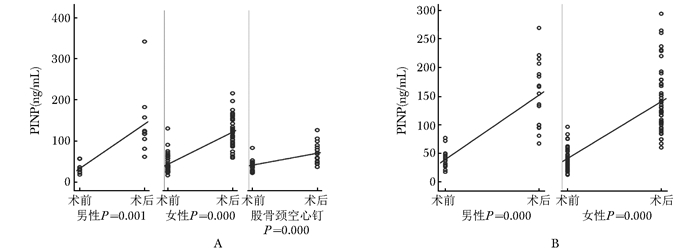
|
| 图 1 髋部骨折患者手术前后P1NP的变化 Figure 1 Changes of P1NP level before and after surgery in hip fracture patients A:股骨颈骨折后P1NP术前术后变化;B:股骨粗隆间骨折后P1NP术前术后变化;P1NP:Ⅰ型前胶原氨基末端前肽 |
| 骨折类型 | 例数 | 术前 | 复查时间(d) | 术后 | |||||||
| ALP(U/L) | P1NP(μg/L) | CTX(μg/L) | 25OHD(μg/L) | ALP(U/L) | P1NP(μg/L) | CTX(μg/L) | 25OHD(μg/L) | ||||
| 女性 | 粗隆间 | 51 | 68.8±19.5 | 40.7±18.5 | 0.57±0.25 | 12.6±9.6 | 46.3±4.5 | 96.7±28.4 | 140.3±54.0 | 0.90±0.33 | 16.3±8.7 |
| 股骨颈 | 42 | 66.5±15.4 | 42.8±21.6 | 0.66±0.30 | 13.8±6.1 | 48.0±5.4 | 73.1±14.9 | 121.4±36.2 | 0.88±0.28 | 16.2±6.4 | |
| P值 | 0.527 | 0.618 | 0.118 | 0.448 | 0.108 | 0.000 | 0.048 | 0.735 | 0.963 | ||
| 男性 | 粗隆间 | 17 | 58.2±22.1 | 39.0±16.2 | 0.48±0.23 | 15.8±7.6 | 46.3±4.9 | 106.7±45.5 | 151.6±57.7 | 0.66±0.30 | 19.0±8.0 |
| 股骨颈 | 10 | 61.7±13.2 | 32.8±13.7 | 0.49±0.24 | 17.9±9.7 | 47.0±2.9 | 95.7±24.1 | 140.9±78.5 | 0.70±0.30 | 21.5±13.5 | |
| P值 | 0.658 | 0.318 | 0.917 | 0.534 | 0.641 | 0.490 | 0.690 | 0.729 | 0.549 | ||
| 股骨颈空心钉 | 18 | 68.1±17.7 | 41.0±14.1 | 0.56±0.27 | 14.0±9.1 | 46.4±4.1 | 77.8±18.4 | 70.0±24.0 | 0.65±0.27 | 18.1±10.26.3 | |
| 粗隆间P值 | 0.065 | 0.731 | 0.170 | 0.216 | 1.000 | 0.406 | 0.466 | 0.008 | 0.264 | ||
| 股骨颈P值 | 0.369 | 0.168 | 0.088 | 0.098 | 0.693 | 0.000 | 0.460 | 0.077 | 0.257 | ||
| 股骨颈空心钉P值 | 0.554 | 0.978 | 0.356 | 0.770 | 0.537 | 0.956 | 0.000 | 0.015 | 0.716 | ||
| ALP:碱性磷酸酶;P1NP:1型前胶原氨基末端肽;CTX:1型胶原交联羧基末端肽;25OHD:25羟维生素D;P值:同性别粗隆间和股骨颈骨折之间一般情况的t检验P值;粗隆间P值:男性和女性的股骨粗隆间骨折之间一般情况的t检验P值;股骨颈P值:男性、女性的股骨颈骨折人工股骨头置换组之间一般情况的t检验P值;股骨颈空心钉P值:股骨颈骨折空心钉内固定组和股骨颈骨折人工股骨头置换术组之间一般情况的t检验P值 | |||||||||||
CTX术前术后变化趋势
髋部骨折术后,反应骨代谢破坏的指标CTX亦出现了明显的上升(图 2),上升幅度在各类型骨折中均为1.5倍左右(表 2),然而有部分患者为下降趋势(图 3)。
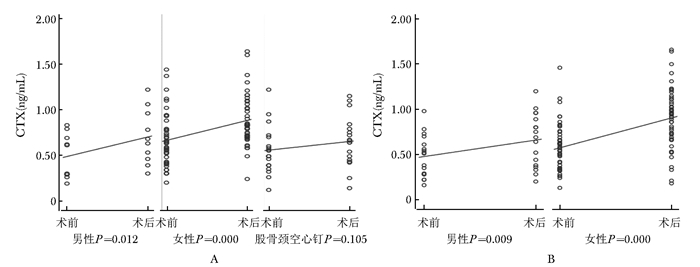
|
| 图 2 髋部骨折患者手术前后CTX的变化 Figure 2 Changes of CTX level before and after surgery in hip fracture patients A:股骨颈骨折后CTX术前术后变化; B:股骨粗隆间骨折后CTX术前术后变化;CTX:Ⅰ型胶原交联羟基末端肽 |
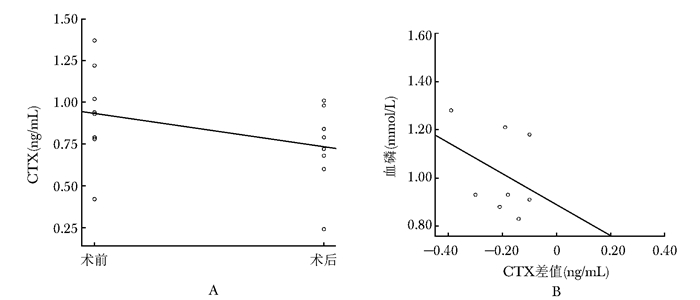
|
| 图 3 CTX下降股骨颈骨折人工股骨头置换术患者CTX变化和血磷的关系 Figure 3 Relation of CTX level with serum phosphate concentration in female patients with hemiarthroplasty for femoral neck fracture A:女性股骨颈骨折人工股骨头置换术后CTX下降术前术后变化; B:女性股骨颈骨折人工股骨头置换术后CTX下降与血磷的关系;CTX:Ⅰ型胶原交联羟基末端肽 |
ALP术前术后变化趋势
髋部骨折术后,反应骨代谢合成的指标ALP出现了明显的上升(图 4),上升幅度在各类型骨折中均为1.5倍左右(表 2)
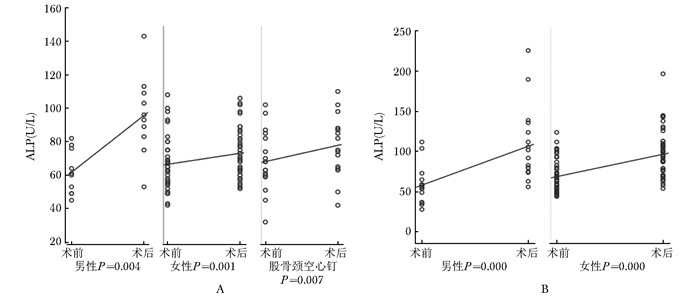
|
| 图 4 髋部骨折患者手术前后ALP的变化 Figure 4 Changes of ALP level before and after surgery in hip fracture patients A:股骨颈骨折后ALP术前术后变化;B:股骨粗隆间骨折后ALP术前术后变化;ALP:碱性磷酸酶 |
女性髋部骨折前后P1NP、CTX的变化值和其他参数的关系
女性股骨颈骨折人工股骨头置换术前后:未见P1NP的变化值和年龄、BMI、BMD、血白蛋白、血钙、血磷、血红蛋白、25OHD相关;CTX的变化值和基线血磷呈负相关(r= -0.426,P=0.005);未见CTX变化值和其他参数相关。
女性股骨颈骨折空心钉术前后:P1NP的变化值和患者年龄相关(r=0.587,P=0.035);P1NP的变化值和基线25OHD相关(r=0.791,P=0.002);未见P1NP的变化值和BMI、BMD、血白蛋白、血钙、血磷、血红蛋白相关;未见CTX变化值和其他参数相关。
女性粗隆间骨折髓内针内固定术前后:P1NP的变化值和患者基线白蛋白水平相关(r=-0.330,P=0.018);未见P1NP的变化值和年龄、BMI、BMD、血钙、血磷、血红蛋白、25OHD相关;未见CTX变化值和其他参数相关。
女性股骨颈骨折人工股骨头置换术组中CTX下降的Logistic回归分析:CTX的下降与基线血磷水平成负相关(wald检验,P=0.017)。
讨论对于髋部骨折目前临床中多尽早采取各种术式,比如空心钉、人工股骨头置换术或髓内钉以避免卧床出现多种并发症,达到尽快活动提高生活质量、降低病死率的目的。无论手术还是保守治疗,骨折后的愈合都是一个动态的过程,破骨细胞清除残留死骨,成骨细胞形成新骨,二者紧密关联构成骨重建或称骨转换。骨代谢的生化指标可反映骨折愈合过程中的骨转换状态[2-4],骨代谢标志物中P1NP为Ⅰ型前胶原经酶切修饰后产生,P1NP在血清中的含量反映成骨细胞合成骨胶原的能力;CTX为成熟Ⅰ型胶原被破骨细胞降解所产生,CTX在血清中的含量反映破骨细胞的骨吸收活性。曾有研究报道,对于髋部骨折的患者,骨吸收标志物在骨折术后2周内升高,2~3个月开始降低,6个月时接近于骨折前的水平;骨形成标志物峰值时间晚于骨吸收标志物,但在骨折术后1年仍保持升高。骨代谢标志物的变化可反应骨折后的修复过程[5-6],了解骨代谢标志物的变化规律有助于早期发现不符合规律的愈合过程,从而早期干预。
本研究观察了股骨颈骨折和股骨粗隆间骨折患者,手术前后骨代谢标志物的变化。从一般资料中,可见髋部骨折以女性居多,且患者髋部的BMD水平明显低于腰椎的BMD水平;这可能与DXA在检测椎体时受到椎体骨质增生、椎旁大动脉及周围韧带软组织钙化从而使BMD有一定程度假性升高有关。女性股骨粗隆间骨折的血红蛋白水平均较低,低于女性股骨颈骨折和男性髋部骨折;且年龄偏高,考虑与高龄者易发生粗隆间骨折有关,女性基础血红蛋白水平即偏低,且粗隆间骨折患者因局部失血故而更易贫血[7]。女性的肌酐水平低于男性,女性髋部BMD-T值水平低于男性;符合男性肌肉含量高于女性,男性骨密度优于同年龄阶段女性的一般认识[8]。老年髋部骨折患者的维生素D水平均不足,骨折得到重视后维生素D水平有轻微的升高。多数老年患者的血钙及血磷均在正常范围内最低的四分之一象限,经过白蛋白水平校正后的血钙水平亦如此;可能与老年人群维生素D水平低,肠道中酸性环境不足,生长激素水平低,服用某些胃肠道药物等有一定关系。
骨代谢标志物变化的观察提示:骨折后1周内至术前,男、女性别之间,以及两种髋部骨折之间的骨代谢标志物均未见明显差异,提示各组患者基线值相同。骨折术后40~50 d时骨代谢标志物均有明显上升,其中以P1NP上升最明显,女性患者的P1NP上升约3倍,男性患者P1NP上升达到4倍左右;CTX及ALP上升幅度均在1.5倍左右水平,提示髋部骨折患者术后成骨及破骨均较活跃,总体仍以成骨为主;但股骨颈骨折空心钉内固定组骨标的变化幅度有不同。股骨颈骨折空心钉内固定组患者术后P1NP较术前上升在1.5倍左右,术前术后比较,差异有统计学意义(P=0.000);但CTX术后与术前比较,差异无统计学意义(P=0.105);考虑原因为该术式并未改变患者的解剖结构,骨折仍保持为囊内骨折,鉴于囊内骨折关节液的冲刷、血供的不丰富、生物学环境不良,从而骨代谢的水平明显低于囊外骨折的粗隆间和转为囊外愈合的人工股骨头置换术患者[9-10]。从数值上,男性的P1NP及ALP高于女性,CTX低于女性,考虑与男性雄激素的成骨作用及女性失去了雌激素对骨代谢的保护作用有关,有待进一步扩大样本量来明确。
在手术前后骨代谢标志物变化的折线图中,可见反应成骨的P1NP和ALP均表现为上升趋势,但反应破骨的CTX在部分患者呈下降的趋势;选择例数较多、下降趋势较明显的女性股骨颈骨折人工股骨头置换术后组进一步分析原因:Logistic回归提示:CTX的下降与基线血磷水平成负相关(wald检验,P=0.017);即如基线血磷水平偏高,则CTX在术后更早的趋于降低;由于老年患者血磷水平正常偏高有提示患者健康状况相对良好,营养摄入充足,蛋白、胶原、能量代谢状况较好的意义,故考虑可能这部分患者骨代谢的能力相对较好,能更早的进入骨折愈合;亦有可能该部分患者对位、对线优于其他患者。在分组分析女性髋部骨折后骨代谢标志物与其他参数的关系中,可见部分有统计学意义的相关,亦有一定临床意义,但整体上并未见明显的趋势。
之前也有文献陆续报道过髋部骨折后骨代谢标志物的变化,但多数研究均未区分骨折类型、手术类型,以及性别、年龄跨度亦较大[11-13]。且先前的研究多采用ALP作为骨形成的标志物,结果提示股骨粗隆间骨折髓内钉固定术后的骨形成及骨吸收标志物均高于股骨颈骨折空心钉内固定手术患者[6-14],本研究结果也同上述研究结果一致,且未见骨代谢标志物和骨密度之间的相关。
总体上,髋部骨折类型不同、手术方式不同将会明显影响骨折手术后骨代谢标志物的变化趋势,也就代表着不同类型的患者骨折愈合将有所不同。但骨折后骨代谢标志物的变化应是有范围有规律的,超出范围或达不到升高幅度及/或不符合规律的变化则提示骨折愈合进程的异常。这种规律对于了解骨代谢,监测骨折愈合过程,早期发现骨折愈合中的异常,甚至制定骨折后的治疗方案应能起到一定的作用。
| [1] | Cooper C, Cole ZA, Holroyd CR, et al. Secular trends in the incidence of hip and other osteoporotic fractures[J]. Osteoporos Int, 2011, 22: 1277–1288. DOI:10.1007/s00198-011-1601-6 |
| [2] | Sousa CP, Dias IR, Lopez-Peña M, et al. Bone turnover markers for early detection of fracture healing disturbances:A review of the scientific literature[J]. An Acad Bras Cienc, 2015, 87: 1049–1061. DOI:10.1590/0001-3765201520150008 |
| [3] | Wölfl C, Schweppenhäuser D, Gühring T, et al. Characteristics of boneturnover in the longbonemetaphysisfracturedpatients with normal or lowbone mineral density(BMD)[J]. PLoS One, 2014, 9: e96058. DOI:10.1371/journal.pone.0096058 |
| [4] | Mukhopadhyay M, Sinha R, Pal M, et al. Role of commonbiochemical markers for the assessment of fractureunion[J]. Indian J Clin Biochem, 2011, 26: 274–278. DOI:10.1007/s12291-011-0143-1 |
| [5] | Ichimura S, Hasegawa M. Biochemical markers of bone turnover. New aspect. Changes in bone turnover markers during fracture healing[J]. Clin Calcium, 2009, 19: 1102–1108. |
| [6] | Ikegami S, Kamimura M, Nakagawa H, et al. Comparison in bone turnover markers during early healing of femoral neck fracture and trochanteric fracture in elderly patients[J]. Orthop Rev (Pavia), 2009, 1: 50–55. |
| [7] | Smith GH, Tsang J, Molyneux SG, et al. The hidden bloodloss after hip fracture[J]. Injury, 2011, 42: 133–135. DOI:10.1016/j.injury.2010.02.015 |
| [8] | Li M, Li Y, Deng W, et al. Chinese bone turnover marker study:reference ranges for C-terminal telopeptide of type Ⅰ collagen and procollagen I N-terminal peptide by age and gender[J]. PLoS One, 2014, 9: e103841. DOI:10.1371/journal.pone.0103841 |
| [9] | Bonnaire F, Schaefer DJ, Kuner EH. Hemarthrosis and hip joint pressure in femoral neck fractures[J]. Clin Orthop Relat Res, 1998, 353: 148–155. DOI:10.1097/00003086-199808000-00017 |
| [10] | Beck M, Siebenrock KA, Affolter B, et al. Increased intraarticular pressure reduces blood flow to the femoral head[J]. Clin Orthop Relat Res, 2004, 424: 149–152. DOI:10.1097/01.blo.0000128296.28666.35 |
| [11] | Hosking DJ. Changes in serum alkaline phosphatase after femoral fractures[J]. J Bone Joint Surg, 1978, 60B: 61–65. |
| [12] | Ohishi T, Takahashi M, Kushida K, et al. Changes of biochemical markers during fracture healing[J]. Arch Orthop Trauma Surg, 1998, 118: 126–130. DOI:10.1007/s004020050331 |
| [13] | Sato Y, Kaji M, Higuchi F, et al. Changes in bone and calcium metabolism following hip fracture in elderly patients[J]. Osteoporosis Int, 2001, 12: 445–449. DOI:10.1007/s001980170088 |
| [14] | Nakagawa H, Kamimura M, Uchiyama S, et al. Changes in total alkaline phosphatase(ALP) level after hip fracture:comparison between femoral neck and trochanter fracture[J]. J Orthop Sci, 2006, 11: 135–159. DOI:10.1007/s00776-005-0990-9 |
| (收稿日期:2016-08-11) |

