2. 116044 大连,大连医科大学药学院临床药理教研室
2. Department of Clinical Pharmacology, College of Pharmacy, Dalian Medical University, Dalian 116044, Liaoning, China
骨的健康,包括骨容量、骨密度等,是由平衡的骨重塑过程保持的[1]。骨重塑过程包括成骨细胞介导的骨形成和破骨细胞介导的骨吸收[2]。当骨形成和骨吸收的平衡被打破导致成骨细胞介导的骨形成弱于破骨细胞介导的骨吸收时,骨表现出以骨质疏松为代表的病变状态,表现为骨脆性增加、骨微结构破坏,及增加骨折风险[3]。
研究表明氧化应激是骨质疏松的致病因素[4]。氧化应激,由机体内过量活性氧(reactive oxygen species,ROS)蓄积造成的,即活性氧的产生超过机体抗氧化能力[4]。一方面,ROS可抑制成骨细胞分化并抑制成骨细胞的矿化作用,诱导成骨细胞凋亡[5];另一方面,机体内的ROS也可促进破骨细胞的分化和骨吸收[6],两者均可破坏骨重塑的平衡,导致骨吸收高于骨形成,进而导致骨质疏松。因此,抗氧化剂可能通过清除体内氧自由基而达到预防或者治疗骨质疏松的作用。NADPH氧化酶4(NADPH oxidase4,Nox4)则是ROS主要来源[7],通过抑制Nox4蛋白或mRNA的表达减少成骨细胞内ROS的产生从而促进骨形成,这可为预防和治疗骨质疏松提供新的思路和靶点。
α-硫辛酸(alpha-lipoic acid,ALA),作为一种天然的超强抗氧化剂,素有“万能抗氧化剂”美誉,具有很强的清除体内ROS的能力[8, 9]。本实验初步探讨硫辛酸对H2O2处理的MC3T3-E1成骨细胞骨形成过程的影响及其促骨形成的作用机制。
材料与方法 主要实验试剂MC3T3-E1细胞:购于中国科学院上海细胞生物学研究所。硫辛酸(批号20060214,纯度≥99.5 %):江苏常熟富士莱医药化工有限公司;DMEM培养基:Gibico公司,美国;胎牛血清(fetal bovine serum,FBS):天津市灏洋生物制品科技有限责任公司;胰蛋白酶: Gibico公司;MTT,DMSO:Sigma公司。碱性磷酸酶(alkaline phosphatase,ALP)、超氧化物歧化酶(superoxide dismutase,SOD)、细胞丙二醛(malondialdehyde,MDA)、乳酸脱氢酶(lactate dehydrogenase,LDH)活性分析试剂盒:南京建成科技有限公司; DCFH-DA探针及BCA蛋白浓度测定试剂盒:碧云天生物技术研究所;RNAiso Plus(Total RNA提取试剂)、real time (RT)-PCR引物、RT-PCR 试剂盒:宝生物工程(大连)有限公司;Triton X-100、维生素C:Amresco公司,美国;β-甘油磷酸钠:Solarbio公司,中国。
主要实验仪器CO2培养箱(Thermo公司,美国),倒置生物相差显微镜(Olympus公司,日本),RT-PCR仪器(ABI 7500,美国)。
MC3T3-E1细胞分组及处理细胞分组:细胞计数后将其分为5组,每组5孔重复,即空白对照组(Control),H2O2损伤组(1.0 mmol/L),低剂量硫辛酸给药组(0.1 mmol/L),中剂量硫辛酸给药组(0.2 mmol/L),高剂量硫辛酸给药组(0.4 mmol/L)。ALA水溶性较差,故用1 mL DMSO配成800 mmol/L的母液,再用无血清培养液稀释至相应浓度(DMSO浓度≤0.5‰),H2O2用无血清培养液稀释至终浓度为1.0 mmol/L。
给药处理:给药组先加入相应浓度硫辛酸预作用20 h,损伤组和给药组再加入H2O2与硫辛酸共作用4 h。
硫辛酸对H2O2损伤的细胞活力保护作用实验采用MTT的方法检测细胞活力,以1×105/孔的密度接种细胞于96孔培养板中,待细胞汇合率至80%时,按本研究方法给药处理,每孔加入10 μL MTT(5 g/L)继续培养4 h,然后加入三联液溶解生成的蓝紫色甲臜。用酶标仪测定570 nm的A值。实验重复3次。
细胞中SOD,MDA及细胞上清LDH测定以1×106/孔的密度接种细胞于24孔细胞培养板中,待细胞汇合率至80%时,按本研究方法给药处理后,按照相应试剂盒说明书测量并计算。
ALP活性检测以1×106/孔的密度接种细胞于24孔细胞培养板中,待细胞贴壁后,加入条件培养液(含50 g/L维生素C、10 nmol/L β-甘油磷酸钠的DMEM细胞培养液),在37 ℃、5% CO2的细胞培养箱中继续培养7 d,按本研究方法给药处理后,按照ALP试剂盒说明书测定细胞中ALP含量,BCA试剂盒测定蛋白总含量,并且按照ALP试剂盒说明书中提供的公式计算单位蛋白中ALP含量。
Von Kossa染色-矿化结节的测定以5×106/孔的密度接种细胞于6孔细胞培养板中,待细胞100%汇合,按本研究方法给药处理后,加入上述条件培养液,继续培养27 d。采用文献[10]方法进行Von Kossa染色。然后在低倍显微镜(×10)视野下每组随机选取7个视野,记录矿化结节数目,倒置显微镜(Olympus公司,日本)照相。
MC3T3-E1细胞内ROS水平的测定细胞内ROS水平采用DCFH-DA荧光探针进行检测,按本研究给药处理,按照试剂盒说明书处理细胞后,流式细胞仪(BD FACScalibur公司,美国)检测。
RT-PCR检测Nox4、Osterix、BMP-2、Ⅰ型胶原、骨钙素和护骨素/细胞核因子κB受体活化因子配基表达按照Trizol一步法提取总RNA,紫外分光光度计测量RNA浓度,并调至同一浓度1 g/L。使用反转录试剂盒,即Prime Script@ RT reagent Kit With gDNA Eraser(Perfect Real Time),取1 μL总RNA加入10 μL反应体系(含gDNA Eraser Buffer、gDNA Eraser、RNase Free dH2O),42 ℃,2 min,将总RNA反转录为cDNA。引物基因序列如表1所示,用PCR扩增反应试剂盒,即SYBR Premix Ex TaqTM(TIi RNaseH Plus)进行扩增反应:将2.0 μL cDNA加入到20 μL体系(含SYBR Premix Ex TaqTM,specific primers,ROX Referenxe DyeII,dH2O)。反应条件为:95 ℃变性30 s,退火95 ℃ 5 s,延伸60 ℃ 30 s。反应结束后根据Ct值,采用2-△△Ct定量分析法,以GAPDH作为内参基因进行计算和统计。
| 基因 | 引物序列(5′ → 3′) | 扩增片段长度(bp) |
| GAPDH | F:gaccacagtccatgccatcac | 424 |
| R:gctgttgaagtcgcaggagac | ||
| Nox4 | F:ctggtctgacgggtgtctgcatggtg | 413 |
| R:ctccgcacaataaaggcacaaaggtccag | ||
| OPG | F:ttacctggagatcgaattctgcttg | 143 |
| R:gtgctttcgatgaagtctcagctg | ||
| RANKL | F:gcagcatcgctctgttcctgta | 161 |
| R:cctgcaggagtcaggtagtgtgtc | ||
| Osterix | F:tggccatgctgactgcagcc | 137 |
| R:tgggtaggcgtcccccatgg | ||
| BMP-2 | F:tgaggattaggtctttg | 440 |
| R:cacaaccatgtcctgataat | ||
| COL-Ⅰ | F:gcatggccaagaagacatcc | 83 |
| R:cctcgggtttccacgtctc | ||
| OCN | F:ctggctgcgctctgtctct | 80 |
| R:tgcttggacatgaaggctttg | ||
| GAPDH:磷酸甘油醛脱氢酶; Nox4:NADPH氧化酶4; OPG:护骨素; RANKL:细胞核因子κB受体活化因子配基; Osterix:转录因子Osterix; BMP-2:骨形态发生蛋白2; COL-Ⅰ:成骨细胞内Ⅰ型胶原; OCN:骨钙素 | ||
实验数据用SPSS 13.0统计软件进行处理,用One-way ANOVA进行分析,数据以均数±标准差(x±s)表示。组间差异比较用单因素方差分析,以P<0.05为差异有统计学意义。
结 果 硫辛酸和H2O2浓度筛选及对H2O2损伤后细胞活力的影响硫辛酸及H2O2细胞毒性预实验结果显示,0.1~0.4 mmol/L硫辛酸无细胞毒性(P>0.05);1.0 mmol/L H2O2作用4 h细胞损伤率接近40%,作为本实验损伤条件(图1)。
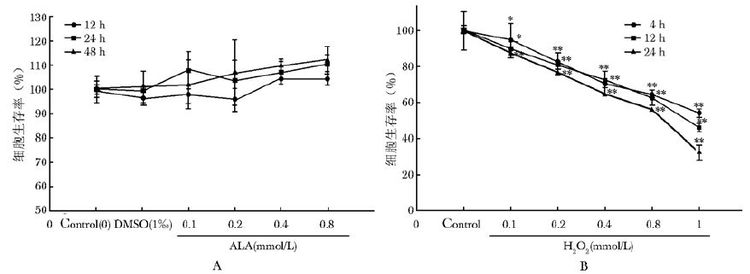
|
| 图1 硫辛酸和过氧化氢对MC3T3-E1细胞生存率的影响 Fig.1 Effects of ALA and H2O2 on survival rate of MC3T3-E1 cells A:硫辛酸12、24、48 h时间点;B:过氧化氢4、12、24 h时间点;ALA:硫辛酸;MC3T3-E1:小鼠前成骨细胞;与对照组比较 ,*P<0.05,**P<0.01 |
MTT结果表明,1.0 mmol/L H2O2处理4 h,细胞活力较空白对照组明显减少(P=0.000)。硫辛酸给药组剂量依赖性地上调细胞活力,中高剂量组与损伤组相比差异有统计学意义(P=0.027,P=0.002)(表2)。
| 组别 | A570 |
| Control | 0.762±0.097 |
| H2O2(1.0 mmol/L) | 0.486±0.070* |
| H2O2+ALA(0.10 mmol/L) | 0.491±0.059 |
| H2O2+ALA(0.20 mmol/L) | 0.588±0.028Δ |
| H2O2+ALA(0.40 mmol/L) | 0.685±0.034# |
| ALA:硫辛酸;与空白对照组比较,*P=0.0004;与H2O2组比较,ΔP=0.027,#P=0.002 | |
ALP是前成骨细胞早期分化的标志。MC3T3-E1细胞按本研究方法给药处理,经条件培养液培养7 d后,损伤组ALP活性明显下降(表3,P=0.008),与损伤组比较,差异有统计学意义(P=0.000)。用改良Von Kossa法染色后,可在显微镜下发现黑色的片状或点状矿化结节(图2),细胞培养27 d后空白对照组矿化结节开始形成并达到高峰期,损伤组矿化结节的面积和数量与空白对照组相比明显减少(P=0.009),而与损伤组比较,ALA明显促进矿化结节的产生(P=0.044,P=0.009)。
| 组别 | ALP activities(U/g) |
| Control | 89.28±7.82 |
| H2O2(1.0 mmol/L) | 45.10±4.32* |
| H2O2+ALA(0.10 mmol/L) | 49.61±15.04 |
| H2O2+ALA(0.20 mmol/L) | 77.27±21.28Δ |
| H2O2+ALA(0.40 mmol/L) | 97.16±12.94# |
| ALA:硫辛酸;ALP:碱性磷酸酶; 与空白对照组比较,*P=0.008;与H2O2组比较,ΔP<0.05,#P=0.000 | |
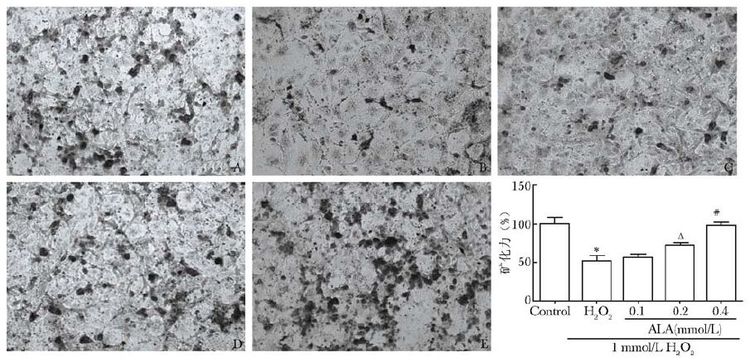
|
| 图2 硫辛酸对MC3T3-E1矿化能力的影响 Fig.2 Effect of ALA on MC3T3-E1 mineralization H2O2+0.1 mmol/L硫辛酸组(100×);D:H2O2+0.2 mmol/L硫辛酸组(100×);E:H2O2+0.4 mmol/L硫辛酸组(100×);ALA:硫辛酸; 与空白对照组比较,*P=0.009;与H2O2组比较,ΔP=0.044,#P=0.009 |
RT-PCR结果表明:与空白对照组相比,损伤组Osterix、COL-Ⅰ及OCN均呈下降趋势(P值分别为0.000,0.031,0.000),损伤组骨形态发生蛋白2(BMP-2)的变化不明显(P>0.05)。与损伤组相比,ALA剂量依赖性地上调Osterix、BMP-2、COL-Ⅰ及OCN mRNA表达(图3)。
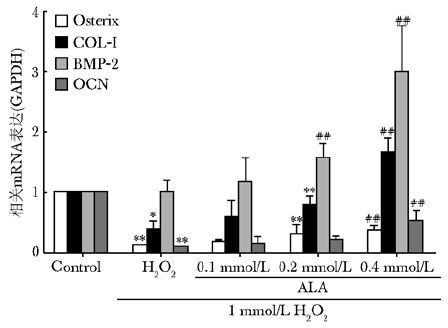
|
| 图3 硫辛酸对MC3T3-E1骨形成相关mRNA的影响 Fig.3 Effect of ALA on bone formation related mRNA of MC3T3-E1 ALA:硫辛酸;MC3T3-E1:小鼠前成骨细胞; 与空白组相比,*P<0.05,**P<0.01;与H2O2组比较,##P<0.01 |
与空白对照相比,损伤组细胞内SOD 活性明显降低(P=0.006)。与之相反,MDA含量(P=0.001)和LDH活性(P=0.002)则明显增加。与损伤组相比,ALA各浓度组细胞内SOD活性显著提高(P=0.008),细胞内MDA含量以及细胞培养液中LDH活性则明显下降(P=0.005,P=0.002)(表4)。
| 组别 | SOD活性(U/mg) | MDA含量(mmol/mg) | LDH活性(U/L) |
| Control | 146.88±5.41 | 4.29±0.20 | 32.56±9.30 |
| H2O2(1.0 mmol/L) | 90.63±23.59* | 12.04±3.21* | 63.57±11.71* |
| H2O2+ALA(0.10 mmol/L) | 121.89±21.13 | 10.19±2.12 | 62.02±14.21 |
| H2O2+ALA(0.20 mmol/L) | 143.75±43.19# | 9.72±1.39 | 37.21±12.31# |
| H2O2+ALA(0.40 mmol/L) | 132.50±35.05Δ | 3.24±1.60Δ | 10.85±2.69Δ |
| ALA:硫辛酸; 与空白组比较,*P<0.01; 与H2O2组比较,#P<0.05,ΔP=0.081,ΔP= 0.0045,ΔP=0.002 | |||
H2O2处理后,细胞内ROS水平与空白对照组相比明显升高(图4)(P=0.032),荧光波峰向右迁移。ALA处理后,荧光波峰向左侧回移,与损伤组相比,ROS水平明显下降(P=0.043,0.020)。
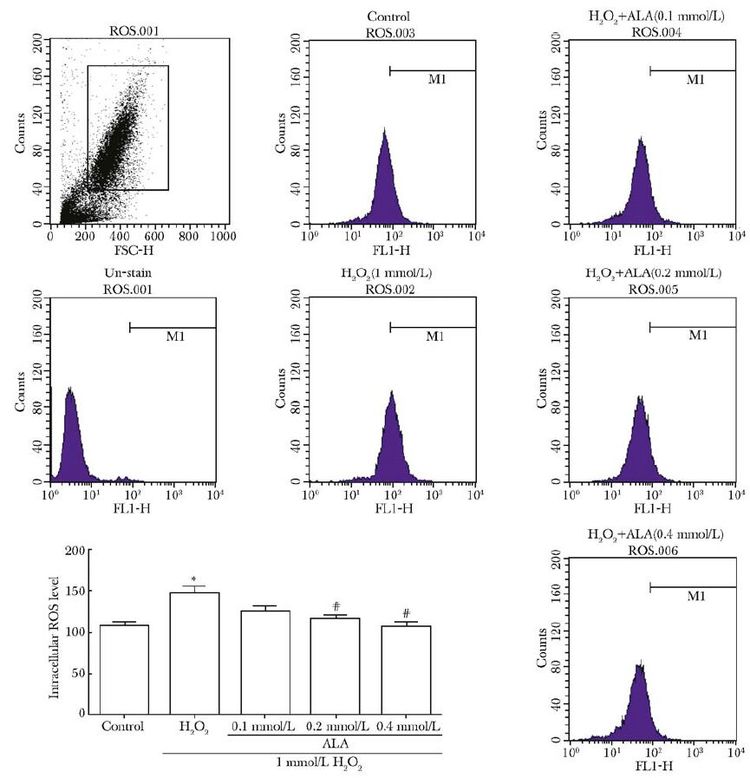
|
| 图4 硫辛酸对MC3T3-E1细胞内ROS的清除作用 Fig.4 Removal of ROS in MC3T3-E1 cells by ALA ALA:硫辛酸; 与空白组比较,*P<0.05;与H2O2组比较,#P<0.05 |
RT-PCR的结果表明:H2O2损伤组Nox4蛋白和mRNA的表达水平较空白对照组显著升高(P<0.01),而给药组剂量依赖性的降低Nox4 mRNA表达,并具差异有统计学意义(P<0.05或P<0.01)(图5)。
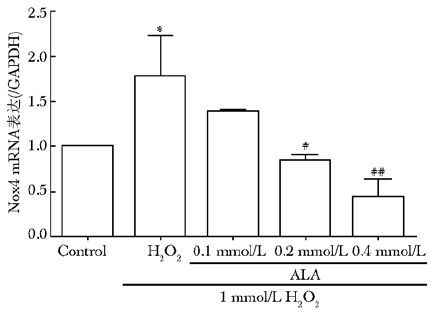
|
| 图5 硫辛酸对Nox4 mRNA表达水平的影响 Fig.5 Effect of ALA on the expression level of Nox4 mRNA ALA:硫辛酸; 与空白对照组比较,*P<0.01;与H2O2组比较,#P<0.05,##P<0.01; |
RT-PCR结果表明:与空白对照组相比,损伤组RANKL mRNA表达水平升高,OPG表达水平降低,OPG/RANKL 比值明显下降;给药组逆转了两者之间的变化,显著升高OPG/RANKL mRNA比值(图6)。
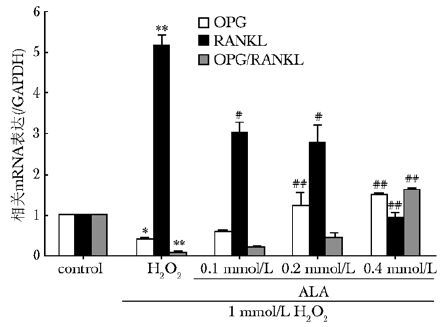
|
| 图6 硫辛酸对OPG,RANKL和OPG/RANKL mRNA表达水平的影响 Fig.6 Effect of ACA on the expression level of OPG,RANKL and OPG/RANKL mRNA OPG:护骨素; RANKL:细胞核因子κB受体活化因子配基; 与空白对照组比较,*P<0.05,**P<0.01;与H2O2组比较,#P<0.05,##P<0.01 |
氧化应激是骨质疏松重要的致病因素和危险因子。本实验主要研究抗氧化剂硫辛酸在成骨细胞介导的骨形成方向的作用。MC3T3-E1细胞作为研究体外成骨细胞分化的较好模型,具有单一定向成骨细胞分化的各种生物学特性,被广泛应用在成骨细胞的相关体外实验研究中[11]。本研究并非直接研究ALA对MC3T3-E1细胞的作用,而是用H2O2诱导MC3T3-E1细胞建立成骨细胞氧化应激模型,进行ALA抗氧化能力的研究。而氧化应激与衰老、激素水平降低、糖皮质激素等很多因素诱导的骨质疏松有关。
成骨细胞体外成骨过程大致可分为细胞增生分化、骨基质形成和成熟及骨基质矿化几个阶段。成骨细胞增生能力的降低、分化及矿化被抑制、凋亡细胞的数目增加都会使成骨细胞数量减少[12],骨形成水平降低,骨量减少。故促进体外培养成骨细胞成熟分化是评价抗骨质疏松药物的的主要研究方法。ALP和矿化结节分别是成骨细胞分化早期和分化成熟晚期的标志[13]; OCN、COL-Ⅰ和Osterix是骨形成过程重要的指标[14, 15]。BMP-2参与调节与成骨细胞分化和破骨细胞分化相关的基因表达[16]。鉴于此,本实验发现ALA能够加强钙盐的沉积,增强MC3T3-E1细胞的矿化能力,从而使矿化结节数量增加;同时实验还测定了上述4者基因在MC3T3-E1细胞中的表达水平,发现ALA显著反转H2O2导致的成骨细胞分化标志物ALP、COL-Ⅰ、OCN的下降趋势,上调ALP、COL-Ⅰ、OCN、BMP-2的表达,并激活转录因子Osterix。由此证明,ALA可以促进成骨细胞分化、矿化及成熟,进而促进骨形成过程。
在骨组织中,OPG作为一种诱饵受体,在成熟的成骨细胞上高表达,与破骨细胞表面的RANK竞争性地结合RANKL,从而抑制RANKL与破骨细胞表面的RANK结合,进而抑制破骨细胞的分化成熟[1]。因此,OPG/RANKL的比值是评价骨形成与骨吸收动态平衡的一个重要的标志[17, 18]。本实验结果表明,ALA可以剂量依赖性地上调OPG mRNA并下调RANKL mRNA的表达水平,明显地上调OPG/RANKL mRNA的比值。这表明硫辛酸可能通过调节OPG/RANKL通路维持正常的骨重塑过程,发挥促骨形成的作用。
Nox4,作为NADPH氧化酶家族成员之一,是ROS的主要来源[7]。近来研究证实Nox4也广泛分布在前成骨细胞中[16]。本实验结果表明,硫辛酸剂量依赖性地下调Nox4 mRNA表达水平,并降低胞内ROS的水平。由此推测,硫辛酸通过下调Nox4 mRNA表达水平清除胞内活性氧自由基,发挥抗氧化作用,保护H2O2诱导的氧化损伤。为了更好的证实硫辛酸下调Nox4表达和其清除ROS相关,可以用Nox4的阻断剂或者RNAi技术将Nox4基因沉默或者阻断进一步检测ROS水平,这是本实验有待深入研究的部分。
综上所述,本实验发现硫辛酸可以促进MC3T3-E1前成骨细胞分化、矿化和成熟,进而促进骨形成过程。同时,硫辛酸提高H2O2损伤后MC3T3-E1的细胞活力,提高MC3T3-E1细胞内抗氧化酶的活性,降低细胞内氧化应激水平,提高抗氧化水平,有效地防御与降低H2O2对成骨细胞的氧化损伤,提升成骨细胞中OPG/RANKL比值。提示其促MC3T3-E1细胞的矿化作用可能是通过下调Nox4基因的表达,清除ROS蓄积而发挥其强大的抗氧化作用实现的。本研究为硫辛酸可能用于骨质疏松的治疗提供了有力实验依据。
| [1] | Mccormick RK. Osteoporosis:integrating biomarkers and other diagnostic correlates into the management of bone fragility[J]. Altern Med Rev,2007,12:113-145. |
| [2] | Zuo C,Huang Y,Bajis R,et al. Osteoblastogenesis regulation signals in bone remodeling[J]. Osteoporosis Int,2012,23:1653-1663. |
| [3] | Laliberte MC,Perreault S,Jouini G,et al. Effectiveness of interventions to improve the detection and treatment of osteoporosis in primary care settings:a systematic review and meta-analysis[J]. Osteoporosis Int,2011,22:2743-2768. |
| [4] | Baek KH,Oh KW,Lee WY,et al. Association of oxidative stress with postmenopausal osteoporosis and the effects of hydrogen peroxide on osteoclast formation in human bone marrow cell cultures[J]. Calcified Tissue Int,2010,87:226-235. |
| [5] | Mody N,Parhami F,Sarafian TA,et al. Oxidative stress modulates osteoblastic differentiation of vascular and bone cells[J]. Free Radical Bio Med,2001,31:509-519. |
| [6] | Lean JM,Davies JT,Fuller,et al. A crucial role for thiol antioxidants in estrogen-deficiency bone loss[J]. J Clin Invest,2003,112:915-923. |
| [7] | Yong R,Chen XM,Shen S,et al. Plumbagin ameliorates diabetic nephropathy via interruption of pathways that include Nox4 signalling[J]. PLoS One,2013, 8:e73428. |
| [8] | Bilska A,Wlodek L. Lipoic acid-the drug of the future?[J]. Pharmacol Rep,2005,57:570-577. |
| [9] | Parveen R,Asghar A,Anjum FM,et al. Selective deposition of dietary alpha-Lipoic acid in mitochondrial fraction and its synergistic effect with alpha-Tocoperhol acetate on broiler meat oxidative stability[J]. Lipids Health Dis,2013,12:52. |
| [10] | 张春芳,吴珊,彭金咏,等. 薯蓣皂苷通过上调Lrp5、β-catenin表达促进成骨细胞MC3T3-E1增生、分化[J]. 中国药理学通报,2013,29:1255-1260. |
| [11] | Choi EM,Lee YS. Involvement of PI3K/Akt/CREB and redox changes in mitochondrial defect of osteoblastic MC3T3-E1 cells[J]. Toxicol Vitro,2011,25:1085-1088. |
| [12] | Armour KJ,Armour KE,VAN'T HR,et al. Activation of the inducible nitric oxide synthase pathway contributes to inflammation-induced osteoporosis by suppressing bone formation and causing osteoblast apoptosis[J]. Arthritis Rheumat,2001,44:2790-2796. |
| [13] | 韩桂秋,葛宝丰,陈克明,等. 金雀异黄酮对体外培养缺氧大鼠骨髓间充质干细胞增生与分化的影响[J]. 中国药学杂志,2011,46:1248-1253. |
| [14] | Collin P,Nefussi JR,Wetterwald A,et al. Expression of collagen,osteocalcin,and bone alkaline phosphatase in a mineralizing rat osteoblastic cell culture[J]. Calcified Tissue Int,1992,50:175-183. |
| [15] | 翟远坤,李志忠,陈克明,等. 淫羊藿素和脱水淫羊藿素对骨髓间充质干细胞成骨性分化影响的比较研究[J]. 中国药学杂志,2011,46:837-842. |
| [16] | Mandal CC,Ganapathy S,Gorin Y,et al. Reactive oxygen species derived from Nox4 mediate BMP2 gene transcription and osteoblast differentiation[J]. Biochem J,2011,433:393-402. |
| [17] | 仲蕾蕾,杨冰,黄晓斌,等. OPG/RANKL/RANK系统在成骨细胞和破骨细胞相互调节中的作用[J]. 中国骨质疏松杂志,2011,17:1010-1013. |
| [18] | Udagawa N,Takahashi N,Yasuda H,et al. Osteoprotegerin produced by osteoblasts is an important regulator in osteoclast development and function[J]. Endocrinology,2000,141:3478-3484. |
| (收稿日期:2015-11-13) |

