阻塞性睡眠呼吸暂停综合征 (obstructive sleep apnea syndrome, OSAS) 是临床常见的呼吸系统疾病,主要表现为反复发作的呼吸暂停、睡眠低氧、夜间打鼾。OSAS影响心血管、神经等多个系统,但临床较少关注其对骨代谢的不利影响。本文报告一例以“打鼾、困倦10年,反复胸痛2年”为主诉就诊的疑难病例,探讨OSAS与骨骼疾病间的关系,以引起临床医生对OSAS患者骨代谢异常重视。
病例摘要患者,男,38岁,打鼾、困倦10年,反复胸痛2年就诊。患者因打鼾、困倦,诊断为阻塞性睡眠呼吸暂停综合征 (obstructive sleep apnea syndrome,OSAS)10年,未接受治疗。2013年11月患者出现右胸部疼痛,服用布洛芬后缓解。2014年5月患者出现双侧胸痛,持续2月自行好转;2015年7月患者再次出现右侧胸痛,外院CT检查结果示“右第3肋骨、左第3~6肋骨多发骨折”,给予降钙素50 IU,1次/d,肌肉注射8 d,胸痛缓解。2015年10月患者打喷嚏后出现右胸疼痛、吸气受限,外院CT检查结果示“多发肋骨骨折”。起病以来,患者否认身高变矮,否认口渴、多饮,否认肉眼血尿、尿中排石。否认长期服用糖皮质激素、甲状腺激素及抗癫痫药史。二便正常,体质量无明显改变。
既往史:无特殊。
个人史:饮酒史21年,饮白酒250~500 g/d。
家族史:阴性。
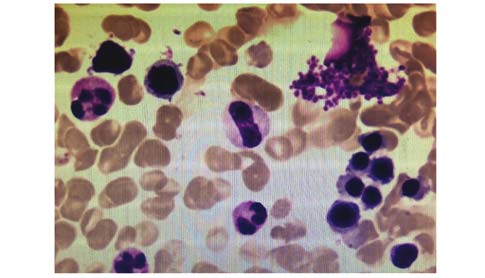
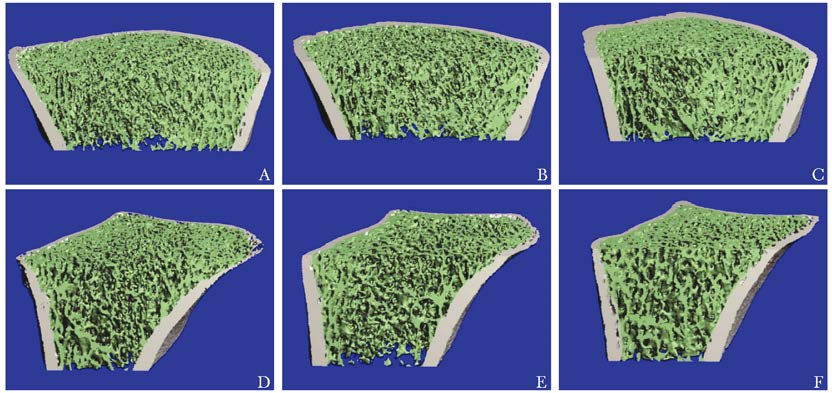
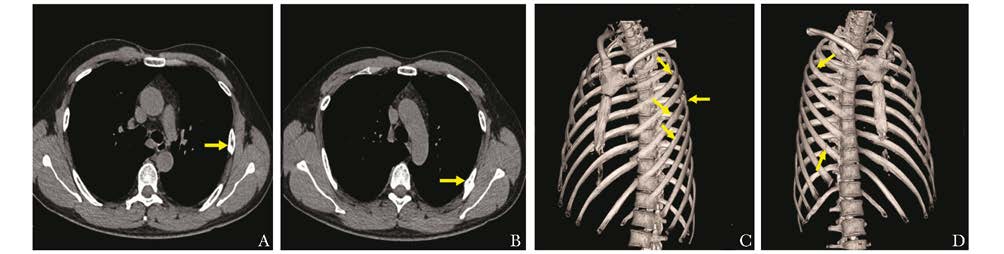
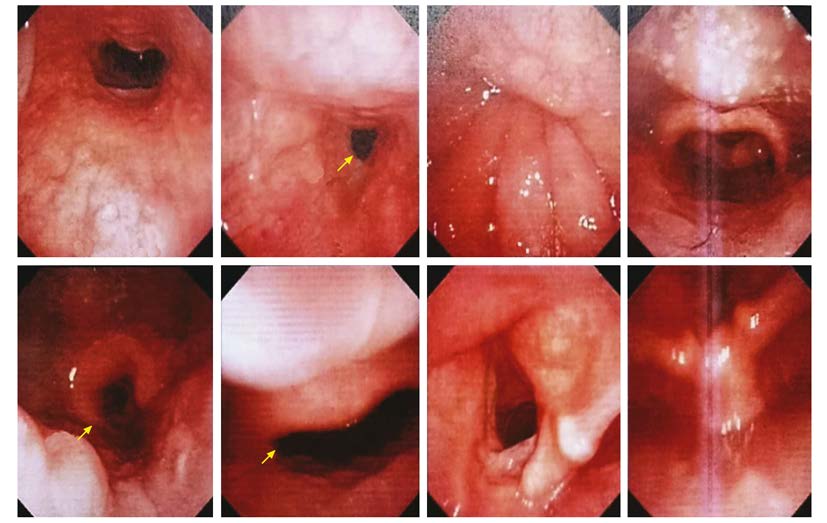
查体:血压140/100 mmHg (1 mmHg=0.133 kPa),肥胖体型,体质量指数 (body mass index,BMI) 27.7 kg/m2,一般状况好,甲状腺未及肿大,心率90次/min,心律齐,骨骼无明显畸形,胸廓挤压痛 (+),脊柱压叩痛 (-)。辅助检查:血常规、肝肾功、血沉正常;内分泌检查示维生素D缺乏,余骨生化指标正常 (表 1);多种自身抗体 (-);血尿免疫固定电泳正常,尿本周蛋白 (-);前列腺特异性抗原 (-)。骨髓细胞形态学:骨髓增生活跃,粒系、红系各阶段比例及形态大致正常,红细胞形态正常,淋巴细胞及单核细胞比例形态正常,核细胞及血小板不缺乏 (图 1)。双能X线骨吸收仪检查:腰椎2~4骨密度为1.167 g/cm2,Z值为0.4,股骨颈骨密度为1.006 g/cm2,Z值为0.3,全髋骨密度为1.121 g/cm2,Z值为0.9。高分辨外周定量CT (high-rese lection peripheral quantitative computed tomography,HR-pQCT) 测定桡骨、胫骨远端体积及骨微结构,与中国汉族健康青年男性比较,无明显差异 (图 2、表 2)。胸廓CT平扫+三维重建检查:右第3肋、左第5肋骨折;左第3、5、6肋局部形态改变 (图 3)。全身骨扫描:肋骨多处骨代谢异常活跃。PET/CT:多处肋骨骨折。多导睡眠图:最低血氧饱和度66.0%,呼吸暂停低通气指数35次/h,符合重度阻塞性OSAS,重度睡眠低氧。电子喉镜检查:咽腔狭窄 (图 4)。予以无创呼吸机治疗OSAS,同时给予碳酸钙1.5 g (含元素钙600 mg)/d、维生素D3乳剂3.75 U单位/月治疗。随访6个月,患者睡眠低氧情况改善,未再出现新骨折。
| 检查指标 | 结果 | 正常参考值 |
| 白细胞 (×109/L) | 3.64 | 4.00~10.00 |
| 红细胞 (×1012/L) | 5.12 | 4.00~5.50 |
| 血小板 (×109/L) | 284 | 100~350 |
| 血红蛋白 (g/L) | 170 ↑ | 120~160 |
| 淋巴细胞百分比 (%) | 43.1 ↑ | 20.0~40.0 |
| 单核细胞百分比 (%) | 5.2 | 3.0~8.0 |
| 中性粒细胞百分比 (%) | 48.7 | 50.0~75.0 |
| 丙氨酸氨基转移酶 (U/L) | 38 | 9~50 |
| 乳酸脱氢酶 (U/L) | 185 | 0~250 |
| 血钾 (mmol/L) | 4.1 | 3.5~5.5 |
| 血钠 (mmol/L) | 138 | 135~145 |
| 肌酐 (μmol/L) | 93 | 59~104 |
| 红细胞沉降率 (mm/h) | 1 | 0~15 |
| 促甲状腺激素 (mU/L) | 1.483 | 0.38~4.34 |
| 游离三碘甲状腺原氨酸 (pmol/L) | 5.07 | 2.77~6.31 |
| 游离甲状腺素 (pmol/L) | 17.80 | 10.45~24.38 |
| 促黄体生成素 (U/L) | 3.87 | 1.24~8.62 |
| 促卵泡激素 (U/L) | 8.00 | 1.27~19.26 |
| 雌二醇 (pmol/L) | 102.48 | <172.02 |
| 睾酮 (ng/L) | 4.11 | 1.75~7.81 |
| 血总皮质醇 (nmol/L) | 223.84 | 110.40~615.48 |
| 促肾上腺皮质激素 (ng/L) | 25.9 | 0~46 |
| 血钙 (mmol/L) | 2.39 | 2.13~2.70 |
| 血磷 (mmol/L) | 1.00 | 0.81~1.45 |
| 碱性磷酸酶 (U/L) | 76 | 45~125 |
| 甲状旁腺激素 (ng/L) | 16.4 | 12.0~65.0 |
| 25羟维生素D (mg/L) | 17.2 ↓ | 30.0~50.0 |
| β-CTX (mg/L) | 0.475 | 0.26~0.512 |
| 24h尿钙 (mmol /24 h) | 5.74 | 2.50~8.75 |
| 24h尿磷 (mmol /24 h) | 33.76 | 22.58~45.16 |
|
| 图 1 骨髓细胞形态学 Figure 1 Bone marrow cellular morphology |
|
| 图 2 骨高分辨外周定量CT Figure 2 Bone scan of high resolution peripheral quantitative computed tomography A:患者胫骨;B:对照1胫骨;C:对照2胫骨;D:患者桡骨;E:对照1桡骨;F:对照2桡骨 |
| 项目 | 桡骨 | 胫骨 | ||||
| 本患者 | 对照1 | 对照2 | 本患者 | 对照1 | 对照2 | |
| 骨总面积 (mm2) | 827.1 | 706.3 | 783.9 | 380.2 | 295.7 | 338.5 |
| 皮质骨面积 (mm2) | 145.8 | 166.1 | 152.4 | 76.1 | 75.4 | 84.7 |
| 骨小梁面积 (mm2) | 687.1 | 545.6 | 637.3 | 308.6 | 224.4 | 258.0 |
| 总体积骨密度 (mg HA/cm3) | 317.3 | 405.3 | 317.7 | 327.9 | 368.2 | 341.2 |
| 松质骨体积骨密度 (mg HA/cm3) | 182.7 | 237.7 | 174.0 | 197.4 | 199.7 | 161.5 |
| 皮质骨体积骨密度 (mg HA/cm3) | 955.9 | 954.9 | 927.3 | 862.6 | 872.5 | 899.9 |
| 骨小梁体积分数 | 0.278 | 0.340 | 0.265 | 0.288 | 0.299 | 0.249 |
| 骨小梁数量 (1/mm) | 1.395 | 1.329 | 1.214 | 1.515 | 1.458 | 1.325 |
| 骨小梁厚度 (mm) | 0.276 | 0.291 | 0.285 | 0.258 | 0.245 | 0.245 |
| 骨小梁间距 (mm) | 0.693 | 0.690 | 0.791 | 0.588 | 0.623 | 0.713 |
| 皮质骨厚度 (mm) | 1.455 | 1.889 | 1.576 | 1.056 | 1.154 | 1.222 |
| 皮质骨孔隙度 (%) | 0.009 | 0.030 | 0.014 | 0.005 | 0.018 | 0.007 |
| HR-pQCT:高分辨外周定量CT;对照1:男性,32岁;对照2:男性,35岁 | ||||||
|
| 图 3 胸部CT+三维重建 Figure 3 Chest CT and three-dimensional reconstruction A、B:左侧第5肋骨骨折 (箭头);C、D:左右侧多发肋骨骨折 (箭头) |
|
| 图 4 电子喉镜检查示咽腔狭窄 Figure 4 Pharyngeal stenosis indicated by electronic laryngoscope |
本例特点:青年男性,慢性病程。诊为重度OSAS 10年,未治疗。近2年来反复出现胸痛,影像学证实多发肋骨骨折。既往有长期大量饮酒史。辅助检查示维生素D缺乏,其他内分泌、免疫、血液系统相关生化指标均无异常。影像学:骨密度正常。生化检查及影像学未发现肿瘤性疾病证据。
患者为青年男性,罹患多发肋骨骨折,应进一步寻找骨折原因。首先,要考虑代谢性骨病的可能性。患者腰椎和髋部骨密度正常,不支持骨质疏松症诊断;患者无使用糖皮质激素史,也无内源性皮质醇增多症的临床表现,血尿皮质醇水平正常,糖皮质激素诱发性骨质疏松症证据不足;患者维生素D轻度缺乏,但血钙磷、碱性磷酸酶及甲状旁腺素水平正常,全身骨骼无畸形,因此骨软化症证据不足,维生素D缺乏难以解释患者疾病全貌。患者血钙磷、甲状旁腺素、骨转换生化指标水平正常,甲状旁腺功能亢进症、低血磷性骨软化症、骨纤维异样增生症等代谢性骨病无明显证据。其次,要排除肿瘤相关性骨骼病变的可能性。患者血尿轻链、前列腺特异性抗原等多项肿瘤标志物阴性,骨髓涂片及骨活检均无异常,PET-CT、骨扫描、胸廓三维重建等影像学检查除肋骨骨折外,无明显阳性发现,因此肿瘤相关的骨骼疾病证据不足。第三,要考虑慢性疾病所致的骨骼病变。患者肝、肾功能、抗核抗体无异常,不支持慢性肝、肾疾病及自身免疫性疾病所致的骨骼病变,患者无腹泻、吸收不良等病史,体型肥胖,不支持胃肠道疾病所致的骨骼病变。在排除上述多种疾病后,由于本例患者罹患严重OSAS 10年,骨折部位集中于肋骨,其他骨骼无受累,因此要考虑OSAS诱发疲劳性骨折的可能性。
OSAS并发肋骨疲劳性骨折少见,仅见于个案报道。Chakhtoura报道1例患严重OSAS的中年男性,剧烈咳嗽后发生多发肋骨骨折,进一步分析发现,肥胖和OSAS导致骨质疏松症是患者骨脆性增加的主要病因[1]。肋骨疲劳性骨折还多并发于慢性阻塞性肺疾病 (chronic obstructive pulmonary disease,COPD)、肺囊性纤维化、孕妇妊娠期,多为咳嗽和打喷嚏诱发;此外,健康成人剧烈咳嗽诱发肋骨骨折也并不罕见[2-6]。
OSAS是一种以反复发作的呼吸暂停、睡眠低氧、夜间打鼾为特征的呼吸疾病。多导睡眠监测显示患者每晚7 h睡眠中,呼吸暂停及低通气反复发作30次以上,或睡眠呼吸暂停低通气指数5次以上[7]。OSAS可导致胸廓负压增大、呼吸肌应力增加,对肋骨的影响包括:(1) 骨应力增加且过于集中。呼吸时上下前后应力变化的焦点主要集中在第6~8肋骨,该部位骨折发生率占78.4%[8]。(2) 肌肉疲劳、损伤。长期肌肉不协调收缩和肌肉疲劳失去对骨骼的保护也可能诱发疲劳性骨折,即“过度负重”理论和“肌肉疲劳”理论[9]。(3) 微小裂纹累积。当持续应力作用于骨时,可能产生微小裂纹,随着时间延长、微损伤累积,脆性骨折容易发生[10-11]。因此,OSAS使呼吸肌反复不协调收缩、肋骨应力集中以及肋骨微小裂纹产生,可能是肋骨疲劳性骨折的主要机制。
此外,大量研究证实OSAS与骨密度降低、骨折风险增加密切相关。台湾一项研究纳入了1 377例OSAS患者,随访6年发现其患骨质疏松症的风险是非OSAS人群的2.52倍[12]。Terzi等[13]研究纳入30例OSAS患者和20名健康对照者,OSAS患者股骨颈骨密度和T值明显偏低,血β-CTX水平显著高于对照组。进一步研究发现,OSAS可通过低氧和皮质醇节律改变影响骨代谢,还可因肥胖、性激素减少、瘦素分泌水平降低、氧化应激、维生素D缺乏和糖尿病等多方面因素影响骨代谢,降低骨强度[1]。尽管检查提示本例患者腰椎及髋部骨密度正常,胫骨和桡骨骨微结构正常,但由于目前检测手段有限,患者的骨强度改变,尤其是肋骨部位的骨强度,尚不清楚,值得今后进一步研究,以明确患者反复肋骨骨折的确切机制。
该患者既往长期大量饮酒,还应考虑饮酒与骨折的相关性。有Meta分析提示长期大量饮酒可增加髋部骨折风险[14]。长期饮白酒可降低男性腰椎骨密度,增加骨折风险[15]。饮酒一方面可直接增加跌倒诱发的骨折风险;另一方面可通过抑制间充质干细胞向成骨细胞分化、促进其向脂肪细胞分化、抑制成骨、促进骨吸收等机制,加速骨丢失,降低骨密度,增加骨折风险[16-17]。还有研究发现,饮白酒男性与对照组相比,全髋骨密度并无明显差别,但pQCT提示饮白酒男性桡骨远端的骨皮质变薄,皮质骨和小梁骨体积骨密度降低[18]。本例患者pQCT提示胫骨和桡骨体积骨密度及微结构无明显异常,且患者骨折部位均为肋骨,提示严重OSAS是导致患者肋骨骨折的主要原因。
肋骨疲劳性骨折的治疗包括去除病因、镇痛、适当外固定等[9]。本例患者针对肋骨骨折的病因,积极治疗原发病OSAS,给予无创气道正压通气,降低呼吸肌对肋骨的应力,并给予钙剂及维生素D治疗。随访6个月,患者鼾声减少,缺氧改善,胸痛明显好转,未再出现新骨折,提示治疗有一定的疗效。
通过对本例OSAS并发多发肋骨骨折疑难病例的鉴别诊断及治疗获得的启示是:OSAS是临床较常见的呼吸系统疾病,它不仅影响生活质量,对骨代谢也存在潜在的不利影响,其可以降低骨强度,并可能通过应力和微损伤诱发肋骨疲劳性骨折。在临床工作中,应关注OSAS对骨骼代谢的不良影响,积极治疗原发病。
| [1] | Nasrallah CM, Chami H. Bone loss in obesity and obstructive sleep apnea:a review of literature[J]. J Clin Sleep Med, 2015, 11 : 575–580. |
| [2] | Yeh CF, Su SC. Cough-induced rib fracture in a young healthy man[J]. J Formos Med Assoc, 2012, 111 : 179–180. DOI:10.1016/j.jfma.2011.07.020 |
| [3] | Hillenbrand A, Henne-Bruns D, Wurl P. Cough induced rib fracture, rupture of the diaphragm and abdminal herniation[J]. World J Emerg Surg, 2006, 1 : 34. DOI:10.1186/1749-7922-1-34 |
| [4] | Dean NC, Boerum DH, Liou TG. Rib plating of acute and sub-acute non-union rib fractures in an adult with cystic fibrosis:a case report[J]. BMC Research Notes, 2014, 7 : 681. DOI:10.1186/1756-0500-7-681 |
| [5] | Lehouck A, Boonen S, Decramer M, et al. COPD, bone metabolism, and osteoporosis[J]. Chest, 2011, 139 : 648–657. DOI:10.1378/chest.10-1427 |
| [6] | Misof BM, Moreira CA, Klaushofer K, et al. Skeletal implications of chronic obstructive pulmonary disease[J]. Curr Osteoporos Rep, 2016, 14 : 49–53. DOI:10.1007/s11914-016-0301-8 |
| [7] | Swanson CM, Shea SA, Stone KL, et al. Obstructive sleep apnea and metabolic bone disease:insights into the relationship between bone and sleep[J]. J Bone Miner Res, 2015, 30 : 199–211. DOI:10.1002/jbmr.2446 |
| [8] | McInnis KC, Ramey LN. High-risk stress fractures:diagnosis and management[J]. Am Acad Phys Med Rehabil, 2016, 8 : 113–124. |
| [9] | Matcuk GR, Mahanty SR, Skalski MR, et al. Stress fractures:pathophysiology, clinical presentation, imaging features, and treatment options[J]. Emerg Radiol, 2016, 23 : 365–375. DOI:10.1007/s10140-016-1390-5 |
| [10] | Uzkeser H, Yildirim K, Aktan B, et al. Bone mineral density in patients with obstructive sleep apnea syndrome[J]. Sleep Breath, 2013, 17 : 17–18. DOI:10.1007/s11325-012-0699-x |
| [11] | Goff MG, Lambers FM, Nguyenb TM, et al. Fatigue-induced microdamage in cancellous bone occurs distant from resorption cavities and trabecular surfaces[J]. Bone, 2015, 79 : 8–14. DOI:10.1016/j.bone.2015.05.020 |
| [12] | Chen YL, Weng SF, Shen YC, et al. Obstructive sleep apnea and risk of osteoporosis:a population-based cohort study in Taiwan[J]. J Clin Endocrinol Metab, 2014, 7 : 2441–2447. |
| [13] | Terzi R, Yilmaz Z. Bone mineral density and changes in bone metabolism in patients with obstructive sleep apnea syndrome[J]. J Bone Miner Metab, 2016, 34 : 475–481. DOI:10.1007/s00774-015-0691-1 |
| [14] | Zhang X, Yu Z, Yu M, et al. Alcohol consumption and hip fracture risk[J]. Osteoporos Int, 2015, 26 : 531–542. DOI:10.1007/s00198-014-2879-y |
| [15] | Kutleša Z, Mršic DB. Wine and bone health:a review[J]. J Bone Miner Metab, 2016, 34 : 11–22. DOI:10.1007/s00774-015-0660-8 |
| [16] | Liu Y, Kou XX, Chen C, et al. Chronic high dose alcohol induces osteopenia via activation of mTOR signaling in bone marrow mesenchymal stem cells[J]. Stem Cells, 2016, 34 : 2157–2168. DOI:10.1002/stem.2392 |
| [17] | Arteroa A, Arterob A, Tarínd JJ, et al. The impact of moderate wine consumption on health[J]. Maturitas, 2015, 80 : 3–13. DOI:10.1016/j.maturitas.2014.09.007 |
| [18] | Paccou J, Edwards MH, Ward K, et al. Relationships between bone geometry, volumetric bone mineral density and bone microarchitecture of the distal radius and tibia withalcohol consumption[J]. Bone, 2015, 78 : 122–129. DOI:10.1016/j.bone.2015.05.002 |
| (收稿日期:2016-06-01) |

