2. 350005 福州,福建医科大学附属第一医院骨科
2. Department of Orthopedics, The First Affiliated Hospital of Fujian Medical University, Fuzhou 350005, China
双膦酸盐作为骨吸收抑制剂,临床上常用于治疗骨质疏松及骨转移癌。股骨非典型骨折是长期使用双膦酸盐(bisphosphonates,BPs)后并发症,由Odvina等[1]首次报道,迄今为止,国内外已有大量相关报道[2-4]。现报道1例乳腺癌术后长期使用唑来膦酸治疗后被误诊为乳腺癌股骨转移的病例。
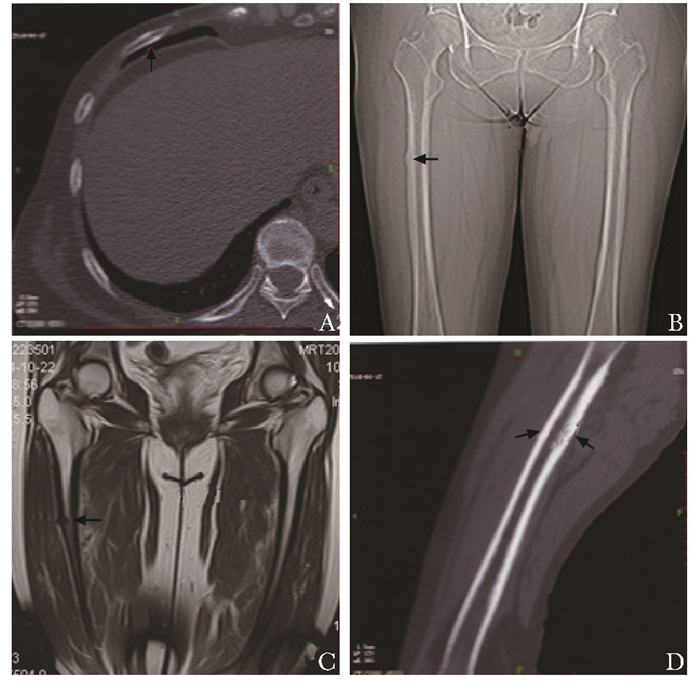
病例报告患者,女性,59岁,于2016年2月就诊福建医科大学附属第一医院骨科。该患者于1999年,因“右乳腺癌”行手术治疗。术后规律化疗及内分泌治疗。2009年,患者全身骨显像检查结果提示:右侧第5肋骨放射性异常浓聚(图 1A),肺部CT检查结果提示“右肋骨病变,不排除陈旧性骨折或转移瘤”。于外院静脉使用唑来膦酸(4 mg/月)规律治疗,2013年,患者开始出现右侧大腿疼痛,活动时加重,多次CT及磁共振检查结果均提示“右股骨中上段局限性骨皮质增厚,左侧股骨形态、大小及信号未见明显异常,周围未见占位”(图 1B、C),予镇痛等对症处理,病情无明显好转。2014年9月全身骨显像检查结果提示“右股骨中上段放射性异常浓聚”,外院考虑“不排除乳腺癌股骨转移”,予DT30Gy局部放射治疗10次后疼痛未见明显好转,遂加用“来曲唑”内分泌治疗。PET-CT检查结果示右股骨中段外侧皮质骨质密度增高,轻微代谢状态(图 1D)。血液检查肿瘤相关蛋白指标:AFP、CEA、CA153、CA125均阴性,肝、肾功能均正常,25羟维生素D (25 hydroxyvitamin D,25OHD)19.81 mg/L(参考值25~70 mg/L),血钙2.30 mmol/L(参考值2.25~2.75 mmol/L)、血磷1.58 mmol/L(参考值0.97~1.61 mmol/L),血碱性磷酸酶66 U/L(参考值40~110 U/L)。骨代谢指标提示:低骨转化状态,血清Ⅰ型原胶原氨基端肽(procollagen type 1 N-terminal propeptide,P1NP)11.94 mg/L(参考值14.28~58.92 mg/L)、血清N端骨钙素降解产物(serum N-terminal midfragment osteocalcin,N-MID OC)9.89 mg/L(参考值15~46 mg/L)。
|
| 图 1 患者骨折前影像学异常表现 Figure 1 Imaging abnormalities before fracture in patients A:CT显示右侧第5肋骨异常信号影(箭头);B:患者骨折前的CT图像,右中股骨外侧皮质明显增厚;C:患者骨折前MRI图像;D:患者骨折前PET-CT图像,显示股骨上段骨质浓度较高(箭头) |
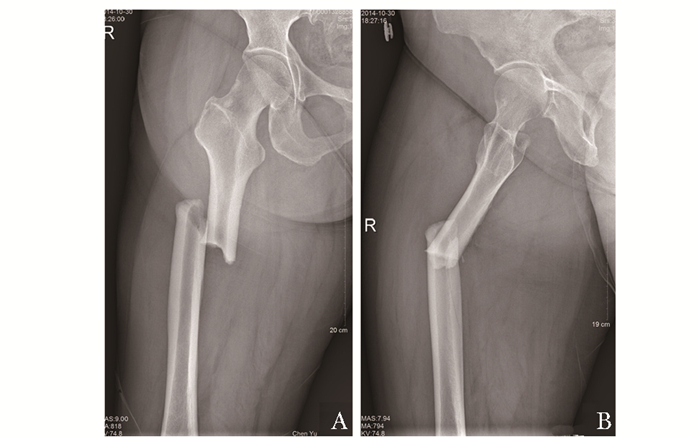
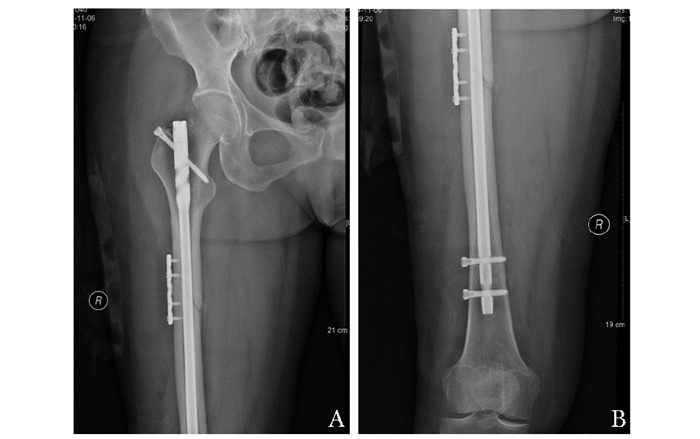
2014年11月,患者坐车时轻微扭伤,致右股骨小转子短螺旋形骨折(图 2A、B),于外院诊断为“右股骨病理性骨折”,伤后3 d行“右股骨骨折切开复位+髓内钉、钢板内固定术”(图 3A、B),术中送检右股骨髓腔、骨折端碎块状病灶组织病理结果均未见肿瘤或异常增生。术后仍使用双膦酸盐,术后2个月起部分负重行走,多次X线检查均提示骨折端未见明显骨痂生长。
|
| 图 2 患者骨折后股骨正位片 Figure 2 Patient's femoral film A:右股骨小转子下约5cm处短螺旋性骨折,骨折远端外侧皮质可见明显增厚,骨折完全移位,周围无明显骨折块;B:骨折后右股骨侧位片,骨折完全移位并向外侧成角 |
|
| 图 3 患者初次术后股骨正位片 Figure 3 Femoral films after the initial operation A:患者予髓内钉+骨折部位锁定钢板固定,髓内钉上缘螺钉由大转子指向股骨距;B:髓内钉远端2枚螺钉固定 |
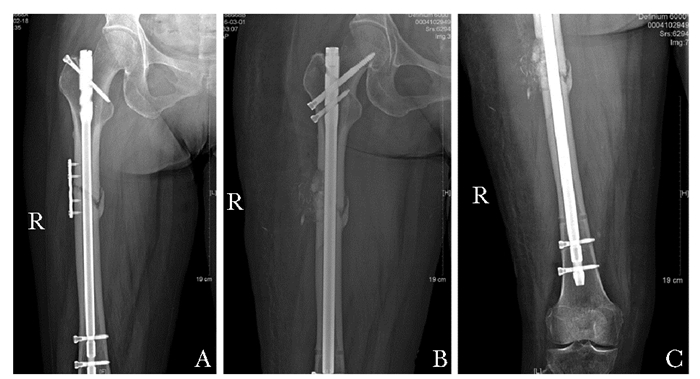
2016年2月以“右股骨骨折术后不愈合,右侧股骨非典型骨折,左侧股骨皮质增厚”收住本院。入院后停用唑来膦酸和内分泌治疗,予完善右股骨正侧位片(图 4A),肝、肾功能及凝血功能等相关术前检查后再次手术,术中见右股骨小粗隆下5 cm处局部纤维骨痂形成,骨折端骨质硬化,术中冰冻病理检查提示未见肿瘤组织。去除所有内固定物,清理骨折端纤维组织及硬化骨。逐级扩髓后植入11 mm、比原钉长2 cm的髓内钉,近端改为头颈锁定螺钉,远端避开原钉孔平行植入两枚锁定螺钉,取自体髂嵴松质骨植于断端处。术后病理显示:送检髓腔组织可见大量纤维骨质,余组织可见紊乱骨小梁,未见肿瘤组织。术后X线片提示内固定位置正确,骨折对位对线良好(图 4B、C)。术后口服骨化三醇胶丸0.25 μg/d及钙剂600 mg/d,术后第2天开始在康复医生指导下扶助行器下肢部分负重功能锻炼,术后5 d出院,继续康复治疗。
|
| 图 4 患者二次术前右股骨正位片 Figure 4 Femoral films before the second operation A:内固定均在位,无明显松动,骨折线清晰,对位对线尚可,周围可见小骨片;B:二次术后股骨正位片,图像可见更换髓内固定装置,髓内钉近端2枚螺钉固定,螺钉远端指向股骨头,骨折部位固定钢板移除,周围可见植骨;C:股骨髓内钉远端2枚螺钉固定,位置较初次手术靠近股骨远端 |
患者术后于福建医科大学附属第一医院门诊规律随访,评估症状、功能和X线片检查(图 5),翻修术后18个月,2017年8月复诊结果:双侧大腿无疼痛,右股骨骨折线消失,已达骨性愈合,步态正常,Barthel评分100分。2018年2月再次复诊,未感疼痛等不适,步态如常。
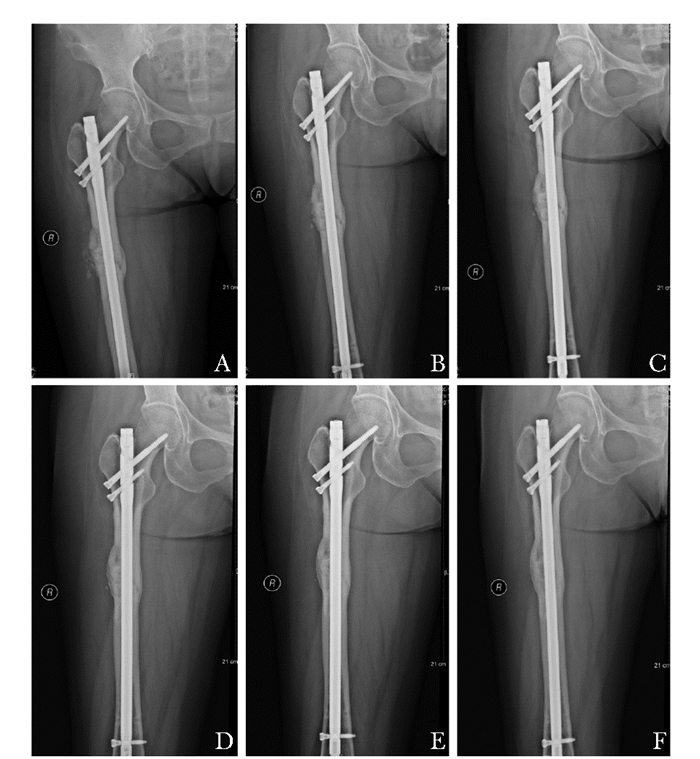
|
| 图 5 患者二次术后股骨正位片 Figure 5 Femoral films after the second operation A:内固定在位,骨折端多发斑片状骨碎片影,骨痂形成,骨折线较前模糊,对位、对线良好;B~D:二次术后6、9、12个月右股骨正位片,图像提示骨折线较前模糊,骨痂较前增多(图B骨折线较前模糊,纤维骨痂形成、图C骨折线较前进一步模糊、图D骨折线几乎消失);E:骨折二次术后18个月右股骨正位片,骨痂已包绕原骨折部位;F:患者二次术后2年随访右股骨正位片,影像提示骨痂完全包绕,骨折愈合良好 |
非典型股骨骨折(atypical femoral fractures,AFF)[1, 5]指长期使用BPs情况下,低能量损伤或无明显外伤条件下,发生于股骨粗隆下或股骨干部分的脆性骨折。区别于常见的“典型”髋部骨折或股骨干骨折,该类型骨折被定义为“非典型”[6-8]。
AFF的诊断目前普遍使用2014年美国骨矿盐研究学会(American Society for Bone and Mineral Research,ASBMR)提出的诊断标准,包括5项主要特征和4项次要特征,符合4项以上主要特征才能诊断。其中影像学表现最为重要,包含:早期影像学检查可见不完全骨折或仅出现局部骨皮质隆起、增厚,X线片检查结果提示股骨转子下或股骨干简单横行、斜行或短螺旋形骨折,内侧皮质断端尖锐突出,外侧皮质断端增厚、硬化,局部可见“鸟嘴”样改变[9-10]。无诱因出现患侧大腿疼痛是最常见且重要的临床表现,70%的AFF患者有此症状。低能量损伤甚至无外力情况下发生股骨粗隆下至股骨近1/3内的骨折则需高度怀疑AFF[11]。
内固定方式及骨折术后不愈合原因分析大多数文献均认为髓内固定装置是治疗AFF首选固定方法[12-13]。髓外固定的失败率相对高。Teo等[14]报道称,AFF术后内植入物失败率为23%,髓外固定组假体失败率和翻修率均比髓内固定组高(假体失败率:髓外29%、髓内11%;翻修率:髓外38%、髓内22%)。有文献报道采用髓内钉固定成功率可达98%~99%[15-16]。但本例患者在骨折后行切开复位、顺行髓股骨内钉,外加锁定钢板内固定术,出现骨不愈合,考虑与以下原因有关:(1)采用的内固定方式可能不合适,初次手术时采用髓内钉联合锁定钢板髓外固定,骨折部位绝对固定,而AFF骨折髓内钉弹性固定术后,本身延迟愈合甚至骨不连的发病率较高;(2)术后未考虑AFF可能,仍继续使用BPs,研究认为BPs可通过抑制骨吸收影响早期软骨痂重建,造成骨折延迟愈合[17],而且BPs还会通过抑制骨转化干扰板层骨的正常改建和塑形[18-19];(3)尽管良好的复位对于AFF的骨折愈合至关重要[20],但切开复位意味着对骨折部分骨膜血运的干扰,同时外侧钢板还可能造成局部应力遮挡,这进一步增加了AFF骨不愈合的概率;(4)手术前放射治疗,通过抑制成骨细胞活性和血管新生形成,也会极大影响骨折愈合[21]。
对于AFF术后骨不愈合的治疗方法报道不一,包括皮下注射PTH类似物特立帕肽、局部使用超声刺激骨生长[22]、使用髓内钉或钢板翻修[20]等。由于本例患者在首次术后2年仍未有骨愈合迹象,所以决定采用翻修手术。在去除钢板、更换髓内钉并于骨折端植入自体骨后,术后3个月即显示骨痂生长良好,但翻修术后骨折完全愈合时间长达1年。多数报道显示,AFF的骨愈合时间较典型股骨骨折更长,平均愈合时间为5~10个月[14, 23]。鉴于本例患者已行翻修术,愈合时间长也是合理的。由于缺乏RCT研究结果,AFF术后在使用维生素D和钙剂基础上是否加用PTH治疗目前意见不一[21],而本例患者未联合PTH就获得了骨愈合。
误诊、误治原因分析本例为乳腺癌患者,长期使用BPs和内分泌治疗,骨折前出现长时间右大腿外侧疼痛,反复多次就诊多家医院,影像学检查结果均提示右股骨中上段局限性骨皮质增厚及不全骨折,因均未考虑是BPs导致的股骨皮质增厚及裂纹骨折,未详细追问BPs使用史,仅根据影像报告结果,而错误给予大腿局部放射治疗。
股骨骨折后的影像学改变和临床表现完全符合ASBMR的AFF诊断标准,初次术中病理未发现肿瘤病变,因此AFF的诊断是明确的。患者第一次术后外院仍考虑肿瘤病理性骨折,由于未考虑是股骨AFF,患者继续使用BPs治疗。股骨骨折术后辗转多家医院,诊断为骨折不愈合,仍未考虑股骨AFF,继续使用BPs治疗。后患者出现对侧大腿疼痛,影像学检查提示左侧股股外侧皮质增厚。仍未正确诊断股骨非典型骨折。
患者2016年确诊为AFF后,停用BPs治疗,再次手术,更换髓内钉和自体植骨后,随访18个月年,骨折愈合,对侧大腿疼痛消失,整个病程中也排除了肿瘤骨转移。
因AFF骨折部位及受伤时外力与低暴力转子下骨折相似,临床上部分AFF患者被误诊。Goh等[11]曾对13例低暴力转子下骨折的女性患者进行病例对照研究,发现除有无BPs服用史差别明显外,其余症状在低暴力转子下骨折与AFF组间大致相仿。但随着BPs的广泛应用,对BPs相关的AFF的研究增多,AFF误诊的报道已逐渐减少,AFF被误诊为肿瘤病变更为罕见。Van de Laarschot等[23]报道1例乳腺癌患者在辅助化疗过程中使用口服BPs和芳香酶抑制剂时出现双侧大腿痛病例,该患者同样被诊断乳腺癌骨转移,并接受放射治疗,但最终诊断为AFF,但未发生骨折。
本病例的误诊可能与以下因素有关:(1)患者有乳腺癌病史,又长期就诊肿瘤科,医生容易过分关注肿瘤相关的病因;(2)BPs在中国的广泛应用时间相对较短,肿瘤科医师对BPs的长期应用经验少,骨科医师对BPs可能的不良反应了解不足;(3)影像科医生对本病认识不足,在未能获取足够的病史资料情况下极易漏诊AFF[24]。
综上,本文报道了1例长期使用唑来膦酸治疗的乳腺癌术后患者,因大腿疼痛被误诊为乳腺癌骨转移,接受局部放射治疗后疼痛加重,最终于轻微暴力下发生AFF,经髓内钉联合髓外锁定钢板固定手术,手术后15个月骨折不愈合。经过修正诊断为BPs相关的AFF,停用BPs药物,采用更换髓内钉和植骨等方法治疗,18个月后骨折完全愈合。在患者长期使用BPs出现无诱因大腿疼痛时,应首先考虑BPs相关的股骨皮质增厚病变以及不全,如果在轻微外伤后出现股骨上段骨折,应考虑AFF的可能,需要进行正确的影像学检查及解读,避免不恰当的治疗。AFF发生后的治疗应首选闭合复位及髓内固定,术后适当延长负重时间,以减少骨折不愈合及骨不连的发生。当因骨不愈合或内固定失败翻修时,仍应首先采用髓内固定方式,并行局部自体植骨,增加骨折愈合的成功率。
| [1] | Odvina CV, Zerwekh JE, Rao DS, et al. Severely suppressed bone turnover: a potential complication of alendronate therapy[J]. J Clin Endocrinol Metab, 2005, 90: 1294–1301. DOI:10.1210/jc.2004-0952 |
| [2] | Bjorgul K, Reigstad A. Atypical fracture of the ulna associated with alendronate use[J]. Acta Orthop, 2011, 82: 761–763. DOI:10.3109/17453674.2011.636676 |
| [3] | Jamal SA, Dion N, Ste-Marie LG. Atypical femoral fractures and bone turnover[J]. N Engl J Med, 2011, 365: 1261–1262. DOI:10.1056/NEJMc1107029 |
| [4] | 丁悦, 余楠生, 官志平. 双膦酸盐相关性非典型骨折:病例报告及文献复习[J]. 中华骨质疏松和骨矿盐疾病杂志, 2012, 5: 230–232. |
| [5] | Gunawardena I, Baxter M, Rasekh Y. Bisphosphonate-related subtrochanteric femoral fractures[J]. Am J Geriatr Pharmacother, 2011, 9: 194–198. DOI:10.1016/j.amjopharm.2011.02.009 |
| [6] | Sellmeyer DE. Atypical fractures as a potential complication of long-term bisphosphonate therapy[J]. JAMA, 2010, 304: 1480–1484. DOI:10.1001/jama.2010.1360 |
| [7] | Shane E, Burr D, Ebeling PR, et al. Atypical subtrochanteric and diaphyseal femoral fractures: report of a task force of the American Society for Bone and Mineral Research[J]. J Bone Miner Res, 2010, 25: 2267–2294. DOI:10.1002/jbmr.253 |
| [8] | Shane E, Burr D, Abrahamsen B, et al. Atypical subtrochanteric and diaphyseal femoral fractures: second report of a task force of the American Society for Bone and Mineral Research[J]. J Bone Miner Res, 2014, 29: 1–23. DOI:10.1002/jbmr.1998 |
| [9] | Kwek EB, Goh SK, Koh JS, et al. An emerging pattern of subtrochanteric stress fractures: a long-term complication of alendronate therapy?[J]. Injury, 2008, 39: 224–231. DOI:10.1016/j.injury.2007.08.036 |
| [10] | Neviaser AS, Lane JM, Lenart BA, et al. Low-energy femoral shaft fractures associated with alendronate use[J]. J Orthop Trauma, 2008, 22: 346–350. DOI:10.1097/BOT.0b013e318172841c |
| [11] | Goh SK, Yang KY, Koh JS, et al. Subtrochanteric insufficiency fractures in patients on alendronate therapy: a caution[J]. J Bone Joint Surg Br, 2007, 89: 349–353. |
| [12] | Das De S, Setiobudi T, Shen L, et al. A rational approach to management of alendronate-related subtrochanteric fractures[J]. J Bone Joint Surg Br, 2010, 92: 679–686. |
| [13] | Yoon RS, Beebe KS, Benevenia J. Prophylactic bilateral intramedullary femoral nails for bisphospho-nate-associated signs of impending subtrochanteric hip fracture[J]. Orthopedics, 2010, 33: 4. |
| [14] | Teo BJ, Koh JS, Goh SK, et al. Post-operative outcomes of atypical femoral subtrochanteric fracture in patients on bisphosphonate therapy[J]. Bone Joint J, 2014, 96-B: 658–664. DOI:10.1302/0301-620X.96B5.32887 |
| [15] | Winquist RA, Hansen ST Jr, Clawson DK. Closed intramedullary nailing of femoral fractures. A report of five hundred and twenty cases[J]. J Bone Joint Surg Am, 1984, 66: 529–539. DOI:10.2106/00004623-198466040-00006 |
| [16] | Tornetta P 3rd, Tiburzi D. Antegrade or retrograde reamed femoral nailing. A prospective, randomised trial[J]. J Bone Joint Surg Br, 2000, 82: 652–654. |
| [17] | Geusens P. Bisphosphonates for postmenopausal osteoporosis: determining duration of treatment[J]. Curr Osteoporos Rep, 2009, 7: 12–17. DOI:10.1007/s11914-009-0003-6 |
| [18] | Madsen JE, Berg-Larsen T, Kirkeby OJ, et al. No adverse effects of clodronate on fracture healing in rats[J]. Acta Orthop Scand, 1998, 69: 532–536. DOI:10.3109/17453679808997793 |
| [19] | Koivukangas A, Tuukkanen J, Kippo K, et al. Long-term administration of clodronate does not prevent fracture healing in rats[J]. Clin Orthop Relat Res, 2003: 268–278. |
| [20] | Cho JW, Oh CW, Leung F, et al. Healing of atypical subtrochanteric femur fractures after cephalomedullary nailing: which factors predict union?[J]. J Orthop Trauma, 2017, 31: 138–145. DOI:10.1097/BOT.0000000000000743 |
| [21] | Blood T, Feller RJ, Cohen E, et al. Atypical fractures of the femur: evaluation and treatment[J]. JBJS Rev, 2015, 3: pii. |
| [22] | Phillips HK, Harrison SJ, Akrawi H, et al. Retrospective review of patients with atypical bisphosphonate related proximal femoral fractures[J]. Injury, 2017, 48: 1159–1164. DOI:10.1016/j.injury.2017.03.025 |
| [23] | Van De Laarschot DM, Somford MP, Jager A, et al. "Atypical" atypical femur fractures and use of bisphosphonates[J]. Clin Cases Miner Bone Metab, 2016, 13: 204–208. |
| [24] | Warren C, Gilchrist N, Coates M, et al. Atypical subtrochanteric fractures, bisphosphonates, blinded radiological review[J]. ANZ J Surg, 2012, 82: 908–912. DOI:10.1111/j.1445-2197.2012.06199.x |
| (收稿日期:2019-04-15) |

