颅骨锁骨发育不全综合征(cleidocranial dysplasia,CCD)又称Marie-Sainton综合征,是一种罕见的遗传性全身骨骼发育不良性疾病,多为常染色体显性遗传,外显率很高。该病由Martin于1765年首次报道,临床发病率约为1:1 00万,男女发病率无明显差别[1]。其主要发病机制为膜内成骨及软骨化骨障碍,主要临床特征为锁骨发育不良,颅骨畸形、囟门不闭合或闭合延迟、颅缝增宽,身材矮小,乳牙滞留、恒牙迟萌或阻生,还可伴有脊柱侧弯、胸廓畸形等表现[2]。研究已证实CCD致病基因为编码成骨细胞特异性转录因子(runt-related transcription factor 2, RUNX2) 的RUNX2基因[3-4],其编码蛋白可促进成骨细胞和软骨细胞的分化,对于维持骨骼正常生长发育十分重要。RUNX2基因突变导致的单倍体不足是CCD的主要致病原因[5]。
本研究对北京协和医院诊治的2例CCD患者及其家属进行了RUNX2基因突变检测。总结并分析2例CCD患者的临床特征、生物化学及影像学特点,明确其RUNX2基因突变位点,为开展基因诊断、遗传咨询和产前诊断提供依据。
对象和方法研究对象
收集2010年3月至2014年8月于北京协和医院内分泌科确诊的2例CCD患者的临床资料,均为散发病例,无家族史,父母非近亲结婚。所有受试者均签署知情同意书。
研究方法
临床诊断:对患者进行病史采集,体格检查,观察牙齿及颌面发育情况,常规血液生物化学检测,拍摄头颅正侧位、胸部正位及双手正位X线片,建立病历档案。
DNA提取:标本采集留取2例患者及其家属外周静脉血各2 mL,乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)抗凝处理。采用Qiagen外周血白细胞DNA快速提取试剂盒(德国)提取基因组DNA。用紫外分光光度仪检测DNA浓度及纯度,-80℃保存备用。
聚合酶链式反应(polymerase chain reaction,PCR)扩增和基因测序:根据参考文献[6]设计8对引物对RUNX2基因外显子及其剪接区进行PCR扩增,扩增区域覆盖RUNX2基因全部外显子及其剪接区,引物由北京天一辉远生物科技有限公司合成。PCR反应采用30 μL反应体系,上下游引物各1.2 μL(浓度10 pmol/L),模板DNA约60 ng(2.6 μL),2×Taq PCR MasterMix 15 μL(北京康为世纪生物科技有限公司),加ddH2O 10 μL至反应体系30 μL。PCR反应条件为95 ℃预变性5 min,(95 ℃变性30 s,53.5 ℃~58.0 ℃温度梯度退火30 s,72℃延伸1 min)×35个循环,72 ℃末次延伸10 min。
将扩增后的PCR产物置于2%琼脂糖凝胶(含1%溴化乙锭)中电泳进行鉴定。PCR扩增产物送至北京擎科新业生物技术公司进行双向测序。测序结果使用Genbank和加州大学圣克普兹分校(University of California at Santa Cruz,UCSC)数据库进行比对分析。
结果2例CCD患者的临床特征
2例患者均为散发病例,都具有囟门未闭、颅骨畸形、颅缝增宽、锁骨发育不全、牙齿发育异常及身材矮小等CCD的典型临床特征。
患者1,女,就诊年龄57岁,足月顺产。患者自幼身材矮小,现身高138 cm,智力正常。体格检查可见颅面比例失调,额大面小,双顶径增宽;前囟未闭,颅骨顶部有一较大缺如,约7 cm×5 cm;眼距增宽,眼裂下斜;肩窄且下垂,肩关节活动度增大,双肩可向胸前聚拢(图 1A);胸廓呈桶状胸;手指末节短小,指甲小,足趾短。口腔检查可见硬腭高狭,牙列不齐,自20岁左右开始出现牙齿脱落(图 1B)。X线检查:头颅形态失常,颅骨板障厚薄不均,多处正常颅骨板障结构缺如,顶部可见大量缝间骨(图 1C);可见牙齿脱落及多生牙阻生(图 1D);双侧锁骨形态异常,左侧锁骨外1/3缺如,右侧锁骨外1/2缺如,较左侧短小(图 1E、F);双手相示骨质稀疏,中节指骨增粗变短,以示指及小指为著(图 1G);胸正位相示脊柱侧弯(图 1E、F)。血液生物化学和骨转换指标未见明显异常(表 1)。
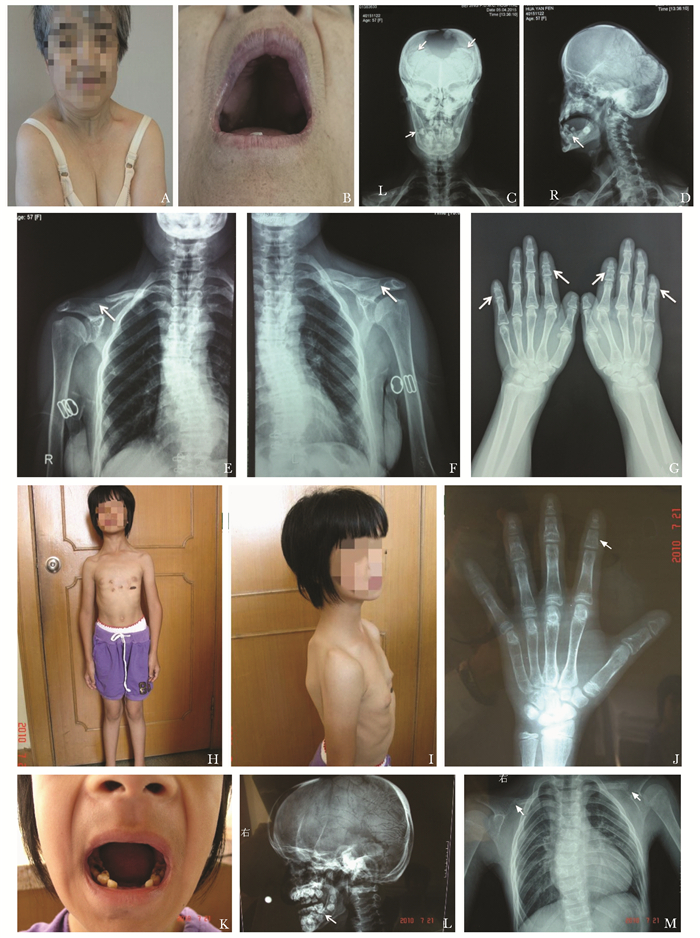
|
| 图 1 两例CCD患者临床及X线表现 Figure 1 Clinical features and X-rays films of two patients with CCD 患者1:A~G;患者2:H~M;A:颅大面小,肩窄且活动度增加;B:高腭弓,牙齿脱落;C、D:颅骨缺损(图C箭头),有多生牙(图C, D箭头);E、F:锁骨外侧缺失(箭头),脊柱侧弯;G:中节指骨增粗变短(箭头),以示指和小指为著;H:肩窄下垂,膝外翻;I:漏斗胸;J:中节指骨增粗变短(箭头);K:乳牙黄,伴龋齿;L:前囟未闭,牙齿阻生(箭头);M:锁骨外侧缺失(箭头),脊柱侧弯; CCD:颅骨锁骨发育不全综合征 |
| 指标 | Ca(mmol/L) | P(mmol/L) | ALP(U/L) | PTH(ng/L) | β-CTX(μg/L) | 25OHD(nmol/L) |
| 患者1 | 2.33 | 1.01 | 52 | 44.5 | 0.399 | 31.75 |
| 患者2 | 2.53 | 1.37 | 185 | 47.9 | - | 37 |
| 正常参考范围(成人) | 2.13~2.70 | 0.81~1.45 | 50~135 | 12.0~65.0 | 0.21~0.44 | 75~125 |
| CCD:颅骨锁骨发育不全综合征; Ca:钙;P:磷;ALP:碱性磷酸酶;PTH:甲状旁腺素;β-CTX:β甲胶原降解产物测定;25OHD:25-羟维生素D | ||||||
患者2,女,就诊年龄13岁,足月顺产,母亲有孕期感冒服药史。自幼出牙说话同正常同龄儿,身高较同龄儿矮小。患儿于5岁时曾行漏斗胸手术,9岁、12岁分别出现2次骨折(足踝及右前臂),自幼易患感冒。查体身高134 cm,位于同年龄同性别儿童第3百分位以下,智力正常。患者颅面比失调,自小头围较同龄儿大,前额较大;前囟未闭约4 cm×3 cm;眼距宽,眼裂下斜;腭弓高狭;双肩窄并下垂(图 1H);胸廓畸形,胸骨向内凹陷,呈漏斗胸(图 1I);双下肢畸形,膝外翻(图 1H);手指第二节增粗(图 1J),足趾短。无串珠肋及手镯征。11岁乳牙脱落后至今恒牙未萌出;乳牙黄,有龋齿(图 1K)。头颅X线示呈“方颅”改变,前囟未闭,颅骨骨缝未见闭合;可见多生牙及牙齿阻生(图 1L);双侧锁骨短小,外侧1/2缺如;示指到小指中节指骨均增粗变短;胸片见脊柱侧弯(图 1M)。血液生物化学和骨转换指标无明显异常(表 1)。
患者RUNX2基因突变分析
基因测序结果发现2例CCD患者均存在RUNX2基因杂合突变。患者1在RUNX2基因第7外显子发现一处移码突变c.1126_1127delT p.F376S fs*106(图 2A),导致第376位后氨基酸序列错乱,且翻译在突变位点后继续编码106个氨基酸后提前终止,产生一种截短的变异蛋白。患者2为RUNX2基因第7外显子发生无义突变c.1123C>T p.Q375X(图 2B),该突变导致RUNX2第375位氨基酸的密码子CAG被UAG取代,导致其编码蛋白在375位处提前终止(Q375X),RUNX2蛋白截短。2处突变均导致RUNX2蛋白C端截短,影响该蛋白C端功能域的完整性及功能。本研究发现的2处突变均为RUNX2基因新突变位点,国内外文献均未见报道。
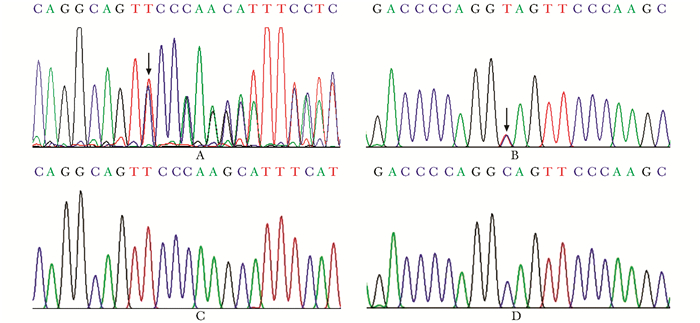
|
| 图 2 2例CCD患者RUNX2基因测序分析 Figure 2 Genetic analysis of RUNX2 gene in two patients CCD A:患者1,c.1126_1127delT,箭头所示为碱基改变,该处为移码突变;B:患者2,c.1123C>T,箭头示C/T杂合双峰,为无义突变;C:患者1突变位点正常对照;D:患者2突变位点正常对照; CCD:颅骨锁骨发育不全综合征 |
本研究2例CCD患者均表现为前囟未闭、颅缝增宽、锁骨短小及牙齿发育异常等CCD典型的临床特征。一项纳入134例CCD患者的回顾性研究结果显示CCD最常见的三大临床表现分别为:锁骨发育不良(81.3%)、前囟不闭合或闭合延迟(75.4%)及牙齿发育异常(50%)、[7]。此外,患者常伴有胸廓畸形(桶状胸或锥型胸)、脊柱侧弯、骨盆或手足指(趾)骨发育异常等表现,且大多身材矮小(中国CCD患者平均身高男性154 cm,女性137 cm[7])。可见CCD是以颅骨、锁骨发育不良为主的广泛性骨骼发育异常性疾病。患者智力一般不受影响。CCD的诊断主要依靠特征性临床表现和X线检查。但对于轻症及症状不典型患者临床诊断困难,可通过检测RUNX2基因突变进行基因诊断。
CCD的致病基因为RUNX2,该基因定位于染色体6p21[8],编码RUNX2蛋白,是一种成骨细胞特异性转录调控因子。RUNX2又称核心结合因子α1(core binding factor A1,CBFA1)、多瘤病毒增强结合蛋白2αA(polymavirus enhancer binding protein 2 alphal A,PEBP2αA)、急性骨髓性白血病因子3(acute myeloid leukemia 3,AML3)[9],是RUNX家族成员之一。该家族由一系列转录因子组成,其共同特征为均包含一段由128个氨基酸组成的DNA结合区,该区域与果蝇的分节基因Runt高度同源,因而被命名为Runt结构域[10]。RUNX家族包含3个成员,RUNX1~3,主要在正常发育和肿瘤形成过程中发挥重要作用[11]。RUNX1与血细胞生成相关,其突变可导致急性髓细胞性白血病;RUNX3则主要与神经元形成、胸腺内细胞生成及肿瘤抑制相关[12]。
RUNX2作为成骨细胞特异性转录调控因子,具有诱导成骨细胞分化和促进软骨细胞成熟的作用,对膜内成骨和软骨内成骨均具有调节作用,对于维持骨骼正常生长发育十分重要。在成骨细胞方面,RUNX2可促进间充质干细胞向成骨细胞特异性分化,并上调骨钙素(osteocalcin,OC)的表达[10],同时通过促进Ⅰ型胶原、骨桥素(osteopontin,OPN)、骨涎蛋白(bone sialoprotein,BSP)以及纤维连接蛋白(fibronectin)等细胞外基质的合成促进矿化[13]。RUNX2敲除的纯合子小鼠(RUNX2-/-)体内完全缺乏骨组织,由于软骨内化骨和膜内化骨功能均丧失而呈现完全性骨缺失[14]。而RUNX2敲除的杂合小鼠(RUNX2+/-)表现出与人类CCD类似的表型[4]。说明RUNX2对于促进成骨细胞分化与矿化,维持成骨细胞正常功能的重要性。RUNX2在软骨形成和软骨内骨化过程中也发挥着重要作用。RUNX2在前肥大软骨细胞和肥大软骨细胞中高表达[15],其表达量随软骨细胞成熟而增加,在肥大软骨细胞的终末阶段表达最显著[16]。在RUNX2+/-小鼠模型中观察到小鼠表现出软骨发育方面的异常,软骨内骨化被抑制,大部分软骨细胞都无法分化成熟,表现为缺乏X型胶原和碱性磷酸酶活性降低[17]。分离并培养RUNX2-/-纯合小鼠的肋软骨细胞发现其逐渐失去自身表型转而向脂肪细胞方向分化[18]。可见RUNX2可诱导软骨细胞肥大和软骨内骨化,以及对于维持软骨细胞表型、抑制其向脂肪细胞分化发挥重要作用。
RUNX2基因对于成骨细胞及软骨细胞的关键调控作用决定了其对于骨形成和代谢的重要性,其突变导致的单倍体不足是目前CCD唯一的分子病因学解释。近年来一项动物研究显示,当小鼠RUNX2蛋白水平低于正常野生型小鼠的70%时才会出现CCD的相关症状,而蛋白水平保持在79%以上均表现为正常表型[19]。
RUNX2基因编码蛋白共含有521个氨基酸,主要包含3个重要结构域:N端是由23个连续谷氨酰胺和17个连续丙氨酸重复序列组成的Q/A域;中间为高度保守的runt结构域;C末端是一个富含脯氨酸、丝氨酸和苏氨酸的PST(proline/serine/threonine-rich)活性结构域。其中,runt结构域介导runt家族转录因子与PEBP2/Cbfb结合形成异二聚体,从而获得更强的DNA结合能力;同时runt结构域还能选择性地识别结合靶基因的特定性序列,调节基因表达;因此,runt结构域是RUNX2蛋白发挥其功能非常重要的区域。PST结构域具有核定位功能,并且与RUNX2介导的转录调节以及与其他转录因子的相互作用有关[5]。而Q/A功能域的作用目前尚不十分明确。本研究两例CCD患者检测到的突变均位于PST结构域,runt结构域未受影响,根据RUNX2各结构域功能推测突变蛋白与DNA的结合能力正常,而主要影响其转录活性,导致转录激活活性丧失。
截至目前,RUNX2基因突变已报道200个位点(human gene mutation database,HDMG),包括错义、无义、缺失、插入及剪切突变等多种突变类型,以发生在runt功能域的错义突变最为常见[20]。错义突变主要变集中于runt结构域,而其他类型的突变则散布于各个区域。说明runt结构域高度保守,其功能对单个氨基酸改变都十分敏感,而N端和C末端相对不保守,需要较大结构上的改变才具有致病影响[5]。
CCD患者临床表现轻重不一,轻型患者可仅有牙齿发育异常,重型患者可表现为全身骨发育不良及广泛性骨质疏松[21],且同一家系患者临床表现也可存在差异[22]。这种表型的差异可能与突变位于RUNX2基因不同功能域而对基因功能产生不同影响有关[23],也可能与环境因素和表观遗传有关[24]。
近年来关于CCD患者临床表型与基因突变型之间相关性的探讨成为一个研究热点。目前研究发现错义、无义、移码或剪切突变等各种突变类型对于表型的影响并无差异[25],然而发生在不同功能域的突变可能与患者表型具有一定的关联性。有研究根据突变是否涉及runt结构域进行分组并分析,结果显示runt结构域发生突变的CCD患者常表现出更为严重的身材矮小及牙齿受累,如多生牙数目多和牙齿阻生等;若突变发生在其他区域而runt结构域保持完整,则大部分患者身材矮小和牙齿受累的症状均比较轻微[5, 23]。Singh等[26]对1例锁骨发育正常的CCD患者进行研究,并回顾性分析了既往发表文章中锁骨发育正常的7例CCD患者表型与基因突变关系,其中突变位点明确的患者有5例,3例为发生在Q/A功能域的无义突变,2例为runt域错义突变。分析后发现突变位于Q/A功能域的CCD患者的表型具有一定的共同特征,即牙齿发育不良症状较轻、锁骨发育相对正常,但诸如鼻骨发育缺失、乳突或额窦气化不良等耳鼻喉相关症状可能较重。
本研究中两例CCD患者突变均位于PST区,而runt结构域未受影响,但2例患者均有显著的身材矮小,与先前文献中runt结构域不受累则CCD患者身材矮小症状不明显的结论并不相符。可见,CCD患者基因型与表型之间可能具有一定相关性,但关联性仍然较弱,尤其是在牙齿发育不良的多样性[24]以及同一家系具有相同突变的患者存在表型差异等方面[22, 24],该现象发生机制可能与表观遗传作用或环境因素影响有关。因此,目前对于CCD患者表型与基因突变型之间的关系尚无定论。
目前CCD并无确切有效的治疗方法,对于头颅、锁骨及全身其他骨骼的病变尚无特殊的治疗手段。大部分患者就诊主要原因是牙齿异常,因此对仍处于生长发育期的患者,可采用正畸治疗,必要时拔除滞留乳牙及多生牙,减小恒牙萌出阻力;成年患者则可通过牙齿修复及种植义齿恢复口腔正常功能。对于颌面部畸形,可通过整形外科手术的方法恢复患者容貌[27]。对于已明确诊断的CCD患者应进行遗传咨询,及早进行产前诊断,改善妊娠结局。
本研究发现了两个RUNX2基因新突变,丰富了CCD疾病的基因突变谱,检出的突变结果可用于对相应家系后代进行产前诊断。
| [1] | Cooper SC, Flaitz CM, Johnston DA, et al. A natural history of cleidocranial dysplasia[J]. Am J Med Genet, 2001, 104: 1–6. DOI:10.1002/(ISSN)1096-8628 |
| [2] | Mundlos S. Cleidocranial dysplasia:clinical and molecular genetics[J]. J Med Genet, 1999, 36: 177–182. |
| [3] | Mundlos S, Otto F, Mundlos C, et al. Mutations involving the transcription factor CBFA1 cause cleidocranial dysplasia[J]. Cell, 1997, 89: 773–779. DOI:10.1016/S0092-8674(00)80260-3 |
| [4] | Otto F, Thornell AP, Crompton T, et al. Cbfa1, a candidate gene for cleidocranial dysplasia syndrome, is essential for osteoblast differentiation and bone development[J]. Cell, 1997, 89: 765–771. DOI:10.1016/S0092-8674(00)80259-7 |
| [5] | Yoshida T, Kanegane H, Osato M, et al. Functional analysis of RUNX2 mutations in Japanese patients with cleidocranial dysplasia demonstrates novel genotype-phenotype correlations[J]. Am J Hum Genet, 2002, 71: 724–738. DOI:10.1086/342717 |
| [6] | Hansen L, Riis AK, Silahtaroglu A, et al. RUNX2 analysis of Danish cleidocranial dysplasia families[J]. Clin Genet, 2011, 79: 254–263. DOI:10.1111/cge.2011.79.issue-3 |
| [7] | 韦华安, 杨立, 张路, 等. 颅锁骨发育不全综合征临床回顾性分析[J]. 武警医学院学报, 2011, 20: 958–960. |
| [8] | Gelb BD, Cooper E, Shevell M, et al. Genetic mapping of the cleidocranial dysplasia (CCD) locus on chromosome band 6p21 to include a microdeletion[J]. Am J Med Genet, 1995, 58: 200–205. DOI:10.1002/(ISSN)1096-8628 |
| [9] | van Wijnen AJ, Stein GS, Gergen JP, et al. Nomenclature for Runt-related (RUNX) proteins[J]. Oncogene, 2004, 23: 4209–4210. DOI:10.1038/sj.onc.1207758 |
| [10] | Ducy P, Zhang R, Geoffroy V, et al. Osf2/Cbfa1:a transcriptional activator of osteoblast differentiation[J]. Cell, 1997, 89: 747–754. DOI:10.1016/S0092-8674(00)80257-3 |
| [11] | Bae SC, Lee YH. Phosphorylation, acetylation and ubiquitination:the molecular basis of RUNX regulation[J]. Gene, 2006, 366: 58–66. DOI:10.1016/j.gene.2005.10.017 |
| [12] | Cohen MJ. Perspectives on RUNX genes:an update[J]. Am J Med Genet A, 2009, 149A: 2629–2646. DOI:10.1002/ajmg.a.v149a:12 |
| [13] | Komori T. Runx2, a multifunctional transcription factor in skeletal development[J]. J Cell Biochem, 2002, 87: 1–8. |
| [14] | Komori T, Yagi H, Nomura S, et al. Targeted disruption of Cbfa1 results in a complete lack of bone formation owing to maturational arrest of osteoblasts[J]. Cell, 1997, 89: 755–764. DOI:10.1016/S0092-8674(00)80258-5 |
| [15] | Kim IS, Otto F, Zabel B, et al. Regulation of chondrocyte differentiation by Cbfa1[J]. Mech Dev, 1999, 80: 159–170. DOI:10.1016/S0925-4773(98)00210-X |
| [16] | Inada M, Yasui T, Nomura S, et al. Maturational disturbance of chondrocytes in Cbfa1-deficient mice[J]. Dev Dyn, 1999, 214: 279–290. DOI:10.1002/(ISSN)1097-0177 |
| [17] | Enomoto-Iwamoto M, Enomoto H, Komori T, et al. Participation of Cbfa1 in regulation of chondrocyte maturation[J]. Osteoarthr Cartila, 2001, 9(Suppl A): S76–S84. |
| [18] | Enomoto H, Furuichi T, Zanma A, et al. Runx2 deficiency in chondrocytes causes adipogenic changes in vitro[J]. J Cell Sci, 2004, 117: 417–425. |
| [19] | Lou Y, Javed A, Hussain S, et al. A Runx2 threshold for the cleidocranial dysplasia phenotype[J]. Hum Mol Genet, 2009, 18: 556–568. |
| [20] | Kim HJ, Nam SH, Kim HJ, et al. Four novel RUNX2 mutations including a splice donor site result in the cleidocranial dysplasia phenotype[J]. J Cell Physiol, 2006, 207: 114–122. DOI:10.1002/(ISSN)1097-4652 |
| [21] | Segal N, Puterman M. Cleidocranial dysplasia-review with an emphasis on otological and audiological manifestations[J]. Int J Pediatr Otorhinolaryngol, 2007, 71: 523–526. DOI:10.1016/j.ijporl.2006.11.021 |
| [22] | Zhang C, Zheng S, Wang Y, et al. Mutational analysis of RUNX2 gene in Chinese patients with cleidocranial dysplasia[J]. Mutagenesis, 2010, 25: 589–594. DOI:10.1093/mutage/geq044 |
| [23] | Bufalino A, Paranaiba LM, Gouvea AF, et al. Cleidocranial dysplasia:oral features and genetic analysis of 11 patients[J]. Oral Dis, 2012, 18: 184–190. DOI:10.1111/odi.2012.18.issue-2 |
| [24] | Suda N, Hamada T, Hattori M, et al. Diversity of supernumerary tooth formation in siblings with cleidocranial dysplasia having identical mutation in RUNX2:possible involvement of non-genetic or epigenetic regulation[J]. Orthod Craniofac Res, 2007, 10: 222–225. DOI:10.1111/ocr.2007.10.issue-4 |
| [25] | Quack I, Vonderstrass B, Stock M, et al. Mutation analysis of core binding factor A1 in patients with cleidocranial dysplasia[J]. Am J Hum Genet, 1999, 65: 1268–1278. DOI:10.1086/302622 |
| [26] | Singh A, Goswami M, Pradhan G, et al. Cleidocranial dysplasia with normal clavicles:a report of a novel genotype and a review of seven previous cases[J]. Mol Syndromol, 2015, 6: 83–86. DOI:10.1159/000375354 |
| [27] | 姜涛, 蒋序, 张运奎. 颅锁骨发育不全综合征2例病例报告及特征分析[J]. 华西口腔医学杂志, 2013, 31: 101–103. DOI:10.7518/hxkq.2013.01.025 |
| (收稿日期:2016-05-04) |

