近年来,铁代谢与骨质疏松症的相关性受到诸多重视,部分研究均提示铁代谢与骨代谢有关[1-3]。2011年,徐又佳和林华等[4]提出需重视铁代谢在骨质疏松症诊治中的意义。而目前临床对铁代谢在骨质疏松症发生、发展过程中所起作用的研究多集中在绝经期女性的髋部骨折,对发病率和危害性更大的骨质疏松性脊柱骨折的研究相对很少。本研究选取胸、腰椎体压缩性骨折患者,探讨其骨密度与血清铁、骨铁含量等指标的相关性。
对象与方法 对象收集2008年1月至2014年12月苏州市第七人民医院院骨科收治的243例胸腰椎椎体压缩性骨折行经皮椎体后凸成形术 (percutaneous kyphoplasty,PKP) 治疗的患者的临床资料,按入院后患者骨密度检查所得值分组,-2.5 < T值 < -1.0为骨量减少组,T值≤-2.5为骨质疏松组。其中骨量减少组95例,男40例,女55例,患者年龄52~79岁,骑电动车摔伤31例,扭伤28例,平地跌伤36例;严重骨质疏松组148例,男51例,女97例,患者年龄50~81岁,骑电动车摔伤41例,扭伤24例,平地跌伤83例。所有患者签署手术同意书和知情同意书,并自愿参加本次研究。
纳入标准:(1) 年龄≥50岁[5]; (2) 经影像学 (X射线、CT、MRI) 检查确诊的单节段骨质疏松性椎体压缩性骨折; (3) 无下肢神经症状。(4) 治疗措施为PKP术。排除标准:(1) 骨肿瘤、炎症及占位性病变引起的病理性骨折; (2) 伴有椎管狭窄; (3) 爆裂性椎体骨折或伤椎既往有手术史; (4) 凝血功能障碍; (5) 伴有严重的心肺功能障碍、肾功能不全; (6) 因疾病或药物等原因引起的继发性骨质疏松患者。
方法骨密度检查:采用双能X线骨密度仪 (Lunar,DPX-NP,美国)。由专人操作,测量日前进行仪器检测、腰椎和髋部模型质量控制,按要求校准精确度、准确度。测定部位:腰椎1-4、总髋部及股骨颈;自动生成T值。T值≥-1.0为正常,-2.5 < T值 < -1.0为骨量减低,T值≤-2.5为骨质疏松 (世界卫生组织骨质疏松诊断标准)。
检测指标:入院第2天留取空腹血清标本。采用电化学发光法检测血清铁蛋白 (SF,13.00~150.00 μg/L);采用酶联免疫吸附试验 (ELISA)(Elecsys 2010,ROCHE,日本) 检测1型原胶原氨基端延长肽 (P1NP,16~55 μg/L)、Ⅰ型胶原C端肽β降解产物 (β-CTX,100~650 ng/L);采用免疫散射比浊法 (BN Prospec,SIEMENS,德国) 检测转铁蛋白 (Tf,2.0~3.6 g/L)、总铁结合力 (TIBC,54.0~77.0 μmol/L)。
骨组织取材和保存:术中取病椎中心区域松质骨组织两块,重约0.5~1.0 g,放入-80 ℃冰箱保存,分别行骨铁含量检测和骨铁染色。
骨铁含量测定:将松质骨用超纯水浸泡15 min,连续3次后浸入体积分数为5%的乙酸15 min,再用超纯水浸泡过夜,除去浅层金属离子;再将浸泡后的松质骨浸泡于体积分数为10%的20 mL过氧化氢溶液中4 h,超纯水洗净后,无水乙醇浸泡15 min,除去软组织及油脂;之后将松质骨转移至干净锥形瓶中,置人85 ℃烘箱烘干至衡重;准确称量后,溶于浓硝酸并微波消解,消解完全后转移、稀释、定容,使用电感耦合等离子体质谱分析仪 (ICP-MS,PE,美国) 测定骨铁含量。
骨组织切片及骨铁染色:将骨组织修剪成体积为2 mm×2 mm×2 mm,用体积分数为10%的甲醛溶液固定,乙醇梯度脱水,二甲苯透明,甲基丙烯酸甲酯包埋,硬组织切片机 (SM2500,LEICA,德国) 切成5 μm不脱钙骨组织切片,行普鲁士蓝铁染色和HE染色。
统计学方法采用SPSS 19.0软件进行统计学分析,数据结果以均数±标准差 (x±s) 表示。组间基本资料的比较,定量数据采用t检验,率的比较采用卡方分析;各变量与腰椎、股骨颈骨密度之间行Pearson相关分析;将Pearson相关分析中P < 0.2的变量作为自变量,骨密度作为因变量行多元回归分析,以P < 0.05为差异有统计学意义。
结果 入选患者一般资料两组患者性别、年龄、身高、体重比较差异均无统计学意义 (P>0.05)(表 1),资料具有可比性。
| 组别 | 例数 | 年龄 (岁) | 性别 | 身高 (cm) | 体质量 (kg) | 体质量指数 (kg/m2) | 骨铁 (μg/g) | 血清铁蛋白 (μg/L) | Ⅰ型原胶原氨基端延长肽 (μg/L) | Ⅰ型胶原C端肽β降解产物 (ng/L) | |
| 男 | 女 | ||||||||||
| 骨量减少组 | 95 | 63.40±1.03 | 40 | 55 | 158.54±3.81 | 59.15±2.01 | 22.72±1.46 | 75.64±32.06 | 201.29±53.37 | 46.63±7.02 | 513.28±73.13 |
| 骨质疏松组 | 148 | 65.13±2.12 | 51 | 97 | 156.77±4.35 | 58.81±3.57 | 21.41±1.24 | 107.71±41.23 | 274.19±72.48 | 77.74±9.91 | 634.18±95.43 |
各变量与股骨颈、L1-4骨密度Pearson相关分析显示年龄、骨铁、血清铁蛋白、Ⅰ型原胶原氨基端延长肽、Ⅰ型胶原C端肽β降解产物与股骨颈和L1-4骨密度呈负相关 (P < 0.05);体质量、体质量指数、转铁蛋白、总铁结合力与股骨颈和L1-4骨密度呈正相关 (P < 0.05)(表 2)。
| 变量 | 股骨颈 | L1-4 | |||
| r | P | r | P | ||
| 基本资料 | |||||
| 年龄 | -0.712 | 0.000 | -0.541 | 0.000 | |
| 身高 | 0.114 | 0.103 | 0.086 | 0.272 | |
| 体质量 | 0.257 | 0.000 | 0.361 | 0.000 | |
| 体质量指数 | 0.237 | 0.002 | 0.335 | 0.000 | |
| 铁代谢指标 | |||||
| 骨铁 | -0.348 | 0.000 | -0.206 | 0.002 | |
| 血清铁蛋白 | -0.323 | 0.000 | -0.213 | 0.015 | |
| 转铁蛋白 | 0.185 | 0.021 | 0.204 | 0.016 | |
| 总铁结合力 | 0.163 | 0.039 | 0.197 | 0.022 | |
| 骨代谢指标 | |||||
| Ⅰ型原胶原氨基端延长肽 | -0.236 | 0.003 | -0.184 | 0.031 | |
| Ⅰ型胶原C端肽β降解产物 | -0.227 | 0.004 | -0.191 | 0.028 | |
将上述Pearson分析结果中P < 0.2的变量与骨密度 (因变量) 行多元线性回归分析。骨铁、血清铁蛋白均能进入股骨颈和腰椎骨密度回归模型,转铁蛋白不能进入股骨颈和腰椎骨密度回归模型 (表 3)。
| 变量 | 股骨颈 | L1-4 | |||||
| β | SE | P | β | SE | P | ||
| 骨铁 | -0.023 | 0.001 | 0.000 | -0.031 | 0.015 | 0.003 | |
| 血清铁蛋白 | -0.014 | 0.002 | 0.005 | -0.063 | 0.021 | 0.008 | |
| R2 | 0.388 | 0.374 | |||||
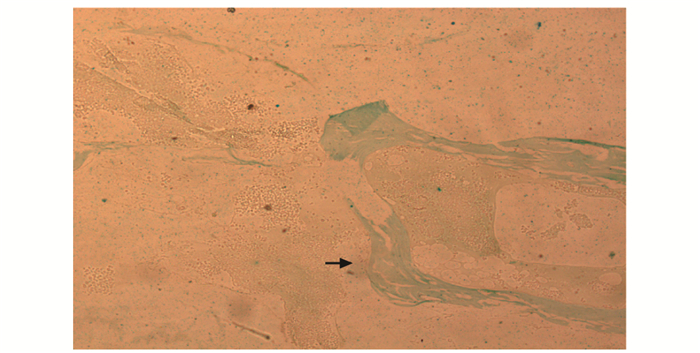
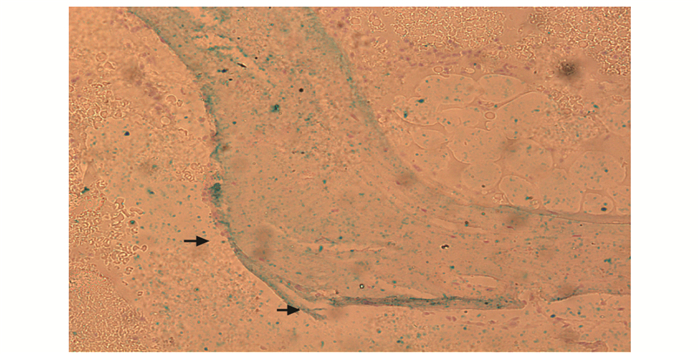
普鲁士蓝铁染色与HE染色可见条絮状骨小梁结构,铁主要沉积在矿化骨小梁和类骨质之间;染色结果显示骨质疏松组骨铁沉积范围较骨量减少组显著增多 (图 1、2)。
|
| 图 1 骨量减少组骨组织铁沉积部位 (箭头) (普鲁士兰铁与HE染色, ×200) Figure 1 Location of iron storages in bone of osteopenia group (×200) |
|
| 图 2 骨质疏松组骨组织铁沉积部位 (箭头)(普鲁士兰铁与HE染色, ×200) Figure 2 Location of iron storages in bone of osteoporosis group (×200) |
2012年国际骨质疏松基金会 (International Osteoporosis Foundation, IOF) 报道:胸腰椎骨质疏松性骨折已经成为影响老年人寿命、健康的一个重要问题[6-7]。目前,对于部分需要手术治疗的患者,经皮椎体成形术 (percutaneous vertebroplasty,PVP) 以及PKP等治疗方法因其创伤小、缓解疼痛明显及可尽早恢复患者肢体功能等优点在临床上得到广泛应用,并取得了良好的疗效[8-9],但手术后因为骨质疏松引起的病椎以及邻近椎体再骨折的患者也不在少数,给患者以及家庭带来了极大的痛苦和负担[10]。临床上预防骨质疏松性椎体骨折的药物主要有抑制骨吸收药物,如钙剂、维生素D、降钙素以及阿仑膦酸盐等;促进骨形成药物,如氟化物、甲状旁腺素等,但治疗效果仍有待进一步的提高。所以,探寻骨质疏松性椎体骨折更多的相关因素,以用来预防和治疗骨质疏松性椎体骨折的发生显得尤为迫切。近年来,动物实验、离体细胞实验以及临床研究都提示铁代谢与骨代谢有关[1-3]。2012年,Kim等[11]选取健康人群研究发现血清铁蛋白升高是加速骨量丢失的独立危险因素;2014年,张伟等[12]发现股骨颈骨折的绝经后女患者体内存在铁蓄积,铁蓄积与绝经后骨质疏松症存在相关性。部分研究者提出铁稳态与骨质疏松症关系密切,降低铁过载可能是防治绝经后骨质疏松症的新方法[13-14]。基于以上研究,本研究对胸、腰椎骨质疏松性椎体压缩性骨折患者铁代谢以及骨代谢指标进行了检测,并对其可能存在的关联性进行了分析,以期对胸腰椎骨质疏松性椎体骨折的治疗提供一定的参考。
铁是人体内重要的微量元素,正常人体铁蓄积达300 μg/L以上[15],许多细胞的生理功能受铁代谢影响,骨骼的代谢也受铁代谢影响。本组病例Pearson相关分析结果显示血清铁蛋白含量与股骨颈骨密度相关系数r为-0.323,与腰椎骨密度相关系数为-0.213,存在显著相关性 (P < 0.05),进一步的多元回归分析结果亦显示血清铁蛋白与骨密度之间的偏回归系数为负值,随着骨密度的降低,骨质疏松程度更高的患者血清铁蛋白呈现了升高趋势。
Ⅰ型原胶原氨基端延长肽和Ⅰ型胶原C端肽β降解产物是IOF推荐的骨形成和骨吸收标志物[16],骨转换指标可动态反映骨代谢活动。最近一项关于澳大利亚人群Ⅰ型原胶原氨基端延长肽和Ⅰ型胶原C端肽β降解产物年龄相关性研究发现:在年龄超过70岁的老年女性中,Ⅰ型原胶原氨基端延长肽和Ⅰ型胶原C端肽β降解产物仍持续升高[17]。本组患者Pearson相关分析结果显示Ⅰ型原胶原氨基端延长肽与股骨颈及腰椎骨密度相关系数分别为-0.236、-0.184,Ⅰ型胶原C端肽β降解产物与股骨颈及腰椎骨密度相关系数分别为-0.227、-0.191,两者与骨密度均存在显著负相关 (P < 0.05),表明随着骨密度的降低,骨转换水平逐渐升高、骨代谢活动有所增强。张伟等[13]在骨质疏松性髋部骨折病例中也发现同样现象。
骨铁是指铁元素在骨组织中的沉积量,需经长期生物化学变化而形成,比较稳定,能直接反映骨组织的铁状态[18],健康人群骨铁含量约为67.3 μg/g[19]。本研究选取病椎松质骨,采用微波消解法处理,测得的骨铁含量与各变量的Pearson相关分析结果显示骨铁含量与股骨颈、腰椎骨密度相关系数分别为-0.348、-0.206,骨铁含量与骨密度存在显著相关性 (P < 0.05)。多元回归分析结果亦进一步证实骨铁含量与骨密度存在负性直线关系。骨铁的形态学检测结果同时也显示骨质疏松程度较重的患者其不脱钙骨组织切片普鲁士蓝铁染色后骨铁沉积范围显著扩大,说明铁在骨组织中的过度沉积可能是造成骨代谢异常的原因之一。
胸、腰椎骨质疏松性骨折发生的相关因素较多,本研究按骨密度的高低将研究对象分为骨量减少组和骨质疏松组,排除由性别、体质量、肾功能不全等因素对骨转换指标的干扰。首先采用Pearson相关分析探寻各变量与骨密度的相关性,之后进一步采用多元线性回归分析研究发现骨铁和血清铁蛋白能进入股骨颈和腰椎骨密度回归模型,说明骨铁和血清铁蛋白均是影响骨密度的独立危险因素。但绝经期女性骨代谢情况可能有别于一般人群,本研究将性别因素排除,未将其单独列出进行研究,对研究结果可能存在一定的干扰。
综上所述,胸、腰椎骨质疏松性椎体骨折患者往往伴随骨代谢和铁代谢异常,随着骨密度降低,椎体骨铁含量及血清铁蛋白呈升高趋势,骨铁及血清铁蛋白含量可能是胸、腰椎骨质疏松性椎体骨折发生的危险因素之一。
| [1] | 贾鹏, 何银峰, 高超, 等. 铁离子对破骨细胞分化及骨吸收的影响[J]. 中华医学杂志, 2012, 92 : 2214–2218. |
| [2] | Jia P, Xu YJ, Zhang ZL, et al. Ferric ion could facilitate osteoclast differentiation and bone resorption through the production of reactive oxygen species[J]. J Orthop Res, 2012, 30 : 1843–1852. |
| [3] | Kim BJ, Lee SH, Koh JM, et al. The association between higher serum ferritin level and lower bone mineral density is prominent in women ≥45 years of age (KNHANES 2008-2010)[J]. Osteoporos Int, 2013, 24 : 2627–2637. DOI:10.1007/s00198-013-2363-0 |
| [4] | 徐又佳, 林华. 重视铁代谢在骨质疏松症诊治中的意义[J]. 中华医学杂志, 2011, 91 : 2223–2225. |
| [5] | Kanis JA, McCloskey EV, Johansson H, et al. Case finding for the management of ostoporosis with FRAX-assessment and intervention thresholds for the UK[J]. Osteoporos Int, 2008, 19 : 1395–1408. DOI:10.1007/s00198-008-0712-1 |
| [6] | Akesson K, Marsh D, Mitchell PJ, et al. Capture the Fracture: a Best Practice Framework and global campaign to break the fragility fracture cycle[J]. Osteoporos Int, 2013, 24 : 2135–2152. DOI:10.1007/s00198-013-2348-z |
| [7] | Johnell O, Kanis JA. An estimate of the worldwide prevalence and disability associated with osteoporotic fractures[J]. Osteoporos Int, 2006, 17 : 1726–1733. |
| [8] | Lieberman IH, Dudeney S, Reinhardt MK, et al. Initial outcome and eficaey of"kyphoplasty"in the treatment of painful osteoporotic vertebral compression fractures[J]. Spine, 2001, 26 : 1631–1638. DOI:10.1097/00007632-200107150-00026 |
| [9] | 纪泉, 张良, 王强, 等. 椎体成形术与椎体后凸成形术治疗骨质疏松性椎体压缩骨折的疗效比较[J]. 中华骨质疏松和骨矿盐疾病杂志, 2013, 6 : 28–33. |
| [10] | 刘新奇, 叶福生, 王永光, 等. 唑来膦酸治疗老年患者经皮椎体成形术后椎体再骨折的短期疗效[J]. 中华骨质疏松和骨矿盐疾病杂志, 2015, 8 : 48–52. |
| [11] | Kim BJ, Ahn SH, Bae SJ, et al. Iron overload accelerates bone loss in healthy postmenopausal women and middle-aged men: a 3-year retrospective longitudinal study[J]. J Bone Miner Res, 2012, 27 : 2279–2290. |
| [12] | 张伟, 王兵, 张林林, 等. 绝经后股骨颈骨折股骨头骨铁含量、血清铁蛋白与骨密度相关性研究[J]. 中华骨科杂志, 2014, 34 : 39–47. |
| [13] | 徐又佳. 降低"铁过载":一个防治绝经后骨质疏松的新方案[J]. 中华骨质疏松和骨矿盐疾病杂志, 2012, 5 : 1–6. |
| [14] | Li GF, Pan YZ, Sirois P, et al. Iron homeostasis in osteoporosis and its clinical implications[J]. Osteoporos Int, 2012, 23 : 2403–2408. DOI:10.1007/s00198-012-1982-1 |
| [15] | Cals MJ, Bories PN, Devanlay M, et al. Extensive laboratory assessment of nutritional status in fit, health-conscious, elderly people living in the Paris area. Research Group on Aging[J]. J Am Coll Nutr, 1994, 13 : 646–657. |
| [16] | Vasikaran S, Cooper C, Eastell R, et al. International Osteoporosis Foundation and International Federation of Clinical Chemistry and Laboratory Medicine position on bone marker standards in osteoporosis[J]. Clin Chem Lab Med, 2011, 49 : 1271–1274. |
| [17] | Martinez J, Olmos JM, Hernandez JL, et al. Bone turnover markers in Spanish postmenopausal women: the Camargo cohort study[J]. Clin Chim Acta, 2009, 409 : 70–74. DOI:10.1016/j.cca.2009.08.020 |
| [18] | Schnitzler CM, Schnaid E, MacPhail AP, et al. Ascorbic acid deficiency, iron overload and alcohol abuse underlie the severe osteoporosis in black African patients with hip fractures—a bone histomorphometric study[J]. Calcif Tissue Int, 2005, 76 : 79–89. |
| [19] | Wieehula D, Jurkiewicz A, Loska K. An assessment of natural concentrations of selected metals in the bone tissues of the femur head[J]. Sci Total Environ, 2008, 406 : 161–167. DOI:10.1016/j.scitotenv.2008.07.068 |
| (收稿日期:2016-09-13) |

