2. 100035 北京,北京积水潭医院放射科
2. Department of Radiology, Beijing Jishuitan Hospital, Beijing 100035, China
畸形性骨炎,又称Paget骨病,是一种病因不明的慢性骨代谢异常疾病。1876年由英国病理学家James Paget首先报道而命名。该病具有明显的地域性,西欧和北美较多见,亚洲国家发病较少,但近十几年我国该病例报道明显增多。本文报道伴有血钙磷代谢异常的非典型畸形性骨炎1例,以期通过对此病例临床特点、血液生物化学指标及影像学特征等分析总结,增加临床医师对本病的了解。
病例报告患者女性,52岁,“腰背痛3年,加重6个月”于2015年1月20日收住院。2012年开始,无明显诱因感腰背痛,2014年8月,腰痛加重,伴颈、髋部酸痛。2014年11就诊当地医院,查血碱性磷酸酶(alkaline phosphatase,ALP)1 218 U/L(参考值:15~130 U/L)、血钙1.88 mmol/L(参考值:2.10~2.62 mmol/L)、血磷0.82 mmol/L(参考值:0.97~1.61 mmol/L),血全段甲状旁腺素(iPTH)242.4 pg/mL(参考值:12~88 pg/mL),全身骨扫描(99mTc-MDP):颅骨、双侧肱骨、脊柱多个椎体、左股骨头,右侧骶髂关节放射性浓聚,代谢增高。诊断考虑“多发骨破坏原因待查”,予唑来磷酸钠(4 mg)静脉滴注治疗1次,症状有所改善。既往体健。月经史:51岁月经开始不规律,3~4个月来潮1次,末次月经为2015-01-16,G2P2。否认家族遗传病史及相关类似情况。入院查体:一般状况可,自主体位,全身皮肤黏膜色泽正常,无皮疹、紫癜、色素沉着,毛发分布正常,全身浅表淋巴结未扪及肿大,头颅无明显畸形,听力粗试无明显下降,甲状腺及心肺腹无明显异常,脊柱无明显畸形,腰椎叩痛阳性,四肢关节无明显肿胀、畸形及压痛,活动无明显受限。
实验室检查血尿便常规均正常。血液生化检查ALP增高、血钙、磷降低、尿钙降低、尿磷增高、骨转换标志物增高(表 1)。血清骨特异碱性磷酸酶(bone specific alkaline phosphatase,BALP)160.60 μg/L(参考值:绝经前妇女2.9~14.5 μg/L,绝经后妇女3.8~22.6 μg/L,成年男性3.7~20.9 μg/L),抗酒石酸酸性磷酸酶(tartrate resistant acid phosphatase,TRACP)12.70 U/L(参考值0~4.15 U/L)。血降钙素、血气分析、尿微量白蛋白、尿α1微球蛋白、尿转铁蛋白、尿免疫球蛋白G、尿N-已酰-β-D-氨基葡萄糖苷酶、血人类白细胞抗原-B27、自身抗体谱、血IgG、IgA、IgM、轻链κ、轻链λ均正常。免疫固定电泳未见IgG、IgA、IgM、轻链κ、轻链λ单克隆成份。性激素测定:卵泡刺激素43.88 IU/L、黄体生成素26.73 IU/L、泌乳素113.16 mIU/L、孕酮2.25 nmol/L、雌二醇157.680 pmol/L、睾酮1.34 nmol/L,符合绝经期女性水平。
| 时间点 | P1NP (μg/L) | β-CTX (μg/L) | OC (μg/L) | 25OHD (nmol/L) | iPTH (ng/L) | ALP (U/L) | Ca (mmol/L) | P (mmol/L) | 尿Ca (mmol/24 h) | 尿P (mmol/24 h) |
| 参考范围 | 13~58 | <1.008 | 15~46 | 50~100 | 12~88 | 15~130 | 2.1~2.6 | 0.97~1.60 | ||
| 治疗初 | 532.5 | 3.1 | >300.0 | 31.5 | 289.2 | 1005 | 2.1 | 0.8 | 0.3 | 6.7 |
| 治疗1年 | 115.3 | 0.9 | 69.9 | 41.8 | 72.5 | 196 | 2.2 | 1.1 | 5.5 | 16.4 |
| ALP:碱性磷酸酶;P1NP:Ⅰ型原胶原氨基端肽;β-CTX:Ⅰ型胶原羧基端肽交联;OC:骨钙素;25OHD:25-羟维生素D;iPTH:全段甲状旁腺素;Ca:钙;P:磷 | ||||||||||
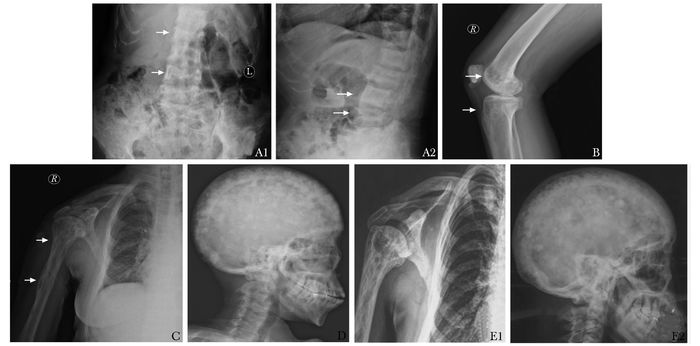
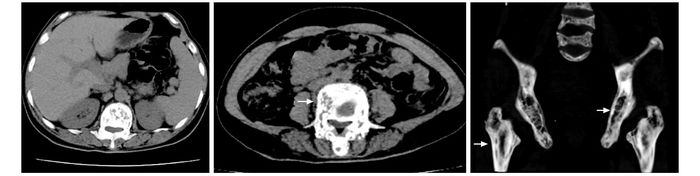
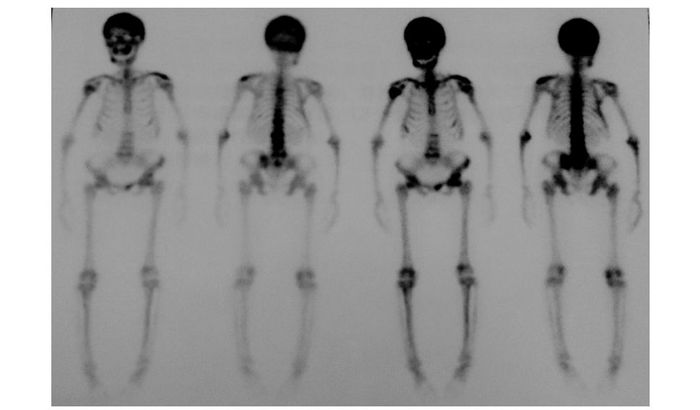
X线片检查:胸腰椎正侧位X线片示腰1、4椎体似成方形,骨皮质边缘毛糙、局部密度增高;腰2、3、5椎体变扁、显示欠清晰,骨质密度减低、模糊;周围软组织未见异常(图 1A)。膝关节侧位X线片示双膝关节诸组成骨骨质密度减低,右侧胫骨近端、股骨远端似见溶骨性破坏区,边界模糊,骨皮质未见破坏,未见骨膜反应,未见软组织肿块影,关节面光整,关节间隙未见狭窄或增宽(图 1B)。肩关节X线片示上肢骨质病变,肱骨骨皮质变薄、分层,骨小梁增粗紊乱(图 1C)。头颅X线片示颅骨可见多发不均匀囊状密度减低区、“棉絮”状密度增高影,皮质欠光整,考虑畸形性骨炎(图 1D)。腹部、骨盆CT:髂骨、股骨上段、腰骶椎及肋骨多发骨内破骨及成骨性改变,相邻软组织未见明显异常密度,考虑全身疾病所致,首先要除外Paget氏病;余未见异常(图 2)。右肱骨近端骨活检示:骨髓成分、纤维性肉芽组织、反应性新生骨;较多淋巴细胞、嗜酸性粒细胞浸润;活检组织恶性诊断不足。全身骨扫描(99m-TC-MDP)示骨骼多发显像异常,呈严重骨质疏松、代谢性骨病征,颅骨、胸腰椎、肩关节及右膝关节异常放射性浓集,结合临床首先考虑为维生素D缺乏所致继发性甲旁亢(图 3)。
|
| 图 1 患者X线片 Figure 1 X-ray films of the patient A1,A2:腰4椎体似成方形,骨皮质边缘毛糙、局部密度增高(A2箭头);腰2、3、5椎体变扁、显示欠清晰,骨质密度减低、模糊(A1箭头、A2箭头);B:膝关节诸组成骨骨质密度减低,右侧胫骨近端、股骨远端似见溶骨性破坏区(箭头),边界模糊,骨皮质未见破坏,未见骨膜反应,未见软组织肿块影,关节面光整,关节间隙未见狭窄或增宽; C:右上肢骨质病变,骨皮质变薄、分层,骨小梁增粗紊乱(箭头); D:颅骨可见多发不均匀囊状密度减低区、“棉絮”状密度增高影,皮质欠光整;E:治疗12月后骨质损害明显好转,E1为肩关节;E2为头颅 |
|
| 图 2 腹部、骨盆CT Figure 2 Abdominal and pelvic CT |
|
| 图 3 全身骨扫描(99M-TC-MDP) Figure 3 99M-TC-MDP scintigraphy of bone |
胸片心肺未见异常。甲状旁腺及颈部淋巴结彩超示甲状腺周围甲状旁腺区未见明显肿物。腹腹部超声肝胆胰脾肾未见异常,腹腔大血管旁未见肿大淋巴结。妇科超声示子宫肌层回声欠均,宫颈纳氏囊肿(1.2 cm×1.0 cm)。甲状旁腺显像(99m-Tc-MIBI):双时相法甲状旁腺显像+颈胸部HAWKEYE断层图像融合示颈部及纵膈区未见明显功能亢进的甲状旁腺显影(图 2)。BMD测定双能X线吸收检测仪(dual energy X-ray absorptiometry,DXA)示低骨量(表 2)。
| 时间点 | 骨密度(g/cm2) | T-值 | ||||
| L1-4 | 股骨颈 | 全髋 | L1-4 | 股骨颈 | 全髋 | |
| 治疗初 | 0.880 | 1.147 | 1.187 | -1.9 | 1.8 | 1.6 |
| 治疗1年 | 1.546 | 1.472 | 1.467 | 3.6 | 4.5 | 3.8 |
| L1-4:腰1-4 | ||||||
根据病史、化验指标、影像学检查及病理活检,该例患者临床诊断为Paget骨病(多骨型)合并维生素D缺乏。治疗上,给予钙尔奇D 600 mg,2次/d; 阿尔法迪三0.5 μg,1次/d; 唑来膦酸(密固达)5 mg,静脉滴注,1次/年。随访12个月后,患者全身骨痛明显减轻,肌力逐渐增强,恢复日常生活。复查血ALP、钙、磷及骨转换标志物均较前明显改善,骨密度较前增高、头颅及肩关节X线片显示受累骨骼病变明显好转,可见骨密度较前增强,颅骨囊状骨吸收区减少,肱骨骨皮质未见分层(图 1 E1、E2)。
讨论2014年12月美国内分泌协会发布了《Paget's骨病临床实践指南》[1]。Paget's骨病(Paget's disease of bone,PD),也称畸形性骨炎、变形性骨炎,一种病因不明的慢性骨代谢异常疾病,以局部骨代谢异常、骨重建障碍为特征。多见于中老年人,男略多于女性,随年龄增长发病率增加。该病存在种族差异,白种人发病率较高(3%~5%),英国、澳大利亚和欧洲多见,亚洲及非洲少见,部分有家族史(15%)[2]。
PD的发病原因不明,目前较肯定的病因学说有遗传因素和环境因素。近年的基因组学研究,已发现有4个基因突变导致该病,其均涉及RANK-NF-κB信号传导通路。其中最重要的基因为SQSTM1(sequestosome 1),该基因编码蛋白p62,调节破骨细胞功能,约40%~50% PD患者存在SQSTM1突变[2]。环境因素中慢性病毒感染可能是PD发病原因之一。常常病毒感染多年后才表现出症状。与PD发病有关的病毒包括麻疹病毒、腮腺炎病毒、狂犬病病毒和副流感病毒。
本病例特点为绝经期女性、腰背痛3年,加重6个月,伴颈、髋部疼痛,查血钙、磷水平降低,ALP及甲状旁腺素(PTH)水平升高,血骨转换指标增高;骨X线示颅骨可见多发不均匀囊状密度减低区、“棉絮”状密度增高影片示;CT示髂骨、股骨上段、腰骶椎及肋骨多发骨内破骨及成骨性改变;骨扫描示骨骼病变部位主要累及颅骨、胸腰椎、肩关节及右膝关节。根据以上临床发现,按照“多发骨损害原因待查”诊断思路,首先排除以下疾病:(1) 患者肾功能正常、无明显肾小球、肾小管损害,不支持肾性骨病;(2) 患者血PTH增高,但甲状旁腺超声及核素检查均正常,且低血钙、低血磷、低尿钙、高尿磷,不符合原发性甲状旁腺功能亢进症;(3) 血液及尿液检查未发现异常单克隆免疫球蛋白增多,骨髓穿刺及活检除外骨髓瘤;(4) 全面细致检查无恶性肿瘤,也不支持肿瘤多发骨转移。最终依据患者症状、血ALP增高并存在Paget骨病特征性的影像学改变,确诊为Paget's骨病。
既往认为我国该病罕见,但近十几年病例报道明显增多[3-6]。发病年龄多在40岁以后,特别是40~70岁人群。病程2个月至37年不等,大多为5~10年。以散发PD为主,最常见症状是骨痛。多骨性PD占50%~71%,最常累及部位为骨盆、颅骨、椎骨、股骨,其次为胫骨、肱骨、锁骨和肋骨。国内尚无PD合并恶性骨肿瘤报道。国外报道无症状患者的比例可高达95%[7],而我国除中国香港地区报道病例中,仅1例出现轻度背痛,6例无症状(87%)因血ALP升高或X线检查被发现;我国报道病例大多数均因骨痛就诊,考虑这可能与我国的低发病率及临床医师对该病的认识不足而未能早期诊断有关。
PD的临床诊断要点:(1) 多数患者无症状,常因其他需要照X线片时意外发现,或查体发现血碱性磷酸酶增加,追查原因时被发现。(2) 典型表现为骨痛、骨畸形、骨折;X线片呈骨吸收和骨形成均增加的特征性骨结构紊乱。骨吸收和骨形成标志物水平均增高。(3) 骨核素扫描对临床明确患者受累骨骼部位具有优势,判断是单骨性或多骨性损害,明确受累骨骼。(4) 基本病理改变是破骨性及异常增生性骨病变,非诊断所必须,主要用于鉴别除外恶性病变,具有特征性改变的是在增宽的骨小梁内有大量界限清楚的蓝染的骨黏合线。本例患者多发骨骼受累,其病理结果受患者意愿及取材部位等因素限制未能见到PD典型病理改变,但对于除外恶性病变还是有意义的。
ALP显著升高是本病的重要特征。约95%的患者血清ALP增高,多为正常上限的2~10倍,其上升的幅度与病变范围、部位和活动程度有关。病变波及范围广,尤其累及头颅则升高明显,单骨病变范围小也可正常。因此ALP也是反映病变范围、活动性和观察治疗效果的重要指标。PD者血钙、磷一般正常,还可伴有骨转换生化标志物水平升高。
与大多数文献报道的PD患者血钙、磷及PTH水平正常不同,本例患者存在血钙、磷及PTH异常。进一步文献复习,发现早已有报道Paget骨病患者可以存在低血钙及血PTH水平增高[8-9],但其机制尚未阐明,推测维生素D缺乏可能是PD患者出现低血钙的主要原因之一。有关PD与维生素D缺乏的研究观点主要如下:(1) 破骨细胞活性增加阶段,新产生的类骨质矿化导致对维生素D需求增加,造成处于维生素D储备边缘的患者维生素D缺乏,甚至出现骨软化;(2) 维生素D缺乏引起的骨矿化障碍可能是PD的诱发因素,近年欧美国家PD发病率下降,推测或许与大力提倡补充维生素D相关;(3) PD在老年人多发,同时维生素D缺乏在老年人群更普遍。上述仅是流行病学研究结果,确切机制尚需要进一步的病因学研究证实。另外,本例患者在确诊PD之前曾接受双膦酸盐静脉输注治疗减轻骨痛症状,但事先并没有充分纠正钙及维生素D不足,这亦是造成低血钙、PTH升高的重要原因。双膦酸盐能够抑制骨矿化过程,抑制骨吸收作用强且持久,故PD患者,尤其是存在骨转换快、维生素D缺乏情况时,应用双膦酸盐治疗可出现低血钙、继发甲状旁腺功能亢进。因此,建议给予双膦酸盐治疗之前应检测血25OHD水平。即使血钙、血磷和PTH水平正常,仍应检测血25OHD水平,从而减少或避免维生素D缺乏继发性甲旁亢的不利影响。
少数PD患者也可以出现高血钙和高尿钙。多见于一些病变广泛和长期制动PD患者[10]。PD在发病初期以破骨细胞活动增加、骨吸收为主,骨钙释放入血,因此可能出现高钙血症。其次,如果患者因骨折、脊柱损伤、四肢瘫痪、大面积烧伤等需要长期制动时在高骨转换状态下,由于制动缺乏机械刺激,骨吸收进一步增加,引发骨钙大量释放入血超过肾脏排泄钙的能力导致的制动性高钙血症。此外,PD患者同时合并另一种疾病时,如甲状旁腺功能亢进症、恶性肿瘤,也可以存在血钙增高[11]。
本例患者为PD(多骨型)。PD(多骨型)除了进行多发性骨损害的鉴别外,还应考虑:(1) PD疾病早期X线表现并不典型,要注意与其他引起骨痛、骨畸形、骨折的疾病鉴别。如骨软化症、骨纤维异常增生症及肿瘤性骨病。骨软化症X线特点是见到假性骨折(loser)线,骨盆三角形变形,骨小梁粗糙紊乱且夹杂囊状透亮影。骨纤维异常增生症的X线表现为囊状膨胀性透亮区,单囊或多囊,边缘清晰,常有硬化边,皮质变薄,囊内有散在条索状和斑点状致密影,骨组织呈磨玻璃样特征改变。肿瘤性骨病,多见于骨盆、肋骨、椎体等,一般不会累及颅骨及手足短骨,局部有软组织肿块影,存在原发恶性肿瘤病灶表现,病变部位活检为恶性病变。(2) 其他低骨量疾病。如骨质疏松的患者骨矿物质和有机质呈等比例减少,出现骨皮质变薄,骨小梁纤细、结构紊乱;成骨不全的患者,由于其有机质结构的异常,导致骨矿物整体密度下降。Paget骨病由于骨重建增快出现骨量低下,但是主要表现为骨骼的结构紊乱,骨骼呈现膨胀性改变。
双膦酸盐是治疗PD的首选药物。PD病理生理特征是骨吸收增加,随之代偿性的新骨形成增加,骨转换骨重建单位的生成速率的增加导致病变部位编织骨和板层骨镶嵌。这种结构改变使骨膨大、疏松、血管增多、发生畸形和骨折。因此,抑制骨吸收,降低骨转换的双膦酸盐是治疗PD的首选药物。由于唑来膦酸的效力更强、缓解时间更长,国外目前多选用唑来膦酸。同时建议患者每日摄入1 000~1 500 mg钙,充足的日照,至少400 IU维生素D。适度锻炼维持骨骼健康,避免体质量增加,利于保持关节稳定性,受累骨骼应避免过度负重。PD预后一般比较好,尤其是在严重骨损害发生之前治疗的患者。PD骨痛在治疗数周内可见减轻甚至消失,双膦酸盐可以使患者长期缓解,但存在治疗期限。研究表明,93%患者ALP恢复正常,65%患者可获得15个月的缓解期,疗程一般不超过5年[6]。但是如果疾病复发,则需要恢复治疗。
不同于多数文献PD患者血钙、血磷正常的报道,本文1例PD伴低血钙、低血磷。结合文献复习,本文总结分析了Paget骨病伴钙磷代谢异常的原因、实验室检查和治疗情况,以期拓宽临床医师对本病的认识,为其临床诊治积累更多经验。
| [1] | Singer FR, Bone HG 3rd, Hosking DJ, et al. Paget's disease of bone:an Endocrine Society clinical practice guidline[J]. J Clin Endocrinol Metab, 2014, 99: 4408–4422. DOI:10.1210/jc.2014-2910 |
| [2] | Ralston SH, Langston AL, Reid IR. Pathogenesis and management of Paget disease of bone[J]. Lancet, 2008, 372: 155–163. DOI:10.1016/S0140-6736(08)61035-1 |
| [3] | 许藏丹, 高志红, 何庆, 等. 160例Paget病临床荟萃分析. 中华医学会、中华医学会内分泌学分会. 《中华医学会第十次全国内分泌学术会议论文汇编》[C]. 中华医学会, 2011: 611-615. |
| [4] | 郑燕, 杜洪泉, 章振林. 畸形性骨炎六例的临床诊治分析[J]. 中华内分泌代谢杂志, 2015, 31: 139–142. DOI:10.3760/cma.j.issn.1000-6699.2015.02.011 |
| [5] | Gu JM, Zhang ZL, Zhang H, et al. Thirteen Chinese patients with sporadic Paget's disease of bone:clinical features, SQSTM1 mutation identification, and functional analysis[J]. J Bone Miner Metab, 2012, 30: 525–533. DOI:10.1007/s00774-012-0352-6 |
| [6] | Wat WZ, Cheung WS, Lau TW. A case series of Paget's disease of bone in Chinese[J]. Hong Kong Med J, 2013, 19: 242–248. |
| [7] | Rousiere M, Michou L, Cornelis F, et al. Paget's disease of bone[J]. Best Pract Res Clin Rheumatol, 2003, 17: 1019–1041. DOI:10.1016/j.berh.2003.09.003 |
| [8] | 孟迅吾, 邢小平, 周学瀛, 等. 畸形性骨炎的诊断和治疗[J]. 中华内分泌代谢杂志, 1993, 9: 27–29. |
| [9] | Polyzos SA, Anastasilakis AD, Makras P, et al. Paget's disease of bone and calcium homeostasis:focus on bisphosphonate treatment[J]. Exp Clin Endocrinal Diabetes, 2011, 119: 519–524. DOI:10.1055/s-0031-1284365 |
| [10] | Nathan AW, Ludlam HA, Wilson DW, et al. Hypercalcaemia due to immobilization of a patient with Paget's disease of bone[J]. Postgrad Med J, 1982, 58: 714–715. DOI:10.1136/pgmj.58.685.714 |
| [11] | Douglas DL, Duckworth T, Russell RG, et al. Effect of dichloromethylene diphosphonate in Paget's disease of bone and in hypercalcaemia due to primary hyperparathyroidism or malignant disease[J]. Lancet, 1980, 1: 1043–1047. |
| (收稿日期:2016-10-19) |

