肿瘤性骨软化症(tumor induced osteomalacia,TIO)在1947年由McCance[1]首次描述。TIO是一种罕见的获得性副肿瘤综合征,由于间叶组织肿瘤过量分泌成纤维细胞生长因子23(fibroblast growth factor 23,FGF23) 引起肾脏排磷增加,血磷降低;临床表现为乏力、骨痛、骨折、活动障碍[2-3]。TIO患者由于活动困难、骨折等原因长期卧床,也可能并发深静脉血栓(deep vein thrombosis,DVT)、肺栓塞(pulmonary embolism,PE),但目前国内外罕见报道。DVT和PE合称为静脉血栓栓塞症(venous thromboembolism,VTE),它是仅次于急性心肌梗死和脑卒中的第3大血管疾病,严重威胁人类生命[4]。临床上TIO的诊断和肿瘤定位困难,常被误诊、漏诊[5-8];而DVT、PE临床表现多样,有时隐匿,缺乏特异性,易被延误诊治。两者并存进一步增加诊治难度,且PE可能危及患者生命。本研究报道2例成功诊治的TIO并发下肢DVT、PE病例,结合文献复习,分析临床特点并总结经验,以引起临床医师对此类情况的重视,提高诊治水平。
对象和方法对象
北京协和医院2014年8月至2016年9月成功诊治的2例TIO并发下肢DVT、PE患者:患者1,男性,46岁;患者2,女性,52岁。
方法
病史资料:收集一般资料、病程、临床症状、体征、诊治经过。
测定血生化、骨代谢和血栓相关指标:入院后留取空腹血清标本送检。血液生化、凝血及血磷、钙、碱性磷酸酶、甲状旁腺素、25羟维生素D等由北京协和医院检验科完成。其中甲状旁腺素采用电化学发光法测定,25双羟维生素D采用罗氏电化学发光的免疫方法。1, 25双羟维生素D3由北京协和医院核医学科采用放射免疫分析法测定。
特殊试验:(1) 磷廓清试验:患者空腹过夜,早8:00排空膀胱,饮蒸馏水200 mL,2 h后取血测定血磷、肌酐,同时留尿记录尿量,测定尿磷、肌酐。计算磷廓清指数(tubular maximum for phosphorus/glomerular filtration rate, TMP/GFR)。(2) 中性磷负荷试验:患者空腹过夜,试验前排空膀胱,口服中性磷0.192 L(中性磷配方:十二水合磷酸氢二钠73.1 g与磷酸二氢钾6.4 g加水至1 L),测定0、0.5、1、1.5、2.5、3.5 h血磷,最后一次抽血的同时留尿测定尿磷+钙+肌酐。
采用Wells临床评分[4]分析患者DVT和PE的可能性。DVT评分项目包括活动性癌症、下肢瘫痪或近期下肢石膏固定、近期卧床>3 d或近4周大手术、深静脉系统局部压痛、全下肢肿胀、与健侧相比小腿周径增大>3 cm、DVT病史、单侧凹陷性水肿、非曲张性浅静脉侧支循环(以上各项每项1分),可做出非DVT的其他诊断(-2分)。DVT评分≤2分提示DVT可能性较小,评分>2分提示DVT可能性较大。PE评分项目包括PE的可能性大于其他诊断(3分)、DVT临床症状和体征(3分)、心率>100次/min(1.5分)、最近4周内有手术史或制动史1.5分)、既往有DVT或PE史(1.5分)、活动性癌症(1分)、咯血(1分)。PE评分≤4分提示PE可能较小,评分>4分提示PE可能性较大。
以“肿瘤性骨软化症和深静脉血栓形成”、“肿瘤性骨软化症和肺栓塞”、“骨软化症和深静脉血栓形成”、“骨软化症和肺栓塞”为检索词在万方数据库和中国知网对中文文献进行检索;以“tumor induced osteomalacia and deep vein thrombosis”、“tumor induced osteomalacia and pulmonary embolism”、“osteomalacia and deep vein thrombosis”、“osteomalacia and pulmonary embolism”为检索词在PubMed对外文文献进行检索。检索到一例骨软化症并发下肢DVT、PE,为外文文献报道。总结骨软化症并发VTE的临床特点,分析其危险因素。
结果病例1
患者男,46岁,入院日期2014年8月26日,因“全身骨痛2年余,乏力伴活动困难3个月”入院。2012年起患者无明显诱因出现足跟疼痛,渐进累及全身。多次被诊断为“关节炎”,予以对症处理,未见好转。2014年5月行走时跌倒致右髋部剧烈疼痛,在当地医院行髋部MRI示右股骨头内水肿。此后患者全身疼痛加重,伴乏力、行走困难。2014年7月于外院检查发现低磷血症、骨密度低、可疑全身多发骨折(肋骨、第1腰椎)。病程中否认身高变矮。近2年体质量下降5 kg。既往史无特殊。否认吸烟史。否认类似疾病家族史。入院查体:血压(blood pressure, BP)120/80 mmHg(1 mmHg=0.133 kPa),指氧饱和度100%,身高172 cm,体质量指数(body mass index, BMI)28.1 kg/m2;均匀性肥胖,轮椅入室,肋骨压痛(+),胸廓挤压痛(+),双下肢无水肿。
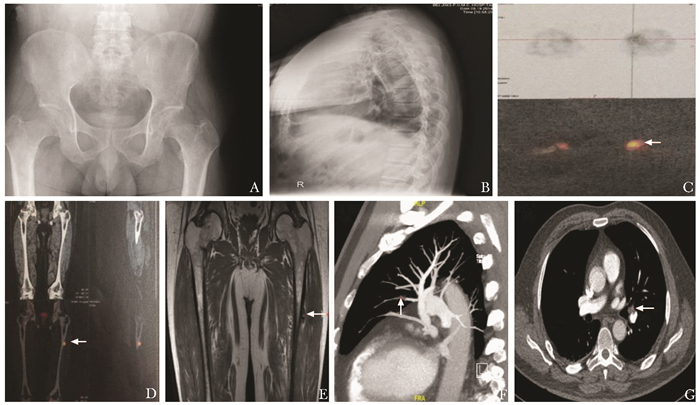
诊治经过:2014年8月查血常规、肝肾功能正常;血磷低、碱性磷酸酶高、TMP/GFR低、25羟维生素D及1, 25双羟维生素D3低(表 1)。心电图示窦性心律,心率65次/min,Ⅲ导联出现Q波及T波倒置。超声心动图未见异常,左室射血分数65%。骨盆X线片(图 1A)和胸腰椎X线片(图 1B)均示骨密度减低。生长抑素受体显像示左侧股骨下段内侧髁高表达灶(图 1C)。68Ga-DOTA-TATE正电子发射计算机断层显像(68Ga-DOTATATE positron emission computed tomography, 68Ga-DOTA-TATE PET/CT)(图 1D)、下肢增强MRI(图 1E)及超声均提示左侧股骨中上段外侧肌肉间隙占位。入院诊断“TIO”。入院后予碳酸钙D3 600 mg每天1次,骨化三醇0.25 μg每天1次治疗。
| 指标 | 患者1 | 患者2 | 正常参考范围 |
| 血磷(mmol/L) | 0.63↓ | 0.32↓ | 0.81~1.45 |
| 血钙(mmol/L) | 2.30 | 2.06↓ | 2.13~2.70 |
| 碱性磷酸酶(U/L) | 165↑ | 150↑ | 男性45~125 女性50~135 |
| 甲状旁腺素(ng/L) | 26.8 | 119.0↑ | 12.0~65.0 |
| 25羟维生素D(μg/L) | 8.9↓ | 22.0↓ | 30.0~50.0 |
| 1, 25双羟维生素D(ng/L) | 13.85↓ | 无 | 19.6~54.3 |
| 磷廓清指数 | 0.60↓ | 0.24↓ | 0.80~1.35 |
| 中性磷负荷试验峰值(mmol/L) | 1.13(1.5 h) | 0.84(1.5 h)↓ | 1.11~2.03(1.5 h) |
| 氧分压(血气)(mmHg Δ) | 90.3 | 73.2↓ | 83.0~108.0 |
| 凝血酶原时间(s) | 10.7 | 12.2 | 10.4~12.6 |
| 活化部分凝血酶原时间(s) | 23.5 | 27.9 | 22.7~31.8 |
| 国际标准化比值 | 0.96 | 1.05 | 0.86~1.14 |
| 纤维蛋白原(g/L) | 3.99↑ | 1.78↓ | 1.80~3.50 |
| D-二聚体(mg/L FEU) | 3.57↑ | 5.92↑ | 0~0.55 |
| TIO:肿瘤性骨软化症;FEU:纤维蛋白原当量单位; Δ1 mmHg=0.133 kPa | |||
|
| 图 1 患者1影像学表现 Figure 1 Imaging findings of patient 1 A:骨盆X线片示骨密度减低; B:胸腰椎X线片示骨密度减低; C:生长抑素受体显像示左侧股骨下段内侧髁高表达灶(箭头); D:68Ga-DOTA-TATE正电子发射计算机断层显像(PET/CT)示左侧股骨中上外侧肌肉间隙高表达结节(箭头); E:双下肢增强MRI示左侧股骨中上段外侧肌肉间隙占位(箭头);F, G:CT肺动脉显影示双肺多发肺栓塞(箭头) |
2014年9月21日起患者无明显诱因出现左下肢肿胀、疼痛伴活动后青紫,无胸闷、胸痛、呼吸困难等不适。查体示双下肢周径不等,左下肢可凹陷性水肿。查血气示氧分压正常;凝血示纤维蛋白原、D-二聚体(D-dimer, DD)升高(表 1)。心电图示窦性心律,心率74次/分,余同前。超声示左侧股总静脉血栓形成。CT肺动脉显影(CT pulmonary artery angiography, CTPA)示双肺多发肺栓塞(图 1F、G)。CT静脉显影(CT venography, CTV)示下腔静脉、左侧髂外静脉、左下肢深静脉血栓形成。狼疮抗凝物为1.01(≤1.2),抗磷脂抗体阴性。2014年9月22日起予依诺肝素钠注射液(克赛,赛诺菲)6 000 IU每12小时1次抗凝治疗,制动2周。2014年10月8日复查超声示左侧股总及股浅静脉近心段管腔血栓形成;左侧髂静脉血栓形成。复查DD 0.96 mg/L纤维蛋白原当量单位(fibrinogen equivalent unit, FEU)↑。2014年10月27日于局部麻醉下行下腔静脉可回收滤器植入术。2014年10月28日于全身麻醉下行左大腿肿物探查切除术,过程顺利。2014年10月29日起予依诺肝素钠6 000 IU每12小时1次、迈之灵(马栗树籽提取物,德国礼达)300 mg每天2次治疗。术后血磷恢复正常,病理符合磷酸盐尿性间叶肿瘤。
随访:(1) TIO:患者继续服用骨化三醇0.25 μg每天1次、碳酸钙D3 0.6 g每天1次,乏力、骨痛逐渐缓解,行走自如,手术10个月后复查血磷1.10 mmol/L,骨密度正常。(2) VTE:患者长期佩戴弹力袜,出院后停用依诺肝素钠,加用Marevan(华法林钠片,芬兰奥利安)3 mg/d,定期监测国际标准化比值(international normalized ratio, INR)调整华法林钠片剂量,近1年服用华法林钠片4.5 mg/d,监测INR 2.5左右。2014年12月北京协和医院复查CTV示左股总静脉、左髂外静脉仍有血栓,左侧髂总静脉新见狭窄,故未行滤器拔除。2015年8月再次复查CTV示原左下肢深静脉血栓吸收,左侧髂总静脉及髂外静脉纤细较前明显。
病例2
患者女,52岁,入院日期2016年8月19日,因“全身骨痛2年余、活动困难9个月”入院。2014年患者无明显诱因出现双侧足跟部、髋部疼痛,逐渐加重至全身。2014年8月患者发现左侧足部占位,并逐渐增大,未重视。2015年1月于外院查血磷低、碱性磷酸酶高;髋关节MRI示右侧耻骨下支骨折不除外;予止痛治疗效果不佳。2015年11月患者全身骨痛加重,伴乏力、活动困难,就诊外院发现骨密度低;予骨化三醇0.25 μg每天1次、碳酸钙D3 0.6 g每天2次等治疗症状无缓解。2016年2月起偶有胸闷、气短等症状,未重视。起病以来身高下降5 cm,体质量下降4 kg。既往高血压10年,近2年未服降压药,自诉血压120~130/80~90 mmHg(1 mmHg=0.133 kPa)。否认吸烟史。否认类似疾病家族史。入院查体:血压140/94 mmHg,指氧饱和度99%;身高155 cm,BMI 26.6 kg/m2,轮椅入室,胸廓、骨盆挤压痛阳性;左足弓内侧可触及3 cm左右肿物,压痛(±),双下肢无水肿。
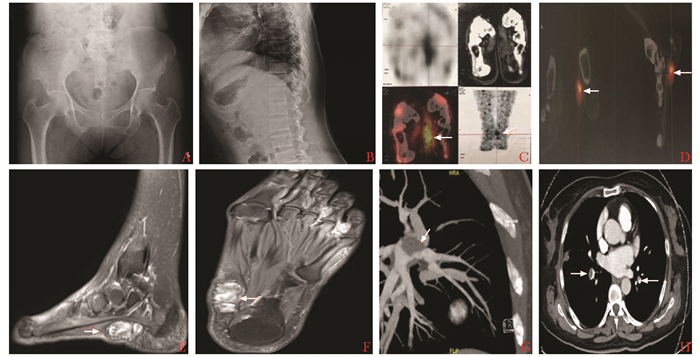
诊治经过:入院后完善血常规,肝、肾功能正常;血磷、血钙、TMP/GFR低,碱性磷酸酶、甲状旁腺素高,血25羟维生素D低;血气氧分压低;凝血示纤维蛋白原低、DD高(表 1)。抗磷脂抗体谱等免疫指标阴性。查蛋白S 29%↓(参考值范围76%~135%)。心电图示窦性心律,心率71次/分,Ⅲ导联出现Q波及T波倒置。超声心动图示左室射血分数67%,轻-中度肺高压(56 mmHg),主肺动脉及右肺动脉增宽。骨盆X线片(图 2A)和胸腰段X线片(图 2B)均示骨质密度减低。生长抑素受体显像示左足高表达病灶(图 2C)。69Ga-DOTA-TATE PET/CT(图 2D)、左足常规MRI(图 2E、2F)及超声均提示左足弓内侧占位。骨扫描示全身异常所见,胸椎6-8不除外压缩性骨折,多处肋骨骨折。骨密度示骨量减少。下肢深静脉彩超示左侧股总静脉、股浅静脉近心段血栓形成可能性大。髂静脉、下腔静脉超声未见异常。CTPA示双肺动脉及其分支多发肺栓塞(图 2G、H);右肺中叶、下叶散在小斑片、索条影,考虑肺梗死灶。入院诊断,“TIO下肢DVT、PE”。入院后予骨化三醇0.25 μg每天2次、中性磷50 mL每天5次治疗。监测血压120~130/70~80 mmHg,未予降压治疗。VTE方面:嘱患者制动、抬高患肢,2016年8月25日起予依诺肝素钠6 000 U每12小时1次治疗。两周后复查超声示左侧股浅、腘静脉血栓后再通。复查DD 0.57 mg/L FEU。2016年9月18日血管外科局部麻醉下行下腔静脉临时滤器植入术;后骨科全身麻醉下行左足底肿物切除术,过程顺利。术后予依诺肝素钠4 000 U每12小时1次、迈之灵300 mg每天2次等治疗。术后血磷恢复正常,病理符合磷酸盐尿性间叶肿瘤。术后第1天患者诉下腹部、腰部阵发性针刺样疼痛,经超声和CTV证实下腔静脉滤器滤网旁及双侧髂总静脉汇合处多发血栓形成。改予依诺肝素钠6 000 IU每12小时1次治疗,并于2016年9月23行下腔静脉造影、滤器拔除术,过程顺利,术后患者疼痛明显缓解。2016年9月25日起予依诺肝素钠6 000 U每12小时1次重叠华法林钠片3 mg每天1次治疗,根据INR结果华法林钠片逐渐加量至5.25 mg每天1次;10月3日复查INR 2.61,停用依诺肝素钠,此后根据INR逐渐调整为华法林钠片3 mg每天1次维持治疗,复查INR 2.50。
|
| 图 2 患者2的影像学表现 Figure 2 Imaging findings of patient 2 A:骨盆X线片示骨质密度减低; B:胸腰段X线片示骨质密度减低; C:生长抑素受体显像示左足示高表达病灶(箭头); D: 68Ga-DOTA-TATE正电子发射计算机断层显像(PET/CT)示左侧足弓高(箭头示摄取病灶); E, F:左足常规MRI示左足底跖长韧带下方软组织占位(箭头); G, H:CT肺动脉显影示双肺动脉及其分支多发肺栓塞(箭头) |
随访:(1) TIO:出院后患者服用骨化三醇0.25 μg每天1次、碳酸钙D3 0.6 g每天1次治疗,自觉乏力、骨痛明显好转,行走自如,术后5个月复查血磷1.01 mmol/L。(2) VTE:患者偶有活动后胸闷、气短,无胸痛、呼吸困难,继续华法林钠片治疗,近2个月口服华法林钠片3.75 mg每天1次,监测INR 2.7左右。
文献复习及病例分析
文献报道1例骨软化症并发下肢DVT、PE的患者:患者女,63岁,因“骨痛2年,胸廓畸形、呼吸困难加重2月”就诊。患者胸骨凸出、重度脊柱后侧凸,有尾骨、耻骨骨折,因左股骨头缺血性坏死曾行左髋关节置换术,后出现右侧股骨颈骨折,长期卧床;血液生化检查示低血磷、低血钙、碱性磷酸酶升高、25羟维生素D低至测不出、甲状旁腺素升高,骨活检提示类骨质堆积;进一步检查未见原发肿瘤证据。诊断为骨软化症、严重维生素D缺乏、继发性甲状旁腺功能亢进症,予维生素D和钙剂治疗两周后血钙、磷恢复正常。患者长期卧床,住院期间予预防性抗凝治疗,住院6周后患者出现急性呼吸循环骤停死亡,尸检发现大面积PE,且伴有下肢DVT[9]。结合文献中的此例报道和本文中的两例TIO并发VTE患者共同分析,3例骨软化症并发下肢DVT、PE患者的临床特点总结见表 2。
| 项目 | 患者1 | 患者2 | 患者3[9] |
| 年龄(岁) | 46 | 52 | 63 |
| 性别 | 男 | 女 | 女 |
| 原发病临床表现 | 骨痛、乏力、活动困难、多发骨折(椎体、肋骨) | 骨痛、乏力、活动困难、多发骨折(耻骨、椎体、肋骨) | 骨痛、活动困难、多发骨折(椎体、胸骨、尾骨、耻骨、股骨颈) |
| 呼吸困难、胸痛 | 无 | 轻微胸闷、气短 | 呼吸困难(胸廓畸形) |
| 下肢肿胀、疼痛 | 左下肢肿胀、疼痛 | 无 | 无 |
| DVT危险因素 | 长期卧床、骨折、年龄>40岁、肥胖 | 长期卧床、骨折、年龄>40岁、蛋白S低、超重 | 长期卧床、骨折、年龄>40岁 |
| Wells临床评分 | DVT 5分,PE 7.5分 | DVT 1分,PE 4.5分 | DVT 2分,PE 4.5分 |
| 血液生物化学检查 | P↓,ALP↑,TMP/GFR↓,25OHD↓,1, 25(OH)2D↓ | P↓,ALP↑,TMP/GFR↓,Ca↓,25OHD↓,PTH↑ | P↓,Ca↓,ALP↑,25OHD↓,PTH↑ |
| TIO肿瘤定位检查 | 68Ga-DOTA-TATE PET/CT、超声、核磁阳性,生长抑素受体显像假阳性 | 68Ga-DOTA-TATE PET/CT、生长抑素受体显像、超声、核磁、查体阳性 | 无 |
| DD升高 | 有 | 有 | 未查 |
| 低氧血症 | 无 | 有 | 不详 |
| 下肢深静脉彩超 | 阳性 | 阳性 | 未查 |
| CTPA | 阳性 | 阳性 | 未查 |
| 治疗 | 病灶切除、骨化三醇、钙剂;下腔静脉滤器植入术、长期抗凝 | 病灶切除、骨化三醇、钙剂;下腔静脉滤器植入术、长期抗凝 | 维生素D+钙剂、预防性抗凝、吸氧 |
| 预后 | 原发病治愈,原血栓吸收,无新发血栓 | 原发病治愈,无明确新发血栓 | 原发病好转,死亡(肺栓塞) |
| DVT:深静脉血栓形成;PE:肺栓塞;TIO:肿瘤性骨软化症;DD:D-二聚体;CTPA:CT肺动脉造影;TMP/GFR:磷廓清指数;P:血磷;ALP:血碱性磷酸酶;PTH:血甲状旁腺素;25OHD:血25双羟维生素D;1, 25(OH)2D:血1, 25双羟维生素D | |||
TIO是一种罕见的由肿瘤引起肾脏排磷增加,造成的获得性低磷骨软化症[9-10]。本研究首次报道两例成功诊治的TIO并发下肢DVT、PE病例。两例患者均成年起病,慢性病程,否认阳性家族史。临床以骨痛、乏力起病,渐进出现活动困难、多发骨折;查体轮椅入室,有骨骼压痛;检查示低磷血症、磷廓清指数降低、碱性磷酸酶升高。骨骼影像学提示骨质密度减低。综上,2例患者低磷骨软化症诊断明确。病因方面,2例患者肿瘤定位明确,手术切除病灶后病情缓解,病理符合磷酸盐尿性间叶肿瘤,TIO明确。两例患者均有DD升高,经下肢深静脉彩超及CTPA证实DVT和PE。临床上TIO常被延误诊治,对于成年起病的有骨痛、乏力、活动困难等症状伴低磷血症的患者需要考虑TIO的诊断,并积极寻找肿瘤病灶[3, 5]。完整切除肿瘤后病情可获得缓解。
尽管TIO是一种慢性可治愈疾病,但并发DVT、PE可能危及生命,临床医师应加强及时识别DVT和PE的意识,提高对其的诊治能力。DVT和PE具有共同的危险因素,即VTE的危险因素,包括任何可以引起血液高凝状态、静脉壁损伤和静脉血液瘀滞的因素,可分为原发性和继发性因素[4, 11]。原发性因素包括蛋白S缺乏、抗凝血酶缺乏等;继发性因素中较为突出的是恶性肿瘤、手术与制动,分别占20%、15%、15%;其他还包括骨折(特别是髋部、骨盆和下肢骨折)、创伤、高龄、肥胖、长期使用雌激素、自身免疫性疾病、吸烟等[4, 11-12]。与年轻患者相比,40岁以后发生VTE风险显著增加,且VTE的年平均发病率随年龄呈指数增长[12]。但仍有部分VTE无明确的促发因素。鉴别诊断方面,本文患者2检测蛋白S低,但为急性血栓期、抗凝治疗期间检测,可能存在干扰,且遗传性蛋白S缺陷症是一种常染色体显性遗传性疾病,患者2亦无明确家族史。自身免疫性疾病也会增加血栓风险,但两例患者均无相关症状,且免疫指标筛查阴性,暂不考虑。然而,对于TIO并发VTE的患者仍需随时要注意评估有无其他继发因素如易栓症、自身免疫性疾病等。TIO的肿瘤多为良性的间叶组织肿瘤[10],文中2例TIO患者的病理亦不支持恶性,故未纳入恶性肿瘤这一危险因素。文中3例骨软化并发VTE患者共同的危险因素为制动、骨折、年龄>40岁。TIO患者平均起病年龄(42±14) 岁,病理性骨折发生率高达84.6%,且所有患者病程中均出现活动困难[13]。由此可见年龄>40岁、制动、骨折等危险因素在TIO患者中并不罕见。对于TIO患者除了需要评估有无VTE危险因素,还需要注意观察有无相关临床表现。DVT主要表现为患肢肿痛,可以出现浅静脉显露,严重的DVT可以出现股白肿甚至股青肿;PE常见的症状为呼吸困难、胸痛、晕厥、咯血等[4, 11]。本文总结的3例患者PE症状轻重不一。由于DVT、PE临床表现多样且缺乏特异性,部分可无任何症状,因此单纯依赖临床症状和体征做出判断并不可靠[14-15]。临床评分系统能够将VTE危险因素和患者症状、体征结合,有助于患者分层和指导进一步检查。对TIO患者建议采用Wells评分评估DVT、PE的临床可能性,另外也可应用修正Geneva评分[4, 15]。此外,DD>0.5 mg/L FEU对VTE有重要参考价值,其诊断VTE的敏感度高(80%~100%),但特异度低(23%~63%);其升高还可见于弥散性血管内凝血、恶性肿瘤、手术等,尤为注意的是DD随着年龄增长升高,建议50岁以上患者可采用年龄校正的DD界值,即年龄×0.01 mg/L FEU[4, 16-17]。DD假阴性的情况也存在,与就诊延迟、检测方法等相关[18]。对于临床评分为VTE可能或者伴有DD升高的患者需要进一步完善影像学检查明确诊断。多普勒超声是DVT诊断的首选方法,CTV可以更好评估髂静脉情况;CTPA是PE诊断的首选检查,而对于CTPA检查存在禁忌的患者可以行肺通气/灌注扫描[14]。此外,血气可有低氧血症,心电图和超声心动图有助于鉴别其他心血管疾病。然而,即使诊断明确,TIO并发VTE进一步加大治疗的难度和风险。TIO首选手术治疗,在并发VTE的情况下,行腹部、盆腔或下肢手术可以考虑植入下腔静脉滤器[4, 11]。同时应积极寻找并去除引起VTE的继发因素。VTE的治疗还包括抗凝、溶栓等,慢性期患者建议长期使用弹力袜。抗凝治疗是VTE的基本治疗,目前推荐维生素K拮抗剂联合低分子肝素或普通肝素,INR达标后停用低分子肝素或普通肝素,也可以选用直接Xa因子抑制剂(利伐沙班);由于华法林治疗剂量范围窄,个体差异大,需定期监测INR,维持INR在2.0~3.0[11]。指南推荐抗凝治疗的疗程至少3个月,对于危险因素不明或者PE起病的患者可酌情延长抗凝疗程,但需要综合评估血栓复发和主要出血的风险[4, 11, 14]。血流动力学不稳定的急性PE患者可行溶栓治疗[4]。
本文报道了2例TIO并发DVT、PE患者,其成功诊治源自于对VTE的早期识别、及时治疗和多科协作。TIO治疗首选手术治疗,VTE的存在增加手术风险、威胁患者生命,因此术前明确是否并发VTE至关重要。对于TIO患者临床上要注意评估有无VTE危险因素、观察有无VTE相关症状。特别对于高龄、多发骨折及长期卧床的TIO患者,尤为需要警惕VTE可能,建议采用临床评分联合DD共同评估VTE可能性,对可疑患者进一步完善多普勒超声、CTPA检查明确诊断。治疗上,对于TIO并发VTE的患者,积极抗凝,植入下腔静脉滤器后行致病肿瘤病灶切除术有效。虽然本文两例患者均为TIO并发VTE,但两者也有不同。患者1为急性VTE,其临床症状较典型;而患者2为慢性VTE,其临床症状相对隐匿,提示诊治过程中需要注意个体化差异。
| [1] | McCance RA. Osteomalacia with Looser's nodes (Milkman's syndrome) due to a raised resistance to vitamin D acquired about the age of 15 years[J]. Q J Med, 1947, 16: 33–46. |
| [2] | Kumar R, Folpe AL, Mullan BP. Tumor-induced osteomalacia[J]. Transl Endocrinol Metab, 2015, 7: 1871. |
| [3] | Chong WH, Molinolo AA, Chen CC, et al. Tumor-induced osteomalacia[J]. Endocr Relat Cancer, 2011, 18: R53–R77. DOI:10.1530/ERC-11-0006 |
| [4] | Di Nisio M, van Es N, Buller HR. Deep vein thrombosis and pulmonary embolism[J]. Lancet, 2016, 388: 3060–3073. DOI:10.1016/S0140-6736(16)30514-1 |
| [5] | Dadoniene J, Miglinas M, Miltiniene D, et al. Tumour-induced osteomalacia:a literature review and a case report[J]. World J Surg Oncol, 2016, 14: 4. |
| [6] | Slot-Steenks MM, Hamdy NA, van de Sande MA, et al. Identifying the culprit lesion in tumor induced hypophosphatemia, the solution of a clinical enigma[J]. Endocrine, 2016, 54: 642–647. DOI:10.1007/s12020-016-1092-5 |
| [7] | Ledford CK, Zelenski NA, Cardona DM, et al. The phosphaturic mesenchymal tumor:why is definitive diagnosis and curative surgery often delayed?[J]. Clin Orthop Relat Res, 2013, 471: 3618–3625. DOI:10.1007/s11999-013-3178-1 |
| [8] | Lewiecki EM, Urig EJ, Williams RJ. Tumor-induced osteomalacia:lessons learned[J]. Arthritis Rheum, 2008, 58: 773–777. DOI:10.1002/(ISSN)1529-0131 |
| [9] | Szigeti N, Feher E, Fabian G. Osteomalacia with fatal outcome in an elderly patient[J]. Dtsch Med Wochenschr, 2003, 128: 2644–2646. DOI:10.1055/s-2003-45482 |
| [10] | Hautmann AH, Hautmann MG, Kolbl O, et al. Tumor-induced osteomalacia:an up-to-date review[J]. Curr Rheumatol Rep, 2015, 17: 512. |
| [11] | 中华医学会外科学分会血管外科学组. 深静脉血栓形成的诊断和治疗指南(第二版)[J]. 中国血管外科杂志:电子版, 2013, 5: 23–26. |
| [12] | Anderson FJ, Spencer FA. Risk factors for venous thromboembolism[J]. Circulation, 2003, 107: I9–I16. DOI:10.1161/01.CIR.0000046771.12875.6C |
| [13] | Jiang Y, Xia WB, Xing XP, et al. Tumor-induced osteomalacia:an important cause of adult-onset hypophosphatemic osteomalacia in China:Report of 39 cases and review of the literature[J]. J Bone Miner Res, 2012, 27: 1967–1975. DOI:10.1002/jbmr.1642 |
| [14] | Min SK, Kim YH, Joh JH, et al. Diagnosis and treatment of lower extremity deep vein thrombosis:Korean practice guidelines[J]. Vasc Specialist Int, 2016, 32: 77–104. DOI:10.5758/vsi.2016.32.3.77 |
| [15] | Saar JA, Maack C. Diagnosis and management of acute pulmonary embolism. ESC Guidelines 2014[J]. Herz, 2015, 40: 1048–1054. DOI:10.1007/s00059-015-4378-0 |
| [16] | Crawford F, Andras A, Welch K, et al. D-dimer test for excluding the diagnosis of pulmonary embolism[J]. Cochrane Database Syst Rev, 2016: CD010864. |
| [17] | Pulivarthi S, Gurram MK. Effectiveness of D-dimer as a screening test for venous thromboembolism:an update[J]. N Am J Med Sci, 2014, 6: 491–499. DOI:10.4103/1947-2714.143278 |
| [18] | 陈胜龙, 曾红科, 黄伟平, 等. D-二聚体阴性肺栓塞患者的危险因素分析[J]. 中华急诊医学杂志, 2015, 24: 1436–1440. DOI:10.3760/cma.j.issn.1671-0282.2015.12.024 |
| (收稿日期:2017-03-23) |

