2. 215123 苏州,苏州大学唐仲英医学研究院血液学研究中心;
3. 215004 苏州,苏州大学骨质疏松症诊疗技术研究所
2. Hematology Center of Cyrus Tang Medical Institute, Soochow University School of Medicine, Suzhou 215123, Jiangsu, China;
3. Osteoporosis Institute of Soochow University, Suzhou 215004, Jiangsu, China
许多病理状态铁过载疾病存在骨质疏松并发症,例如血红蛋白沉着病、含铁血黄素沉着症、地中海贫血、镰状细胞疾病[1-4];2006年Weinberg提出假说认为体内铁增加是骨质疏松症的危险因素[5]。近年来,许多研究发现绝经后女性会出现铁蓄积,且铁蓄积与骨质疏松症显著相关[6]。女性铁蓄积可能与雌激素减少相关,已有研究采用卵巢切除术 (ovariectomy,OVX) 动物模型,探讨雄性动物铁蓄积会不会骨量下降?降铁干预可否恢复骨量下降。目前这方面研究较少,本实验研究雄性铁蓄积小鼠模型骨量变化和降铁剂去铁胺 (deferoxamine,DFO) 对骨量变化的影响。
材料与方法 实验动物体内实验使用SPF级8周雄性C57小鼠 (苏州大学实验动物中心),实验动物许可证号:SYXK (苏)2014-0030,18只小鼠分为对照组、铁蓄积组、DFO干预组,每组6只。
铁蓄积 (FAC) 组:使用枸橼酸铁铵 (ferric ammonium citrate,FAC) 腹腔注射,剂量每周0.1 g/kg,共8周[7]。
DFO干预 (FAC+DFO) 组:使用FAC腹腔注射,剂量每周0.1 g/kg,共8周,第4周FAC干预后1 h腹腔注射DFO,剂量每周0.2 g/kg[8]。
对照 (Ctrl) 组:采用腹腔注射0.9%氯化钠注射液处理每周0.1 g/kg,共8周。8周后所有小鼠麻醉处死。
血清铁蛋白检测各组小鼠相同条件饲养8周后处死并眼眶取血,酶联免疫吸附测定 (enzyme-linked immuno sorbent assay,ELISA) 法检测血清铁蛋白 (ferritin, FER, ABCam),具体操作步骤按说明书进行。
骨量micro-CT评估各组小鼠处死分离单侧股骨,使用micro-CT扫描,进行股骨远端骨小梁三维形态重建和空间结构参数分析,分析参数包括:骨密度 (bone mineral density,BMD)、骨体积分数 (bone volume/tissue volume,BV/TV)、骨小梁厚度 (trabecular thickness,Tb.Th)、骨小梁分离度 (trabecular separation,Tb.Sp)。
细胞培养MC3T3细胞 (中科院上海细胞库) 使用包含10% FBS (Gibco)、100 U/mL青霉素 (Beyotime)、100 μg/mL链霉素 (Beyotime) 的α-MEM (Hyclone) 培养基在5% CO2、37 ℃环境培养,72 h后换液,培养3 d进行传代。
ALP活性检测MC3T3细胞以每孔1×105/mL密度接种于6孔板中。细胞24 h后贴壁加入50 mg/L抗坏血酸和10 mmol/L β甘油酸钠,FAC组培养基中加入FAC 100 μmol/L培养48 h,DFO干预组加FAC 100 μmol/L,第24小时加DFO 10 μmol/L[9],对照组加PBS 100 μmol/L 48 h。各组48 h后每孔加入75 μL Triton X-100裂解细胞,收集上清液后用BCA试剂盒 (Beyotime Biotichnology) 测定总蛋白浓度,用碱性磷酸酶 (alkaline phosphatase,ALP) 活性测定试剂盒 (Labassay) 测ALP含量。使用酶标仪测定波长为520 nm各孔的吸光度并据此计算单位蛋白浓度中ALP的相对活性。
Western blotting法检测MC3T3细胞经PBS清洗使用裂解液提取蛋白,BCA定量后取60 μg蛋白进行SDS-PAGE电泳,之后转移至PVDF膜,常规免疫染色[兔抗-骨形成蛋白 (bone morphogenetic protein,BMP)2,Boster;人抗-GAPDH,上海康成有限责任公司],4 ℃过夜,TBST冲洗后二抗孵育1 h,DAB显色。
统计学方法采用统计软件SPSS19.0进行统计,采用方差分析,实验数据以均数±标准差 (x±s) 表示。P < 0.05表示差异有统计学意义。
结果 血清铁蛋白水平ELISA结果显示,FAC组与对照组相比,FAC组干预8周后FER水平明显上升;DFO干预组与FAC组相比,DFO能降低体内铁蓄积水平,差异具有统计学意义 (P < 0.05)(图 1)。
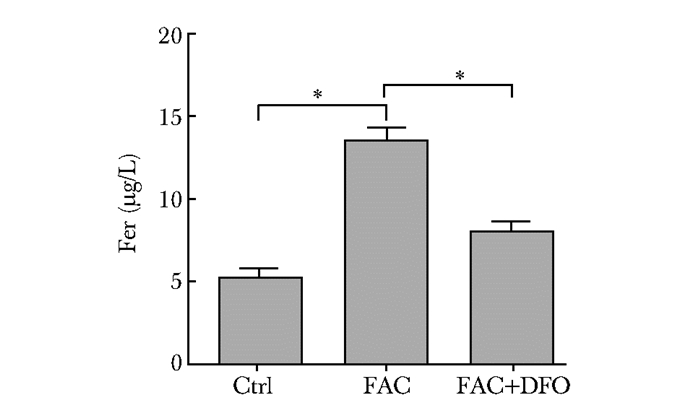
|
| 图 1 铁蓄积组与对照组血清FER的比较 Figure 1 Comparison of serum FER among FAC group, FAC+DFO group and control group Ctrl:对照组; FAC:铁蓄积组; FAC+DFO:铁蓄积后DFO干预组; DFO:去铁胺;FER:去铁蛋白 |
小鼠股骨远端micro-CT检测FAC组与对照组相比,FAC组干预8周后骨小梁结构破坏、骨小梁稀疏、连续性下降; DFO干预组与FAC组相比,DFO能缓解铁蓄积造成的骨量减低 (图 2);骨小梁空间结构参数显示:FAC组BMD、BV/TV、Tb.Th比对照组明显下降,Tb.Sp值增大,DFO干预组恢复正常,差异具有统计学意义 (P < 0.05)(表 1)。

|
| 图 2 Micro-CT股骨远端骨小梁三维重建图 Figure 2 Three-dimensional reconstruction map by micro-CT at distal femoral trabecula |
| 组别 | BMD (mg/mm3) | BV/TV (%) | Tb.Th (mm) | Tb.Sp (mm) |
| Ctrl (n=6) | 104.68±8.56 | 19.92±1.92 | 0.098±0.008 | 0.172±0.133 |
| FAC (n=6) | 50.41±10.27* | 10.18±1.76* | 0.057±0.012* | 0.322±0.214* |
| FAC+DFO (n=6) | 92.72±9.62# | 17.84±1.54# | 0.085±0.010# | 0.186±0.195# |
| Ctrl:对照组; FAC:铁蓄积组; FAC+DFO:铁蓄积后DFO干预组;BMD:体积骨密度值;BV/TV:骨体积分数;Tb.Th:骨小梁厚度;Tb.Sp:骨小梁分离度;与Ctrl组比较,*P < 0.05;与FAC组比较,#P < 0.05 | ||||
对照组、FAC组、DFO干预组细胞ALP活性值分别为0.71±0.06、0.33±0.04、0.59±0.03,FAC组与对照组、DFO干预组与FAC组比较有统计学意义 (P < 0.05)(图 3)。
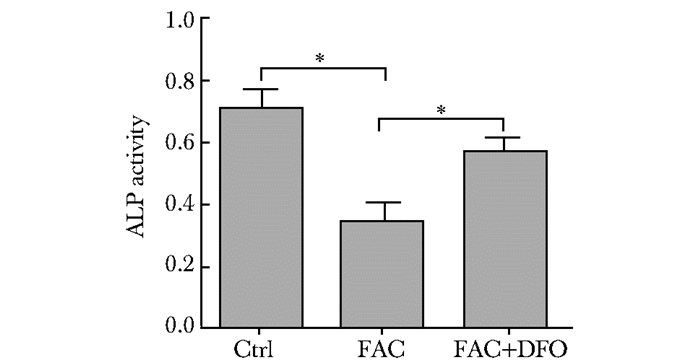
|
| 图 3 各组细胞ALP活性比较 Figure 3 ALP activity by flow cytometry compared among FAC group, FAC+DFO group and control group Ctrl:对照组; FAC:铁蓄积组; FAC+DFO:铁蓄积后; DFO干预组; DFO:去铁胺;ALP:碱性磷酸酶; *P < 0.05 |
相比于对照组,FAC组细胞BMP2表达量降低,加入DFO后细胞BMP2表达量恢复正常 (图 4)。
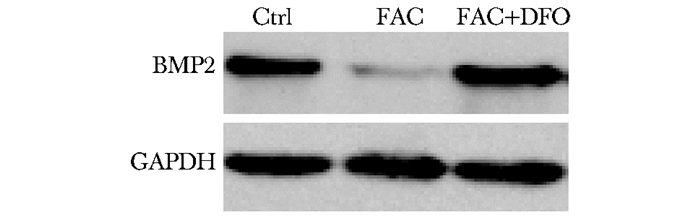
|
| 图 4 各组BMP2蛋白表达水平变化 Figure 4 BMP2 protein expression among FAC group, FAC+DFO group and control group BMP2:骨形成蛋白2;Ctrl:对照组; FAC:铁蓄积组; FAC+DFO:铁蓄积后DFO干预组; DFO:去铁胺 |
原发性骨质疏松症分为两型,Ⅰ型骨质疏松主要与雌激素减少相关,Ⅱ型骨质疏松主要与年龄相关。铁蓄积在Ⅰ型骨质疏松症的研究比较丰富,主要认为雌激素减少会导致女性月经排血停止造成铁蓄积 (正常女性1年可以通过月经排铁36 mg)。本研究在这一背景下,观察雄性小鼠 (排除雌激素影响) 增加外源性铁含量后骨量改变,并进一步观察降铁剂对铁蓄积雄性小鼠骨量改变的影响。
本实验在雄性小鼠中使用腹腔注射8周FAC制作铁蓄积模型,血清ELISA结果证实体内血清铁蛋白升高,micro-CT结果显示股骨远端骨量下降、骨小梁稀疏。这结果提示:雄性小鼠发生铁蓄积也可导致骨质疏松[10-11],该现象可能和活性氧簇 (reactive oxygen species,ROS) 升高有关[7]。骨量下降有许多机制,其中BMP2是一种低分子量糖蛋白,与骨生成和再生有关,基因重组研究发现体内和体外BMP2表达能诱导骨的生成[12],BMP2抑制可以导致骨量下降。Shen等[13]发现在Hepc1-/-铁调素缺乏铁蓄积小鼠模型中骨量下降、骨微结构破坏,BMP/SMAD通路受抑制。BMP2存在于骨基质中,对间充质干细胞 (mesenchymal stem cells,MSCs) MSCs有趋化和促进增生的作用,调节MSCs成骨分化[14]。MC3T3细胞来源于MSCs,是成骨细胞前体细胞。本研究在细胞实验中铁蓄积可抑制成骨前体细胞BMP2表达,这提示,铁蓄积在雄性小鼠中可能影响成骨形成。
铁蓄积的临床干预主要是铁螯合剂使用。本实验在铁蓄积模型中,使用降铁药物DFO干预,micro-CT结果显示DFO可以抑制铁蓄积造成的骨量下降,同时血清铁蛋白水平降低;细胞实验提示:铁蓄积导致成骨细胞ALP活性下降,DFO干预后成骨细胞ALP活性恢复,Chen等[15]在斑马鱼铁蓄积模型中使用DFO干预,结果提示DFO可以抑制铁蓄积诱发的骨量下降。已有实验证实DFO对雄性和雌性小鼠铁蓄积诱导骨量下降有抑制作用[16-17],本实验主要研究DFO对铁蓄积雄性小鼠骨量下降成骨指标ALP和BMP表达的影响。另外,MSCs与成骨细胞形成关系密切,在成骨过程中起重要作用,Najafi等[18]研究发现DFO能促进MSCs归巢,与低氧诱导因子-1α(hypoxia inducible factor-1α,HIF-1α)、趋化因子受体4(chemokine receptor4,CXCR4)、趋化因子受体 (CCR-2)、金属基质蛋白酶2(matrix metalloproteinase-2,MMP-2)、金属基质蛋白酶9(matrix metalloproteinase-9,MMP-9) 表达升高有关。Xie等[19]研究提示铁蓄积可通过ROS抑制骨髓MSCs活性,使用DFO可以缓解;此外也有研究发现DFO可促进血管生成,抑制骨量降低[20]。本实验表明铁蓄积可以抑制细胞活性,DFO干预可以缓解铁蓄积相关的骨量下降。
综上所述,雄性小鼠铁蓄积模型骨量下降,DFO能降低体内铁蓄积、缓解骨量丢失作用,可能与DFO阻断铁蓄积对成骨细胞ALP、BMP2的抑制有关。降低铁蓄积方法有可能成为铁蓄积骨质疏松治疗的补充干预新方法。
| [1] | Guggenbuhl P, Deugnier Y, Boisdet JF, et al. Bone mineral density in men with genetic hemochromatosis and HFE gene mutation[J]. Osteoporos Int, 2005, 16 : 1809–1814. DOI:10.1007/s00198-005-1934-0 |
| [2] | Lorincz G, Traub NE, Chuke PO, et al. African haemosiderosis associated with osteoporosis and vertebral collapse[J]. East Afr Med J, 1974, 51 : 488–495. |
| [3] | Salama OS, Al-Tonbary YA, Shahin RA, et al. Unbalanced bone turnover in children with beta-thalassemia[J]. Hematology, 2006, 11 : 197–202. DOI:10.1080/10245330600702851 |
| [4] | Sarrai M, Duroseau H, D'Augustine J, et al. Bone mass density in adults with sickle cell disease[J]. Br J Haematol, 2007, 136 : 666–672. DOI:10.1111/bjh.2007.136.issue-4 |
| [5] | Weinberg ED. Iron loading: a risk factor for osteoporosis[J]. Biometals, 2006, 19 : 633–635. DOI:10.1007/s10534-006-9000-8 |
| [6] | Kim BJ, Ahn SH, Bae SJ, et al. Iron overload accelerates bone loss in healthy postmenopausal women and middle-aged men: a 3-year retrospective longitudinal study[J]. J Bone Miner Res, 2012, 27 : 2279–2290. DOI:10.1002/jbmr.v27.11 |
| [7] | Tsay J, Yang Z, Ross FP, et al. Bone loss caused by iron overload in a murine model: importance of oxidative stress[J]. Blood, 2010, 116 : 2582–2589. DOI:10.1182/blood-2009-12-260083 |
| [8] | Link G, Ponka P, Konijn AM, et al. Effects of combined chelation treatment with pyridoxal isonicotinoyl hydrazone analogs and deferoxamine in hypertransfused rats and in iron-loaded rat heart cells[J]. Blood, 2003, 101 : 4172–4179. |
| [9] | Regis G, Bosticardo M, Conti L, et al. Iron regulates T-lymphocyte sensitivity to the IFN-gamma/STAT1 signaling pathway in vitro and in vivo[J]. Blood, 2005, 105 : 3214–3221. |
| [10] | Rossi F, Perrotta S, Bellini G, et al. Iron overload causes osteoporosis in thalassemia major patients through interaction with transient receptor potential vanilloid type 1 (TRPV1) channels[J]. Haematologica, 2014, 99 : 1876–1884. DOI:10.3324/haematol.2014.104463 |
| [11] | He YF, Ma Y, Gao C, et al. Iron overload inhibits osteoblast biological activity through oxidative stress[J]. Biol Trace Elem Res, 2013, 152 : 292–296. DOI:10.1007/s12011-013-9605-z |
| [12] | Riley EH, Lane JM, Urist MR, et al. Bone morphogenetic protein-2: biology and applications[J]. Clin Orthop Relat Res, 1996, 324 : 39–46. DOI:10.1097/00003086-199603000-00006 |
| [13] | Shen GS, Yang Q, Jian JL, et al. Hepcidin1 knockout mice display defects in bone microarchitecture and changes of bone formation markers[J]. Calcif Tissue Int, 2014, 94 : 632–639. |
| [14] | Wozney JM, Rosen V. Bone morphogenetic protein and bone morphogenetic protein gene family in bone formation and repair[J]. Clin Orthop Relat Res, 1998, 346 : 26–37. |
| [15] | Chen B, Yan YL, Liu C, et al. Therapeutic effect of deferoxamine on iron overload-induced inhibition of osteogenesis in a zebrafish model[J]. Calcif Tissue Int, 2014, 94 : 353–360. DOI:10.1007/s00223-013-9817-4 |
| [16] | 高超. 甲磺酸去铁胺对去势小鼠、大鼠骨质疏松模型影响的实验研究[D]. 苏州: 苏州大学, 2013. |
| [17] | 刘禄林, 王啸, 李光飞, 等. 甲磺酸去铁胺治疗铁蓄积致骨量下降雄性小鼠的实验研究[J]. 中华骨质疏松杂志, 2015, 21 : 88–93. |
| [18] | Najafi R, Sharifi AM. Deferoxamine preconditioning potentiates mesenchymal stem cell homing in vitro and in streptozotocin-diabetic rats[J]. Expert Opin Biol Ther, 2013, 13 : 959–972. DOI:10.1517/14712598.2013.782390 |
| [19] | 谢芳, 赵明峰, 李玉明, 等. 铁过载诱导活性氧物质生成对骨髓造血功能影响的体外实验研究[J]. 中华血液学杂志, 2011, 32 : 606–609. |
| [20] | Jia P, Chen H, Kang H, et al. Deferoxamine released from poly (lactic-co-glycolic acid) promotes healing of osteoporotic bone defect via enhanced angiogenesis and osteogenesis[J]. J Biomed Mater Res A, 2016, 104 : 2515–2527. |
| (收稿日期:2016-01-25) |

