2. 510900 广州,南方医科大学附属第五医院骨科;
3. 315000 宁波,宁波市第二医院骨科
2. Department of Orthopedics, Fifth Affiliated Hospital of Southern Medical University, Guangzhou 510900, China;
3. Department of Orthopedics, Ningbo No.2 Hospital, Ningbo 315000, Zhejiang, China
甲状旁腺素(parathyroid hormone,PTH)是公认的具有促进骨形成作用的激素[1],在临床治疗中,PTH被证实具有可靠的抗骨质疏松作用,其生物制剂也是目前一线的抗骨质疏松药物。然而,PTH具有间断小剂量促进骨形成,连续大剂量促进骨吸收的双向调节作用,这种特殊的双向调节作用导致PTH治疗尚没有达到理想效果[2]。此外,如何将PTH促进骨形成的作用较好地运用到骨折愈合期以加速患者的康复是目前研究的热点。唑来膦酸是含双氮的第3代双膦酸类药物,对于促进破骨细胞的凋亡有较强的作用。已有研究证实每年5 mg的唑来膦酸盐可以明显提高绝经后骨质疏松女性的腰椎、髋部及股骨颈的骨密度(bone mineral density,BMD),降低跌倒风险[3]。有研究显示,松质骨在骨折的修复过程中会有短暂的化生骨形成,但会很快被吸收,如果使用了双膦酸盐,就会阻止吸收,给骨折修复提供一个支架,加速骨折的愈合[4]。但也有文献提出双膦酸盐不能促进骨折的愈合[5]。此外,以往有研究者探索PTH联合双膦酸盐对骨质疏松的疗效,发现各有不同的结果[6]。本实验旨在观察促骨形成的PTH联合抗骨吸收的唑来膦酸钠对骨质疏松性骨折愈合的影响,为开发更有效的促骨形成药物提供理论依据。
材料与方法 实验动物选用12周龄C57BL/6雌性小鼠96只,体质量23~25 g。均购自广东省医学实验动物中心,实验动物使用许可证号:SYXK(粤)2010-0056,分笼饲养1周,13周龄时进行模型的建立。后将小鼠采用数字表法随机分为4组:0.9%氯化钠注射液组、PTH1-34组、唑来膦酸组(zoledronic acid, ZA)、PTH1-34+ZA组。
仪器与试剂PTH1-34由广州特立公司合成,质谱分析纯度超过95%。将该肽全部溶解在0.1%三氟乙酸(trifluoroacetic acid,TFA)中,分装储存于-80 ℃冰箱,注射前稀释成适当浓度。唑来膦酸(国药准字H20041953,江苏恒瑞医药股份有限公司),储存在4 ℃,注射前稀释成适当浓度。Micro-CT仪器(Skyscan1176,Bruker公司,美国);生物力学测试仪器为单轴电磁伺服试验机(E1000,Instron公司,英国);恒温蜡箱、石蜡切片机、石蜡包埋机(Leica公司,德国);显微镜(IX71,Olympus公司,日本);实时定量荧光PCR仪(ABI7500,美国);相关引物购自上海英潍捷基贸易有限公司;Trizol、RT-PCR试剂盒、SYBR® Premix Ex TaqTM试剂盒购自日本Takara公司。
骨质疏松骨折模型的建立按照经典的切除双侧卵巢的方法建立骨质疏松模型[7]。术后连续3 d腹腔注射青霉素(80 000 U/kg)。将去势的小鼠常规饲养4周后,异氟烷气体(300 mL/min)吸入麻醉后,左侧大腿备皮、皮肤消毒,参考小鼠股骨骨折模型相关的文献[8-9],于左大腿后外侧作1.5 cm的切口,钝性分离肌肉及软组织,暴露股骨,从膝关节处逆行插入直径为0.45 mm钢针进行髓内固定,直视下用手术刀切断股骨中下1/3段部分,造成横行骨折。术毕缝合切口。术后连续3 d腹腔注射青霉素(80 000 U/kg),定时观察伤口愈合情况。
药物治疗骨折术后,将所有小鼠采用数字表法随机分成4组,每组16只,使用相应的药物进行皮下注射,对照组(等剂量0.9%氯化钠注射液,每周5 d,连续4周),PTH1-34(间断用药,40 μg/kg,每周5 d,连续4周),ZA(100 μg/kg,首次注射1次),PTH1-34+ZA(PTH1-34 40 μg/kg,每周5 d,连续4周;ZA,100 μg/kg,首次注射1次),本实验PTH和ZA剂量以过往文献[10-11]为参考。
骨痂处Micro-CT检查各组小鼠在给药后2和4周分别处死8只,将左侧股骨分离,小心剥离周围的软组织及肌肉,并拔除钢针,将整段股骨浸泡在10%甲醛48 h,后取出放在70%乙醇保存在4 ℃,取左侧股骨进行Micro-CT扫描,股骨用湿润的纸巾包裹,放入样本扫描固定器中,确保股骨长轴和扫描器长轴一致,扫描参数设定:选定全部骨痂区域,50 kV,98 μA,每层厚度9 μm,扫描结束后运用Micro-CT自带软件进行新生骨痂区域的选定,并对以下参数进行量化统计:BMD、骨体积(bone volume,BV)、相对骨体积(relative bone volume,BV/TV)、骨小梁厚度(trabecular thickness,Tb.Th)。
生物力学检测进行Micro-CT扫描后的给药2和4周的左侧股骨,进行三点弯曲测试。测试中,选取支点跨距为6 mm,在骨痂中点处垂直施加载荷,速率为2 mm/min。发生骨折时记录下最大力,根据力与位移曲线计算出刚度。本实验过程均由单轴电磁伺服试验机自带软件进行记录、分析。
组织学分析分离术侧股骨后,置于4 ℃浓度为4%多聚甲醛24 h。选取长约6 mm股骨骨痂区,用20%乙二胺四乙酸(EDTA)进行脱钙,每周更换脱钙液,以针刺无阻力提示脱钙终止。乙醇逐级脱水和二甲苯透明处理,然后用石蜡包埋机进行包埋。选取横断位5 μm厚度连续切片,行HE染色,图像系统摄片。
RT-PCR检测分离小鼠右侧股骨,用液氮研磨法将股骨磨成粉末,使用Trizol一步法提取总RNA后,将各自样本的RNA按照说明书用RT-PCR试剂盒反转录成cDNA,内参基因选用GAPDH,使用ABI7500实时荧光定量PCR仪进行SYBR实时定量PCR反应,采用2-ΔΔCt法计算碱性磷酸酶(alkaline phosphatase,ALP)和骨唾液蛋白酸(bone sialoprotein,BSP)mRNA相对表达量,引物序列见表 1。
| 基因 | 正向(5′→3′) | 反向(5′→3′) |
| GAPDH | TGTCGTGGAGTCTACTGGTG | GCATTGCTGACAATCTTGAG |
| ALP | GCTGATATGAGATGTCCTT | GCACTGCCACTGCCTACT |
| BSP | AGGGAACTGACCAGTGTTGG | ACTCAACGGTGCTGCTTTTT |
| ALP:碱性磷酸酶;BSP:骨唾液蛋白酸 | ||
采用SPSS20.0统计学软件进行分析,实验中测得结果重复3次,计量资料以均数±标准差(x±s)表示,以单因素方差分析每个治疗组测量指标的均数,若组间具有差异,则进行多重比较(采用LSD-t检验进行两两比较),以P<0.05为差异有统计学意义。
结果 Micro-CT结果Micro-CT图像(冠状位与横断位):给药后2周,各个治疗组相对于0.9%氯化钠注射液组具有有更丰富的骨痂,其中PTH1-34+ZA组和ZA组的骨痂量相仿,并稍多于PTH1-34组。给药后4周,PTH1-34组和PTH1-34+ZA组骨痂明显缩小,骨折线逐渐模糊,0.9%氯化钠注射液组和ZA组骨痂无明显减少,骨折线明显。且在给药后4周,PTH1-34+ZA组相比较于PTH1-34组,骨痂及皮质BMD明显较高。
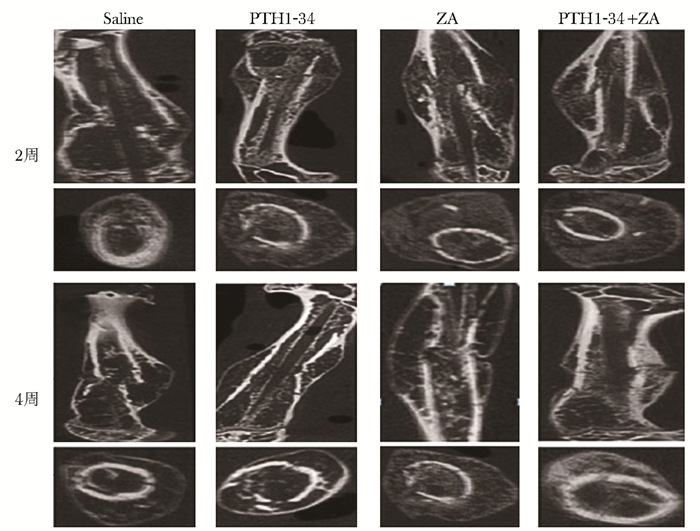
|
| 图 1 给药后2和4周各组显微CT图像 Figure 1 Micro-CT images of each group at the 2 weeks and 4 weeks after administration |
BMD值比较:给药后2周,各个治疗组的BMD值均明显高于saline组(P<0.05)。PTH 1-34+ZA组的BMD值(0.062±6.069) g/cm3,在各个治疗组中最高,与saline组和ZA组比较,差异有统计学意义(P<0.05),而与PTH1-34组的BMD值(0.055±0.003) g/cm3比较,差异无统计学意义(P>0.05,图 2)。给药后4周,各个治疗组的BMD值间比较,差异均有统计学意义(P<0.05)。高低顺序依次为PTH1-34+ZA组>PTH1-34组>ZA组>saline组(P>0.05)(图 2)。
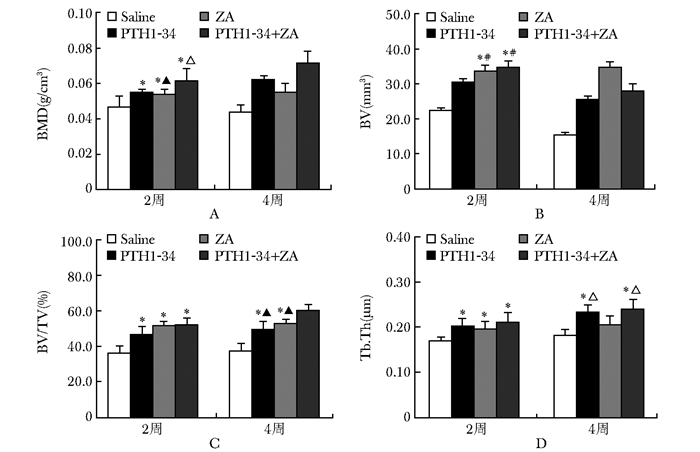
|
| 图 2 给药后2周和4周的Micro-CT检测结果 Figure 2 Results of Micro-CT at the 2 weeks and 4 weeks after administration ZA:唑来膦酸;BMD:骨密度;BV:骨体积;BV/TV:相对骨体积;Tb.Th:骨小梁厚度;PTH:甲状旁腺素;与Saline组比较,*P<0.05;与PTH1-34组比较,#P<0.05;与ZA组比较,△P<0.05;与PTH1-34+ZA组,▲P<0.05 |
BV值比较:给药后2周,各个治疗组的BV值均高于saline组(P<0.05)。PTH1-34+ZA组BV值(34.8±2.6) mm3明显高于PTH1-34组的BV值(30.6±1.7)mm3,差异有统计学意义(P<0.05)。但是与ZA组的BV值(33.7±2.5)mm3比较,差异无统计学意义(P>0.05,图 2)。给药后4周,各个治疗组的BV值均逐渐下降,且各组间差异均有统计学意义(P<0.05)。高低顺序依次为ZA组>PTH1-34+ZA组>PTH1-34组>saline组(图 2)。
BV/TV值比较:给药后2周,各个治疗组的BV/TV值均高于saline组(P<0.05)。而PTH1-34+ZA组和PTH1-34组和ZA组之间的BV/TV值均差异无统计学意义(P>0.05,图 2)。给药后4周,PTH1-34+ZA组的BV/TV值(60.3±5.21)%明显高于ZA组的BV/TV值(53.1±3.3)%,差异有统计学意义(P<0.05),亦显著高于PTH1-34组的BV/TV值(49.7±6.6)%,差异有统计学意义(P<0.05)(图 2)。
Tb.Th值比较:给药后2周,各个治疗组的Tb.Th值均高于saline组(P<0.05)。而PTH1-34+ZA组和PTH1-34组和ZA组间的Tb.Th值,均差异无统计学意义(P>0.05,图 2)。给药后4周,PTH1-34+ZA组的Tb.Th值(0.241±0.029)μm显著高于ZA组的Tb.Th值(0.206±0.022)μm,差异有统计学意义(P<0.05)。同时亦高于PTH1-34组的Tb.Th值(0.234±0.023)μm,但是两者比较,差异无统计学意义(P>0.05,图 2)。
生物力学检测结果给药后2周,PTH1-34+ZA组的刚度分别为PTH1-34组和ZA组的1.15倍和1.26倍,差异有统计学意义(P<0.05)(图 3),最大力分别为该两组的1.22倍和1.36倍,差异有统计学意义(P<0.05)(图 3);给药后4周,PTH1-34+ZA组的刚度分别为PTH1-34组和ZA组的1.31倍和2.2倍,差异有统计学意义(P<0.05)(图 3),最大力分别为该两组的1.21倍和2倍,差异有统计学意义(P<0.05)(图 3)。
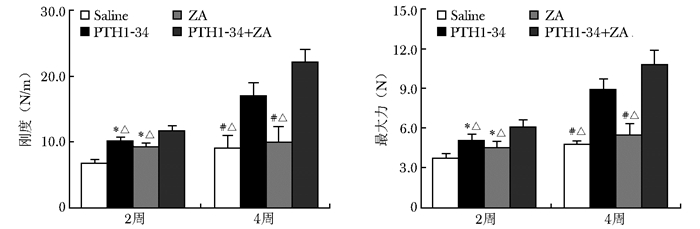
|
| 图 3 给药后2周和4周生物力学检测结果 Figure 3 Biomechanical results at the 2nd and 4th week after administration 与Saline组比较,*P<0.05;与PTH1-34组比较,#P<0.05;与PTH1-34+ZA组, △P<0.05 |
给药后2周,saline组的骨痂区以大量的软骨细胞分布,PTH1-34组和ZA组的骨痂区均以初级骨小梁为主,而PTH1-34组的致密性较ZA组更高;PTH1-34+ZA组的骨痂区的骨小梁排列更加规律,致密性最高。给药后4周,saline组的骨髓腔仍存在大量的编织骨,骨髓腔未通; ZA组的骨髓腔亦有较多的编织骨存在,骨髓腔再通不佳;PTH1-34+ZA组存在少量的编织骨,髓腔再通明显,但是仍略差于PTH1-34组(图 4)。
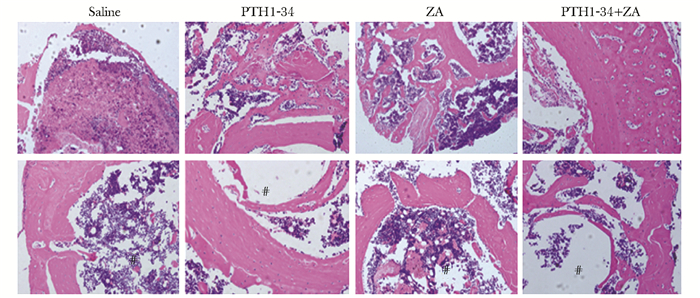
|
| 图 4 给药后2周和4周的骨痂区(HE染色,×100) Figure 4 HE staining of the callus area at the 2 weeks and 4 weeks after administration(×100) PTH:甲状旁腺素;ZA:唑来磷酸;#骨髓腔 |
给药后2周,PTH1-34+ZA组的ALP的表达显著高于其他各组,差异有统计学意义(P<0.05),BSP的表达虽然显著高于saline组,但均明显低于PTH1-34组或ZA组,差异有统计学意义(P<0.05,图 5);给药后4周,PTH1-34+ZA组的BSP的表达显著高于其他各组,ALP的表达也高于其他各组,差异有统计学意义(P<0.05),与PTH1-34比较,差异无统计学意义(P>0.05)。PTH1-34+ZA组的ALP在给药后2周的表达量是saline组的13.8倍,给药后4周为5.2倍;PTH1-34+ZA组的BSP在给药后2周的表达量是saline组的3.5倍,给药后4周为9.2倍(图 5)。
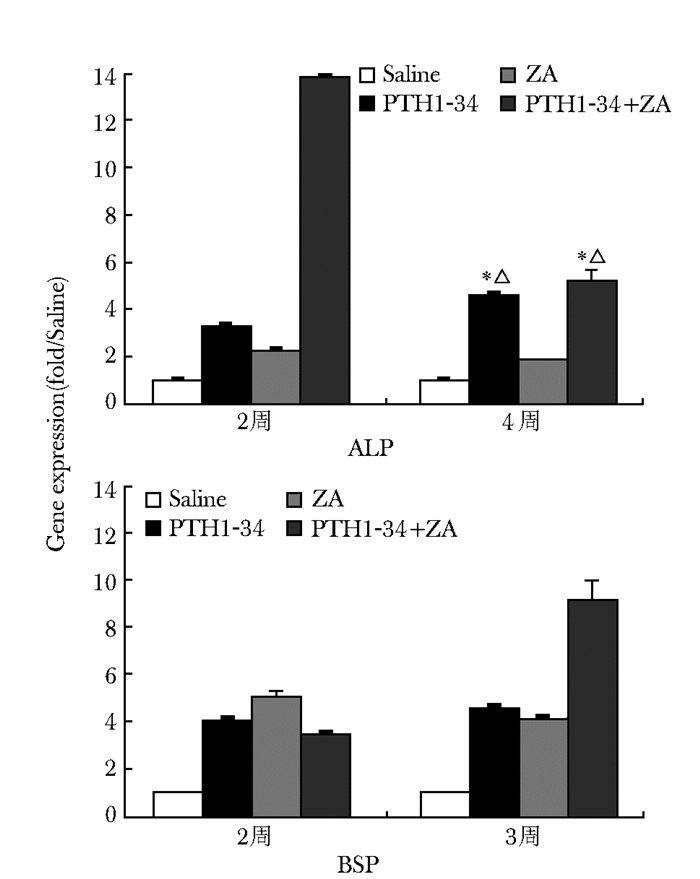
|
| 图 5 给药后2周和4周的基因表达情况 Figure 5 Gene expression at the 2 weeks and 4 weeks after administration 与Saline组比较,*P<0.05;与ZA组比较, △P<0.05;ALP:碱性磷酸酶;BSP:骨唾液酸蛋白 |
年龄>50岁的白种人群中,有50%的女性和20%的男性在今后的一生中会发生脆性骨折[12]。我国目前也正逐步进入老龄化,发生骨质疏松性骨折的老年患者数量也十分可观。PTH作为临床抗骨质疏松的一线药物,在动物及临床试验中已经被证实有促进骨折愈合的作用,双膦酸盐也被证实能在骨折早期减少骨吸收以增加骨痂体积和BMD[13],那么PTH联合双膦酸盐是否会有更好的促骨愈合作用?
借鉴既往相关文献,对小鼠行间断低剂量注射PTH1-34有较好的促骨形成作用[10]。同时,McDonald等[14]发现大剂量单次注射ZA(100 μg/kg)与连续注射ZA(每周1次20 μg/kg,连续5周)相比,硬化骨痂与骨矿物质含量明显较高。故本研究在药物浓度及注射频率上选择甲状旁腺素模拟肽[PTH1-34]间断低剂量注射(40 μg /kg,每周5 d,连续4周)联合唑来膦酸单次注射(100 μg/kg,首次注射1次)的方式观察这种联合给药的方法对于骨质疏松性骨折愈合的骨显微结构、生物力学强度、组织学及成骨相关基因表达的改变。
在Micro-CT中,本实验选取了BMD、BV、BV/TV、Tb.Th等指标描述骨量的变化。其中BMD是最直观的反应骨质疏松程度的指标,也是临床最常用的指标。BV代表骨体积;BV/TV代表骨体积分数,该值越大,代表骨量增加的越多;Tb.Th代表平均骨小梁粗度,发生骨质疏松时,Tb.Th值减小;结果显示PTH1-34组和ZA组的BMD值和BV/TV值均高于saline组,这与目前的研究相符,Iwata等[15]使用PTH治疗38例腰椎压缩性骨折患者,骨折愈合率达到了89%,明显高于对照组的68%,同时PTH治疗组的腰椎BMD值明显升高。Wang等[16]给予胫骨骨折的大鼠连续口服或者皮下注射双膦酸盐28 d后,发现双膦酸盐不仅能减轻疼痛,并且能够抑制破骨细胞活性减少骨小梁的丢失以增骨痂区的BMD。无论是给药后2周和4周,PTH1-34+ZA组的BMD、BV/TV、Tb.Th值均高于PTH1-34组和ZA组,表明PTH联合ZA在提升骨痂骨量和改进骨痂中骨小梁的显微结构方面有一定的叠加作用,最终在各组中表现出最大的BMD值。此外,在给药后2周,联合治疗组的BV/TV值相比于saline组上升了44.5%,4周时达到了60.8%。Casanova等[17]同样使用PTH1-34联合ZA治疗小鼠胫骨骨折,在骨折后3周,发现联合治疗的骨痂区的BV/TV值相比于空白对照组上升了41%,支持了联合治疗对于骨折愈合的有效性。其中该文献是在骨折后第8天开始注射药物,相当于进行Micro-CT测量时已经用药2周,因此用药时间和BV/TV值的增长与本研究相似,这可能提示药物注射时间点的不同对于骨折愈合的短期疗效无明显影响。
生物力学测试中,实验选取最大力和刚度分别代表骨痂骨折所需的应力以及骨痂部位抗形变的能力。结果发现给药后2周和4周,PTH1-34+ZA组的最大力和刚度均明显高于PTH1-34组或ZA组。同时结合Micro-CT数据的BV值可以发现,给药后2周,相比于saline组,药物治疗组的BV值均明显上升;4周时,PTH1-34组和PTH1-34+ZA组的BV值明显减少,而ZA组仍表现出较高的BV值,可能在骨折早期,主要依赖PTH的促骨形成作用增加骨量,加之ZA的抗骨吸收作用保留骨量来增强骨痂的力学强度,到了后期,骨折处力学稳定和强度的恢复则主要靠PTH对于骨痂的骨显微结构的改建。有研究发现,每天皮下注射PTH1-34不仅可以通过增加骨量提升大鼠BMD,并可以通过对髓腔中骨微结构的改建和增加骨小梁面积以提高小鼠骨骼的刚度和弹性模量,并降低其伸缩性[18]。而Hao等[19]对骨折大鼠注射唑来膦酸后发现该药物会延迟骨痂的重塑,但同时也能够明显增加骨痂的力学强度。根据Micro-CT图像,给药后2周的横断位和冠状位显示,各个药物治疗组的骨折处骨痂明显增加,4周时,PTH1-34组和PTH1-34组+ZA组的骨痂量逐渐减少,而ZA组的骨痂量未见明显减少,这也支持了PTH对骨痂的改建和重塑的理论。同时给药后4周的Micro-CT图像显示PTH1-34+ZA组的骨痂致密性较其他组都高,也再次证明了PTH联合ZA可以使骨痂产生最高的BMD值。
组织学结果显示,2周时,除了saline组,其余各组的骨痂区均以初级骨小梁为主,PTH1-34+ZA组的骨小梁表现出最高的最密性和规律性,4周时,PTH1-34+ZA组的骨髓腔再通情况优于ZA组,但是仍稍差于PTH1-34组。结合4周时的冠状位CT显示,PTH1-34+ZA组相比于PTH1-34组,两者骨折线愈合情况相仿,在骨折愈合时间上未见明显优势。这有可能是由于PTH对骨痂的重塑以及髓腔的再通起到了主要作用,并且能够促进骨折愈合时间,而唑来膦酸会稍微延迟对于骨痂的重塑,但是在骨折愈合时间上无明显影响,这与既往的研究相符。Aspenberg等[20]研究了特立帕肽对骨折愈合的影响。绝经后桡骨远端骨折妇女皮下注射特立帕肽8周,与对照组相比,特立帕肽治疗组的骨折愈合时间明显缩短。Kates等[21]总结了273篇有关双膦酸盐对于骨折愈合影响的英文文献,总结发现在动物中使用双膦酸盐可以产生大量骨痂,尽管会延迟原发性编织骨向板层骨的重塑,但是不会延迟骨痂的产生。Li等[22]使用PTH联合唑来膦酸治疗后加速了骨折大鼠的愈合,与本研究结果一致。
在给药后2周和4周,PTH1-34+ZA组的ALP和BSP基因的表达量升高最为明显,其中,ALP基因在4周的表达量较2周明显减少,而BSP基因在4周的表达量较2周时明显增加,这可能揭示了在骨折愈合早期,ALP基因的表达在骨折愈合中占了主要作用,而到了后期,BSP基因开始大量表达以促进骨折愈合。ALP基因的表达增强可以促进成骨细胞分泌大量的碱性磷酸酶,并参与骨的矿化。Schalin-Jantti等[23]对2例患者行PTH注射治疗,并随访18个月,发现2例患者血清的碱性磷酸酶均在给药2个月后达到最高,此后逐渐下降,并表现出对骨折的促进作用;研究发现在MC3T3-E1细胞上使用PTH后,ALP基因表达量在用药后6 h达到峰值,此后逐渐下降[24];另有文献在探索阿仑膦酸钠对于大鼠骨质疏松性骨折愈合的影响时发现血清ALP浓度在用药后2周达到最高,后逐渐下降[25]。本研究联合治疗时出现的ALP基因早期高表达,晚期逐渐下降的结果可能跟PTH和双膦酸盐可以分别通过不同的信号通路促进ALP的表达有关,但是仍不能明确两者信号通路之间是否有相互作用。而BSP基因的表达局限在矿化组织中,成骨细胞、破骨细胞以及其他一些骨相关细胞可以合成和分泌骨唾液酸蛋白,BSP基因的表达在骨骼矿化和癌细胞骨转移中发挥重要作用。Li等[26]使用PTH间断刺激牙骨质细胞,发现BSP基因表达随着时间的推移,表达量不断升高。Hu等[27]发现唑来膦酸可以有效促进BSP、ALP和OSX基因表达。本研究模拟小鼠骨质疏松性骨折,采用PTH联合ZA对小鼠进行治疗,发现在骨质疏松性骨折愈合过程中,联合治疗在促进ALP和BSP基因的表达上有叠加作用,但是具体的信号通路之间的相互作用仍有待探索。
综上所述,PTH1-34联合ZA可以通过增加骨量,并对骨痂区域进行改建促进骨折处力学稳定及强度的恢复,同时能加速骨折愈合,但是相对于单独使用PTH1-34并没有愈合时间上的优势。且在骨折愈合过程中,早期依赖ALP的表达,后期通过BSP的高表达以促进骨折的愈合。当然,本实验的观察时间只有4周,联合用药对于骨折愈合的远期疗效如何还有待更长时间的观察。此外,探讨不同剂量,不同注射频率的PTH和ZA的联合用药对于骨折的愈合疗效可能是今后一个值得探索的方向。
| [1] | Leder BZ. Parathyroid hormone and parathyroid hormone-related protein analogs in osteoporosis therapy[J]. Curr Osteoporos Rep, 2017, 15: 110–119. DOI:10.1007/s11914-017-0353-4 |
| [2] | Drake MT, Srinivasan B, Modder UI, et al. Effects of intermittent parathyroid hormone treatment on osteoprogenitor cells in postmenopausal women[J]. Bone, 2011, 49: 349–355. DOI:10.1016/j.bone.2011.05.003 |
| [3] | 林华, 徐天舒, 范璐, 等. 5 mg唑来膦酸治疗绝经后骨质疏松及其骨折[J]. 中华创伤骨科杂志, 2012, 14: 31–35. DOI:10.3760/cma.j.issn.1671-7600.2012.01.009 |
| [4] | Hegde V, Jo JE, Andreopoulou P, et al. Effect of osteoporosis medications on fracture healing[J]. Osteoporos Int, 2016, 27: 861–871. DOI:10.1007/s00198-015-3331-7 |
| [5] | Sanchez A, Blanco R. Osteonecrosis of the jaw (ONJ) and atypical femoral fracture (AFF) in an osteoporotic patient chronically treated with bisphosphonates[J]. Osteoporos Int, 2017, 28: 1145–1147. DOI:10.1007/s00198-016-3840-z |
| [6] | Li W, Chen W, Lin Y. The efficacy of parathyroid hormone analogues in combination with bisphosphonates for the treatment of osteoporosis:a Meta-analysis of randomized vontrolle trials[J]. Medicine, 2015, 94: e1156. DOI:10.1097/MD.0000000000001156 |
| [7] | 李明, 罗深秋, 刘俊, 等. 抗氧化剂对去卵巢大鼠骨生物力学和血清生化指标的影响[J]. 中华创伤骨科杂志, 2008, 10: 665–669. DOI:10.3760/cma.j.issn.1671-7600.2008.07.018 |
| [8] | Marturano JE, Cleveland BC, Byrne MA, et al. An improved murine femur fracture device for bone healing studies[J]. J Biomech, 2008, 41: 1222–1228. DOI:10.1016/j.jbiomech.2008.01.029 |
| [9] | Histing T, Menger MD, Pohlemann T, et al. An intramedullary locking nail for standardized fixation of femur osteotomies to analyze normal and defective bone healing in mice[J]. J Vis Exp, 2016, 13: 117. |
| [10] | Yang DH, Singh R, Divieti P, et al. Contributions of parathyroid hormone (PTH)/PTH-related peptide receptor signaling pathways to the anabolic effect of PTH on bone[J]. Bone, 2007, 40: 1453–1461. DOI:10.1016/j.bone.2007.02.001 |
| [11] | Savaridas T, Wallace RJ, Salter DM, et al. Do bisphosphonates inhibit direct fracture healing? A laboratory investigation using an animal model[J]. Bone Joint J, 2013, 95B: 1263–1268. |
| [12] | Bogoch ER, Elliot-Gibson V, Beaton D, et al. Fracture prevention in the orthopaedic environment:outcomes of a coordinator-based fracture liaison service[J]. J Bone Joint Surg Am, 2017, 99: 820–831. DOI:10.2106/JBJS.16.01042 |
| [13] | Sugie-Oya A, Takakura A, Takao-Kawabata R, et al. Comparison of treatment effects of teriparatide and the bisphosphonate risedronate in an aged, osteopenic, ovariectomized rat model under various clinical conditions[J]. J Bone Miner Metab, 2016, 34: 303–314. DOI:10.1007/s00774-015-0670-6 |
| [14] | McDonald MM, Dulai S, Godfrey C, et al. Bolus or weekly zoledronic acid administration does not delay endochondral fracture repair but weekly dosing enhances delays in hard callus remodeling[J]. Bone, 2008, 43: 653–662. DOI:10.1016/j.bone.2008.05.019 |
| [15] | Iwata A, Kanayama M, Oha F, et al. Effect of teriparatide (rh-PTH 1-34) versus bisphosphonate on the healing of osteoporotic vertebral compression fracture:A retrospective comparative study[J]. BMC Musculoskelet Disord, 2017, 18: 148. DOI:10.1186/s12891-017-1509-1 |
| [16] | Wang L, Guo TZ, Wei T, et al. Bisphosphonates inhibit pain, bone loss, and inflammation in a rat tibia fracture model of complex regional pain syndrome[J]. Anesth Analg, 2016, 123: 1033–1045. DOI:10.1213/ANE.0000000000001518 |
| [17] | Casanova M, Herelle J, Thomas M, et al. Effect of combined treatment with zoledronic acid and parathy-roid hormone on mouse bone callus structure and composition[J]. Bone, 2016, 92: 70–78. DOI:10.1016/j.bone.2016.08.012 |
| [18] | Chunxiao W, Yu Z, Wentao L, et al. Impacts of the N-terminal fragment analog of human parathyroid hormone on structure, composition and biomechanics of bone[J]. Eur J Pharm Sci, 2012, 47: 926–933. DOI:10.1016/j.ejps.2012.09.013 |
| [19] | Hao Y, Wang X, Wang L, et al. Zoledronic acid suppresses callus remodeling but enhances callus strength in an osteoporotic rat model of fracture healing[J]. Bone, 2015, 81: 702–711. DOI:10.1016/j.bone.2015.09.018 |
| [20] | Aspenberg P, Genant HK, Johansson T, et al. Teri-paratide for acceleration of fracture repair in humans:a prospective, randomized, double-blind study of 102 postmenopausal women with distal radial fractures[J]. J Bone Miner Res, 2010, 25: 404–414. DOI:10.1359/jbmr.090731 |
| [21] | Kates SL, Ackert-Bicknell CL. How do bisphosphonates affect fracture healing?[J]. Injury, 2016, 47: S65–S68. DOI:10.1016/S0020-1383(16)30015-8 |
| [22] | Li YF, Zhou CC, Li JH, et al. The effects of combined human parathyroid hormone (1-34) and zoledronic acid treatment on fracture healing in osteoporotic rats[J]. Osteoporos Int, 2012, 23: 1463–1474. DOI:10.1007/s00198-011-1751-6 |
| [23] | Schalin-Jantti C, Mornet E, Lamminen A, et al. Parathyroid hormone treatment improves pain and fracture healing in adult hypophosphatasia[J]. J Clin Endocrinol Metab, 2010, 95: 5174–5179. DOI:10.1210/jc.2010-1168 |
| [24] | 徐莹, 田野, 孟凌新. 骨形态发生蛋白2介导甲状旁腺素促进成骨细胞分化的实验研究[J]. 中国组织化学和细胞化学杂志, 2012, 21: 79–83. |
| [25] | Sandberg O, Bernhardsson M, Aspenberg P. Earlier effect of alendronate in mouse metaphyseal versus diaphyseal bone healing[J]. J Orthop Res, 2017, 35: 793–799. DOI:10.1002/jor.v35.4 |
| [26] | Li Y, Hu Z, Zhou C, et al. Intermittent parathyroid hormone (PTH) promotes cementogenesis and alleviates the catabolic effects of mechanical strain in cementoblasts[J]. BMC Cell Biol, 2017, 18: 19. DOI:10.1186/s12860-017-0133-0 |
| [27] | Hu L, Wen Y, Xu J, et al. Pretreatment with bisphosphonate enhances osteogenesis of bone marrow mesenchymal stem cells[J]. Stem Cells Dev, 2017, 26: 123–132. DOI:10.1089/scd.2016.0173 |
| (收稿日期:2017-09-12) |

