2. 710054 西安,西安交通大学医学院附属红会医院脊柱外科
2. Department of Spine, Honghui Hospital Affiliated of Xi'an Jiaotong University College of Medicine, Xi'an 710054, China
低钠血症是临床最常见的电解质紊乱状态,其诊断标准因检测方法的差异,临界值由135~137 mmol/L不同[1-2],但目前多数研究以血钠浓度低于135 mmol/L定为低钠血症的诊断标准[3]。人群中低钠血症的发生率在1%~4%不等,在住院患者中,其发生率高达30%~40%[4]。对低钠血症的研究,以往主要集中于急性、重度低钠血症,因其会导致软弱乏力、恶心、呕吐、头痛思睡、肌肉痉挛、共济失调甚至昏迷、死亡等明显症状被广泛关注,积极诊治[5]。而慢性、轻中度低钠血症或血钠偏低状态往往因其病因复杂,无明显临床症状或症状隐匿被临床忽视[6],直到近年来低钠血症与骨折的相关性研究相继报道[7-9]。现在越来越多的研究支持低钠血症与骨折的发生存在相关性,其可能的机制主要集中于两个方面,一方面研究认为低钠血症影响中枢及周围神经功能,进而引起注意力不集中、步态不稳使患者容易跌倒,致使骨折发生[10]。另一方面研究认为低钠状态会直接影响骨代谢,致使骨量减低、骨质疏松发生,使患者易发生骨折[11]。对其相关性研究,目前不仅从临床、流行病学方面获得了证据支持,而且也从动物实验、病理生理实验等方面获得了理论支持。
本文以“低钠血症”、“骨质疏松骨折”、“骨质疏松”、“钠库”、“hyponatremia”、“major osteoporotic fractures”、“osteoporosis”、“sodium reservor”等作为关键词,在中国知网、万方、PubMed、Springer、Cochrane Library、Web of Science等数据库进行检索,同类型的研究选择证据等级高的文献,最终纳入50篇相关文献。旨在对低钠血症与骨折、骨质疏松相关性的研究进展作一综述。
低钠血症与骨折的相关性研究低钠血症与骨折的相关性研究于2008年真正提出,Gankam Kengne等[12]在对513例摔伤所致髋部骨折的老年患者的致伤危险因素研究中发现,除服用药物、神经系统功能衰退、饮酒等危险因素外,骨折组中13.1%患者患低钠血症(131±3 mmol/L),而非骨折组低钠血症发生率仅为3.9%,校正后的相对危险度(OR)值为4.16。因此提出低钠血症是摔伤所致骨折的一个独立危险因素。在此之前,Renneboog等[13]在对慢性低钠血症危害的研究中已指出,慢性低钠血症会影响患者注意力的集中或(和)步态的平稳,使患者容易跌倒,但该研究未涉及骨折风险。随后越来越多的研究开始关注这一方向[14]。
Sandhu等[15]在对骨折危险因素的研究中指出,低钠血症与老年患者的长骨骨折存在相关性。该项研究以就诊于其所在医院急诊科的364例长骨骨折的老年患者(年龄≥65岁)作为研究对象,以同期因非骨折原因就诊于该科室的其他患者作为对照组。研究发现,在骨折组有9.1%(33例)的患者患低钠血症(131±2 mmol/L),而在年龄、性别均匹配的对照组,低钠血症的发生率为4.1%(15例),两组间低钠血症的患病率差异存在统计学意义(P=0.007)。但是该研究也存在明显缺陷,骨折病例中有24%(8例)的患者在研究期间同时服用了选择性5-HT再摄取抑制剂(selective serotonin reuptake inhibitors,SSRIs),而SSRIs本身就能影响血钠代谢[16],增加骨折风险[17],因此该研究结果可能存在偏倚。
Kinsella等[18]对低钠血症与骨折相关性的研究中表示,低钠血症是独立于骨质疏松的一种骨折危险因素。在1 408例(女性,61.4岁)研究对象中,45%的受试者患骨质疏松,18%的受试者有骨折病史。有骨折病史组中,低钠血症的发生率为8.7%,而无骨折病史组中,低钠血症发生率仅为3.1%,将两组间低钠血症的患病率进行比较,差异有统计学意义(P < 0.01)。通过Logistic回归分析得出低钠血症是独立于骨质疏松的一种骨折危险因素。
对于二者相关性的研究,大部分研究类型为回顾性或现况研究,因此对其因果关系推断存在困难。Hoorn等[19]于2011年就低钠血症与骨折的相关性问题发表了该领域的第1篇前瞻性队列研究结果。该研究依据其纳入及排除标准共纳入5 208名年龄 > 55岁的研究对象,收集患者血钠浓度、骨密度等基础资料,经过6~7年随访得出低钠血症患者骨折的风险与血钠正常者比较,差异有统计学意义(P=0.004)。
随低钠血症与骨折相关性研究的深入,研究者发现低钠血症与骨量、骨质疏松间也存在相关性,因此越来越多的研究同时考虑低钠血症与骨折、骨质疏松三者间的相互作用及因果联系。大部分研究认为慢性低钠血症会影响骨代谢,引起骨质疏松的发生,继而易发生骨折,但同时低钠血症也是独立于骨质疏松的一项骨折的危险因素[20]。
低钠血症与骨质疏松的相关性研究低钠血症与骨质疏松的相关性最先由Kinsella等[18]的研究提及,研究发现低钠血症组患者的骨密度较血钠正常组低,但主要考虑是由于两组患者的年龄差异所致(低钠血症组平均年龄67.8岁,血钠正常组平均年龄61.1岁,P=0.000),未能明确低钠血症与骨质疏松之间是否存在直接关系。随后,Verbalis等[21]整理分析美国第3次全国健康和营养调查数据(NHANES III)时首次明确提出了低钠血症与骨质疏松之间存在相关性。通过对所有50岁及以上的受试者血钠水平与骨密度的相关性分析发现,低钠血症组中血钠浓度与股骨颈骨密度之间呈正线性相关性(P < 0.01),低钠血症患者相对于血钠正常者其股骨颈发生骨质疏松的危险性增加了2.87倍,全髋关节发生骨质疏松的危险性增加了2.85倍。
随后,Lawson等[22]对404名神经性厌食症患者进行了血钠水平与骨密度之间相关性的研究,发现血钠浓度 < 140 mmol/L组与血钠浓度≥140 mmol/L组相比较,其腰椎、全髋关节骨密度T值差异均具有统计学意义(P值分别为0.004、0.029)。Kruse等[23]对1 575份临床资料整理分析,发现低钠血症患者全髋关节及腰椎椎体发生骨质疏松的风险均高于血钠症正常者,差异具有统计学意义(P < 0.05),且在低钠血症组中,患者的骨密度与血钠水平之间存在剂量反应关系。Afshinnia等[24]对24 784例患者的临床资料进行整理分析,发现低钠血症组与血钠正常组比较全髋关节骨质疏松症的发生率明显较高,两者差异有统计学意义(P=0.000)。
近期,Kruse等[25]对二者相关性的研究显示,慢性低钠血症(血钠浓度 < 137 mmol/L)与患者骨量减少或骨质疏松的发生存在相关性,但这种关系主要表现在对髋关节骨密度的影响,对腰椎骨密度影响有限。Holm等[26]对5 610名女性患者血钠浓度与骨密度相关性的研究中得出,低钠血症在女性中是其发生骨质疏松与骨质疏松性骨折的危险因素,且低钠血症是骨质疏松骨折独立于骨质疏松的一种危险因素。Upala等[27]就低钠血症、骨折、骨质疏松相关性进行了一项系统回顾及Meta分析。该研究共收集整理该领域的29篇全文文章,其中15项共212 889例病例符合其纳入标准,最终12项进入Meta分析,分析结果示低钠血症与骨折、骨质疏松均存在显著的相关性。
但同时,也有部分研究认为低钠血症与骨质疏松之间并无直接的相关性或因果关系。Hoorn等[19]经过一项前瞻性研究表示,低钠血症与骨质疏松之间并无相关性,通过年龄、性别等因素校正后,低钠血症患者骨密度(0.875±0.15 g/cm2)甚至高于血钠正常者(0.861±0.14 g/cm2),但二者之间比较,差异无统计学意义(P=0.100)。因此,鉴于目前该领域的研究多为回顾性或现状研究,进一步的前瞻性研究及基础理论机制研究才能为三者相关性提供更有效的证据。
低钠血症与骨折、骨质疏松相关性可能机制 低钠血症与跌倒、骨折相关性的基础研究慢性、轻中度低钠血症往往无明显临床症状一直未被重视及正确认识[6],直到有研究表明慢性的低钠血症可能会影响神经认知功能[13]。现在广泛研究均认为慢性低钠血症会导致定向力障碍、嗜睡、构音障碍、步态障碍及注意力不集中等临床症状[28-30],进而使患者易发生跌倒,甚至骨折。对其更深入的理论机制,Vandergheynst等[31]在近期从低钠状态对神经传导和肌肉收缩控制方面进行了探索。该研究由两部分组成,第一部分通过测量11名低钠血症患者(平均血钠浓度127.7±2.5 mmol/L)低钠血症纠正(平均血钠浓度136.1±1.8 mmol/L)前后其握持力及股四头肌等长收缩肌力来评价血钠浓度对肌肉收缩力量的影响,测定患者从座位起立行走3 m转身回坐至原座需要的时间来评价血钠浓度对肌肉启动控制的影响,结果示低钠纠正前后患者肌肉收缩力量差异无统计学意义(P=0.906),但肌肉启动控制方面其用时由14.9S提升到了12.5S (P=0.006)。第二部分通过测量9例低钠血症患者血钠纠正前后神经传导速度和F波潜伏期来研究血钠浓度对神经传导的影响。研究结果显示低钠状态纠正后,神经传导速度较低钠状态提高,F波潜伏期较低钠状态缩短,且差异均具有统计学意义(P < 0.06)。Fujisawa等[32]也从动物试验进一步认识了低钠状态对神经功能的影响。
低钠血症与骨代谢、骨质疏松的基础研究低钠血症与骨代谢、骨质疏松的相关性广受关注,其基础理论研究也较深入,目前主要有3种理论机制。
钠库失衡:钠库理论提出较早,认为骨、软骨及结缔组织的体内钠离子储存库,根据体内内环境的变化,储存或释放钠离子维持内环境稳定[33-34]。钠库理论提出已有半个世纪,随低钠血症的关注,再次走入研究者视野[35]。研究认为,低钠血症状态下机体通过增强骨的重吸收从而释放钠离子,以保持内环境的稳态,而钠释放的同时会影响、加速骨内钙的流失,长期持续的低钠血症将影响骨质的完整性,导致骨质疏松的发生[36-37],但该理论尚缺乏明确的基础研究证据支持。
破骨细胞激活:Verbalis等[21]不仅从流行病学资料中发现了低钠血症与骨质疏松的相关性,而且对其可能的机制进行了进一步的探索。研究利用大鼠模型发现,低钠血症组较血钠正常组大鼠骨密度、骨皮质厚度、骨小梁数目均低于血钠正常组。进一步病理学检查发现低钠血症组大鼠骨质中破骨细胞数目多于血钠正常组。随后,Barsony等[38]进行了体外细胞学实验研究,控制渗透压等其他培养条件恒定,发现低钠条件下诱导分化的破骨细胞数量多、体积大、骨吸收活性强,对其更深入的机制,一方面考虑为低钠环境的直接影响,另一方面考虑通过血管加压素等间接作用有关[39]。
血管加压素的调节作用:多位研究者在低钠血症与骨折、骨质疏松相关性的研究中均发现患者血浆中血管加压素水平往往较高[12, 15, 18-20, 38]。Tamma等[40]通过小鼠模型及体外细胞学实验,分析认为,血管加压素是骨吸收与形成的重要调节因子,成骨细胞与破骨细胞胞膜均有血管加压素1型受体(Avpr1α)和血管加压素2型受体(Avpr2)分布,但总体效应是血管加压来作用于相应受体激活细胞外调节蛋白激酶(Erk),通过诱导破骨细胞的形成及激活其功能促进骨吸收。因此慢性低钠血症患者血管加压素水平升高,最终导致骨质疏松的发生。
低钠血症与骨折、骨质疏松相关性研究价值及意义随低钠血症与骨折、骨质疏松的相关性研究逐步深入,慢性低钠血症的危害被广泛关注,其不仅与骨折、骨质疏松相关,而且与多种疾病的发生、愈后甚至死亡均有明确的相关性[10, 29-30, 37](图 1)。因此,在临床实践中面对低钠血症这种临床最常见的电解质紊乱,要提高认识,及时正确治疗[41],同时因为其多为慢性,病程较长,起病隐匿,病因复杂,对于可能的危险因素要尽量控制,如长期使用利尿剂类药物可引起低钠血症,因此,使用利尿剂时要定期监测电解质浓度,及时调整药物[42-43]。
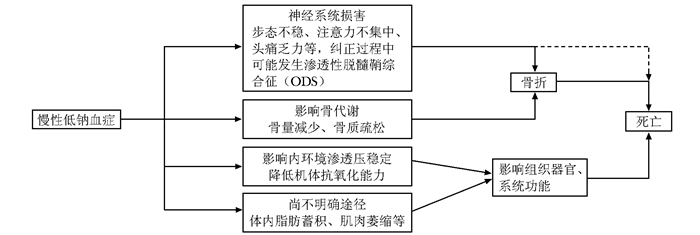
|
| 图 1 慢性低钠血症的危害 Figure 1 Impact of chronic hyponatremia |
另一方面随低钠血症与骨折、骨质疏松相关性的逐步肯定甚至因果关系的确立,血钠监测或许可以成为一种简便易行的骨折风险预测及骨质疏松筛查工具[23, 44]。同时,对于低钠饮食这一全球范围的饮食指导与卫生干预目标[45],我们也要正确认识,特别是对于老年人,尤其是血钠水平偏低或低钠血症者,过分的限制钠盐摄入或许并无益处[46]。再者,通过进一步深入的分子生物学研究,可能为骨质疏松的治疗提供新的方向,如通过血管加压素受体激动或拮抗剂调节骨质代谢[40]。
低钠血症与骨折、骨质疏松相关性研究局限及展望慢性低钠血症病因往往复杂隐匿,比较常见的病因有抗利尿激素分泌异常综合症(syndrome of inappropriate antidiuretic hormone,SIADH)及多种药物的使用,如利尿剂、抗抑郁药、抗精神病药、抗癫痫药、抗肿瘤药、非甾体抗炎药等[47-48]。已有研究表明,髓袢利尿剂与骨折、骨质疏松的发生存在明显的相关性,一方面利尿剂能引起低钠血症的发生,另一方面或许其对骨代谢有直接影响[27]。同时,慢性低钠血症常见于心血管系统、呼吸系统及代谢系统疾病患者,而现有研究已经表明贫血、慢性阻塞性肺疾病等可以影响骨代谢,导致骨质疏松、骨折的发生[49-50]。因此,对于慢性低钠血症与骨折、骨质疏松的相关性研究中要考虑低钠血症原发病因与骨折、骨质疏松的相关性。
此外,对于低钠血症的诊断,现有多数研究均以一次血钠测定为依据诊断,尤其是对于骨折患者,多数研究均是患者骨折后进行血钠浓度的测定,受创伤应激、临床干预等影响,患者本身即存在低钠血症的风险,因此伤后血钠水平不能完全反映患者骨折前血钠状态[27]。Usala等[9]以一项大样本的个体健康档案为研究资料,以连续多次的血钠水平测定评估研究个体的血钠状态,研究血钠状态与骨折、骨质疏松的相关性,研究发现长期持续的低钠血症患者其骨折、骨质疏松的相对危险度显著增加。
同时,目前研究主要集中于流行病学方面病因及危险因素的探索及基础性的实验室研究,尚缺乏前瞻性的临床干预性研究。因此就其关联强度及因果关系的确定尚需进一步的前瞻性研究及病理生理机制研究。
综上所述,低钠血症与骨折、骨质疏松的相关性已被广泛关注,且三者间的相关性逐步明确,但在预防干预、临床诊疗等实践过程中尚未引起重视,尤其国内目前尚缺乏相关方面的报道,需提高临床医师对该领域的认识。对于骨折我们不仅要关注其治疗手段的改进与突破,更要对其预防及风险预测予以重视,对于骨质疏松我们也要关注、重视其预防及早期干预。因此,随低钠血症与骨折、骨质疏松相关性研究的进展,可能为骨折的预防、骨折风险的预测及骨质疏松防治提供新的方向。
| [1] | Adrogué HJ, Madias NE. Hyponatremia[J]. N Engl J Med, 2000, 342 : 1581–1589. DOI:10.1056/NEJM200005253422107 |
| [2] | Kumar S, Berl T. Sodium[J]. Lancet, 1998, 352 : 220–228. DOI:10.1016/S0140-6736(97)12169-9 |
| [3] | Sterns RH. Disorders of plasma sodium-causes, consequences, and correction[J]. N Engl J Med, 2015, 372 : 55–65. DOI:10.1056/NEJMra1404489 |
| [4] | Upadhyay A, Jaber BL, Madias NE. Incidence and prevalence of hyponatremia[J]. Am J Med, 2006, 119 : S30–S35. DOI:10.1016/j.amjmed.2006.05.005 |
| [5] | Patterson JH. The impact of hyponatremia[J]. Pharmacotherapy, 2011, 31 : 5S–8S. DOI:10.1592/phco.31.5.5S |
| [6] | Schrier RW. Does 'asymptomatic hyponatremia' exist?[J]. Nat Rev Nephrol, 2010, 6 : 185. |
| [7] | Kwak MK, Choi D, Lee JH, et al. Relationship between decrease in serum sodium level and bone mineral density in osteoporotic fracture patients[J]. J Bone Metab, 2015, 22 : 9–15. DOI:10.11005/jbm.2015.22.1.9 |
| [8] | Gunathilake R, Oldmeadow C, McEvoy M, et al. Mild hyponatremia is associated with impaired cognition and falls in community-dwelling older persons[J]. J Am Geriatr Soc, 2013, 61 : 1838–1839. DOI:10.1111/jgs.12468 |
| [9] | Usala RL, Fernandez SJ, Mete M, et al. Hyponatremia is associated with increased osteoporosis and bone fractures in a Large U. S. health system population[J]. J Clin Endocrinol Metab, 2015, 100 : 3021–3031. DOI:10.1210/jc.2015-1261 |
| [10] | Zaino C, Maheshwari AV, Goldfarb DS. Impact of mild chronic hyponatremia on falls, fractures, osteoporosis and death[J]. Am J Orthop, 2013, 42 : 522–527. |
| [11] | Koch L. Bone:Mild hyponatremia increases fracture risk[J]. Nat Rev Endocrinol, 2011, 7 : 315. |
| [12] | Gankam Kengne F, Andres C, Sattar L, et al. Mild hyponatremia and risk of fracture in the ambulatory elderly[J]. QJM, 2008, 101 : 583–588. DOI:10.1093/qjmed/hcn061 |
| [13] | Renneboog B, Musch W, Vandemergel X, et al. Mild chronic hypothermia is associated with falls, unstandiness, and attention deficits[J]. Am J Med, 2006, 119 : e1–e8. DOI:10.1016/j.amjmed.2005.12.009 |
| [14] | Hoorn EJ, Liamis G, Zietse R, et al. Hyponatremia and bone:an emerging relationship[J]. Nat Rev Endocrinol, 2011, 8 : 33–39. DOI:10.1038/nrendo.2011.173 |
| [15] | Sandhu HS, Gilles E, DeVita MV, et al. Hyponatremia associated with large-bone fracture in elderly patients[J]. Int Urol Nephrol, 2009, 41 : 733–737. DOI:10.1007/s11255-009-9585-2 |
| [16] | Fabian TJ, Amico JA, Kroboth PD, et al. Paroxetine-induced hyponatremia in older adults:a 12-week prospective study[J]. Arch Intern Med, 2004, 164 : 327–332. DOI:10.1001/archinte.164.3.327 |
| [17] | Ziere G, Dieleman J, van der Cammen T, et al. Selective serotonin reuptake inhibiting antidepressants are associated with an increased risk of nonvertebral fractures[J]. J Clin Psychopharmacol, 2008, 28 : 411–417. DOI:10.1097/JCP.0b013e31817e0ecb |
| [18] | Kinsella S, Moran S, Sullivan MO, et al. Hyponatremia independent of osteoporosis is associated with fracture occurrence[J]. Clin J Am Soc Nephrol, 2010, 5 : 275–280. DOI:10.2215/CJN.06120809 |
| [19] | Hoorn EJ, Rivadeneira F, van Meurs JB, et al. Mild hyponatremia as a risk factor for fractures:the Rotterdam study[J]. J Bone Miner Res, 2011, 26 : 1822–1888. DOI:10.1002/jbmr.380 |
| [20] | Jamal SA, Arampatzis S, Harrison SL, et al. Hyponatremia and Fractures:Findings From the MrOS Study[J]. J Bone Miner Res, 2015, 30 : 970–975. DOI:10.1002/jbmr.2383 |
| [21] | Verbalis JG, Barsony J, Sugimura Y, et al. Hyponatremia-induced osteoporosis[J]. J Bone Miner Res, 2010, 25 : 554–563. DOI:10.1359/jbmr.090827 |
| [22] | Lawson EA, Fazeli PK, Calder G, et al. Plasma sodium level is associated with bone loss severity in women with anorexia nervosa:a cross-sectional study[J]. J Clin Psychiatry, 2012, 73 : e1379–1383. DOI:10.4088/JCP.12m07919 |
| [23] | Kruse C, Eiken P, Vestergaard P. Hyponatremia and osteoporosis:insights from the Danish National Patient Registry[J]. Osteoporos Int, 2015, 26 : 1005–1016. DOI:10.1007/s00198-014-2973-1 |
| [24] | Afshinnia F, Sundaram B, Ackermann RJ, et al. Hyponatremia and osteoporosis:reappraisal of a novel association[J]. Osteoporos Int, 2015, 26 : 2291–2298. DOI:10.1007/s00198-015-3108-z |
| [25] | Kruse C, Eiken P, Verbalis J, et al. The effect of chronic mild hyponatremia on bone mineral loss evaluatedby retrospective national Danish patient data[J]. Bone, 2016, 84 : 9–14. DOI:10.1016/j.bone.2015.12.002 |
| [26] | Holm JP, Amar AO, Hyldstrup L, et al. Hyponatremia, a risk factor for osteoporosis and fractures in women[J]. Osteoporos Int, 2016, 27 : 989–1001. DOI:10.1007/s00198-015-3370-0 |
| [27] | Upala S, Sanguankeo A. Association between hyponatremia, osteoporosis and fracture:a systematic review and Meta-analysis[J]. J Clin Endocrinol Metab, 2015, 25 : jc20154228. |
| [28] | Buffington MA, Abreo K. Hyponatremia:a review[J]. J Intensive Care Med, 2015 : 1–14. |
| [29] | Sterns RH, Silver SM. Complications and management of hyponatremia[J]. Curr Opin Nephrol Hypertens, 2016, 25 : 114–119. DOI:10.1097/MNH.0000000000000200 |
| [30] | Podestà MA, Faravelli I, Cucchiari D, et al. Neurological counterparts of hyponatremia:pathological mechanisms and clinical manifestations[J]. Curr Neurol Neurosci Rep, 2015, 15 : 536. |
| [31] | Vandergheynst F, Gombeir Y, Bellante F, et al. Impact of hyponatremia on nerve conduction and muscle strength[J]. Eur J Clin Invest, 2016, 46 : 328–333. DOI:10.1111/eci.2016.46.issue-4 |
| [32] | Fujisawa H, Sugimura Y, Takagi H, et al. Chronic hyponatremia causes neurologic and psychologic impairments[J]. J Am Soc Nephrol, 2016, 27 : 766–780. DOI:10.1681/ASN.2014121196 |
| [33] | Bergstrom WH, William WM. Bone as a sodium and potassium reservor[J]. J Clin Invest, 1954, 33 : 867–873. DOI:10.1172/JCI102959 |
| [34] | Bergstrom WH. The participation of bone in total body sodium metabolism in the rat[J]. J Clin Invest, 1955, 34 : 997–1004. DOI:10.1172/JCI103168 |
| [35] | Titze J, Dahlmann A, Lerchl K, et al. Spooky sodium balance[J]. Kidney Int, 2014, 85 : 759–767. DOI:10.1038/ki.2013.367 |
| [36] | Ayus JC, Moritz ML. Bone disease as a new complication of hyponatremia:moving beyond brain injury[J]. Clin J Am Soc Nephrol, 2010, 5 : 167–168. DOI:10.2215/CJN.09281209 |
| [37] | Fenske W, Christ-Crain M. News on hyponatremia[J]. Dtsch Med Wochenschr, 2016, 141 : 457–460. DOI:10.1055/s-00000011 |
| [38] | Barsony J, Sugimura Y, Verbalis JG. Osteoclast response to low extracellular sodium and the mechanism of hyponatremia-induced bone loss[J]. J Biol Chem, 2011, 286 : 10864–10875. DOI:10.1074/jbc.M110.155002 |
| [39] | Hannon MJ, Verbalis JG. Sodium homeostasis and bone[J]. Curr Opin Nephrol Hypertens, 2014, 23 : 370–376. DOI:10.1097/01.mnh.0000447022.51722.f4 |
| [40] | Tamma R, Sun L, Cuscito C, et al. Regulation of bone remodeling by vasopressin explains the bone loss in hyponatremia[J]. Proc Natl Acad Sci U S A, 2013, 110 : 18644–18649. DOI:10.1073/pnas.1318257110 |
| [41] | Spasovski G, Vanholder R, Allolio B, et al. Clinical practice guideline on diagnosis and treatment of hyponatraemia[J]. Eur J Endocrinol, 2014, 170 : G1–47. DOI:10.1530/EJE-13-1020 |
| [42] | Arampatzis S, Gaetcke LM, Funk GC, et al. Diuretic-induced hyponatremia and osteoporotic fractures in patients admitted to the emergency department[J]. Maturitas, 2013, 75 : 81–96. DOI:10.1016/j.maturitas.2013.02.007 |
| [43] | Ramos-Levi AM, Duran Rodriguez-Hervada A, Mendez-Bailon M, et al. Drug-induced hyponatremia:an updated review[J]. Minerva Endocrinol, 2014, 39 : 1–12. |
| [44] | Rittenhouse KJ, To T, Rogers A, et al. Hyponatremia as a fall predictor in a geriatric trauma population[J]. Injury, 2015, 46 : 119–123. DOI:10.1016/j.injury.2014.06.013 |
| [45] | Hendriksen MA, Hoogenveen RT, Hoekstra J, et al. Potential effect of salt reduction in processed foods on health[J]. Am J Clin Nutr, 2014, 99 : 446–453. DOI:10.3945/ajcn.113.062018 |
| [46] | Kalogeropoulos AP, Georgiopoulou VV, Murphy RA, et al. Dietary sodium content, mortality, and risk for cardiovascular events in older adults:The Health, Aging, and Body Composition (Health ABC) Study[J]. JAMA Intern Med, 2015, 175 : 410–419. DOI:10.1001/jamainternmed.2014.6278 |
| [47] | Palmer BF, Gates JR, Lader M. Causes and management of hyponatremia[J]. Ann Pharmacother, 2003, 37 : 1694–1702. DOI:10.1345/aph.1D105 |
| [48] | Liamis G, Milionis H, Elisaf M. A review of drug-induced hyponatremia[J]. Am J Kidney Dis, 2008, 52 : 144–153. DOI:10.1053/j.ajkd.2008.03.004 |
| [49] | Korkmaz U, Korkmaz N, Yazici S, et al. Anemia as a risk factor for low bone mineral density in postmenopausal Turkish women[J]. Eur J Intern Med, 2012, 23 : 154–158. DOI:10.1016/j.ejim.2011.11.009 |
| [50] | Rutten EP, Franssen FM, Spruit MA, et al. Anemia is associated with bone mineral density in chronic obstructive pulmonary disease[J]. COPD, 2013, 10 : 286–292. DOI:10.3109/15412555.2012.744390 |
| (收稿日期:2016-04-19) |