2. 215004 苏州,苏州大学附属第二医院妇产科;
3. 214000 无锡,无锡市第三人民医院骨科;
4. 215004 苏州,苏州大学骨质疏松症诊疗技术研究所
2. Department of Gynaecology, The Second Affiliated Hospital of Soochow University, Suzhou 215004, Jiangsu, China;
3. Department of Orthopedics, The Third People's Hospital of Wuxi, Wuxi 214000, Jiangsu, China;
4. Osteoporosis Institute of Soochow University, Suzhou 215004, Jiangsu, China
已有研究表明,女性绝经后,随着体内雌激素 (estrogen,E2) 水平的下降,同步伴随着铁的蓄积[1],而铁的蓄积通过活性氧影响成骨及破骨细胞的增生,进而导致骨质疏松症的发生、发展[2-3]。食蟹猴作为灵长类动物,其生物学特征与人类相似,且雌性食蟹猴具有规律的月经周期[4],是研究雌激素与骨质疏松的理想模式动物。关于食蟹猴E2的检测,国内外已有报道,但其血清铁蛋白 (ferritin,Fer) 的测定未见报道。本实验以苏州西山生长的成年纯种雌性食蟹猴为研究对象,测定血清中的E2与Fer的含量,观察E2与Fer间变化规律与人类的相似性,并且同时检测骨转换指标,积累基础数据,以期将食蟹猴作为深入研究E2、铁蓄积与骨质疏松间关系的动物模型。
对象与方法 对象与分组健康雌性食蟹猴32只,共分2组,其中8~10岁年轻成熟组16只,平均年龄8.5岁;18~20岁老龄组16只,平均年龄18.5岁,体质量3.5~5.5 kg,由江苏苏州西山中科实验动物有限公司提供,实验动物许可证号:SCXK (苏)2012-0009。实验动物均被单独饲养于不锈钢笼具中,给与自由摄食和饮水,并辅以清洁水果。
方法所有动物均于上午空腹采血3 mL,3 500 r/min,4 ℃,10 min离心所得上层血清,每管分装300 μL血清。雌激素及铁蛋白试剂均为罗氏 (Roche公司) 提供,采用罗氏Cobas 6000电化学发光法检测。
统计学方法实验测定结果采用统计分析软件Prism (GraphPad) 进行分析,实验所得数据用均数±标准差 (x±s) 表示,采用t检验,以P < 0.05为差异有统计学意义。
结果年轻成熟组食蟹猴血清E2为 (419.11±387.33) pmol/L,老龄组E2为 (257.41±244.64) pmol/L,两组比较,差异有统计学意义 (P < 0.05)。
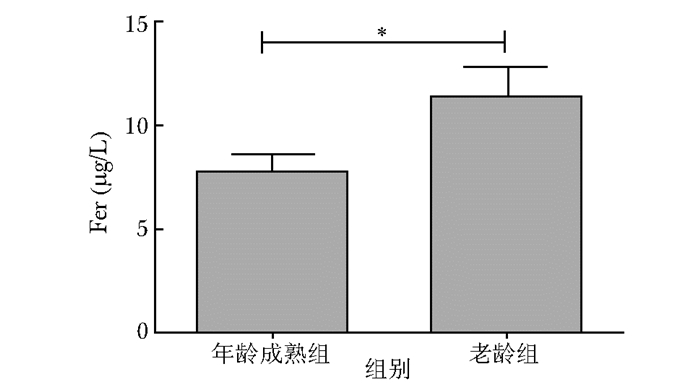
年轻成熟组食蟹猴血清Fer为 (9.57±6.53)μg/L,老龄组Fer为 (11.02±5.19)μg/L。两组比较,差异有统计学意义 (P < 0.05)(图 1)。
|
| 图 1 两组血清Fer水平比较 Figure 1 Comparison of serum Fer level between younger group and older group Fer:铁蛋白;*P < 0.05 |
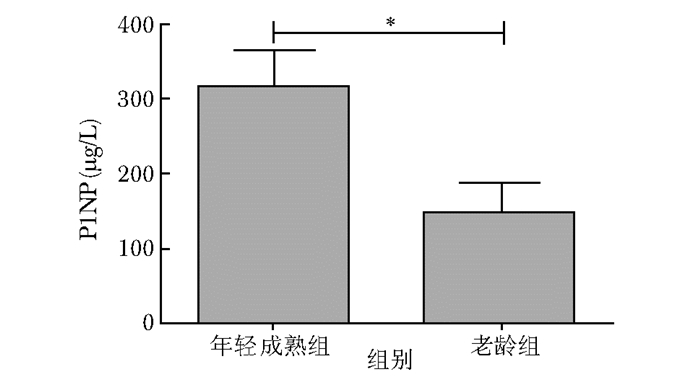
年轻成熟组食蟹猴血清1型骨胶原氨基末端肽 (procollagen 1 N terminal peptide,P1NP) 为 (316.4±46.25)μg/L,老龄组P1NP为 (147.7±38.14)μg/L。两组比较,差异有统计学意义 (P < 0.05)(图 2)。
|
| 图 2 两组血清P1NP水平比较 Figure 2 Comparison of serum P1NP level between younger group and older group P1NP:1型骨胶原氨基末端肽;*P < 0.05 |
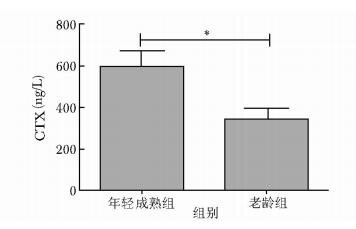
年轻成熟组食蟹猴血清1型胶原羧基末端肽 (carboxy terminal telopeptide of collagen type 1, CTX) 为 (594.00±73.32) ng/L,老龄组CTX为 (342.00±49.18) ng/L。两组比较,差异有统计学意义 (P < 0.05)(图 3)。
|
| 图 3 两组血清CTX水平比较 Figure 3 Comparison of serum CTX level between younger group and older group CTX:1型胶原羧基末端肽;*P < 0.05 |
非人类灵长类动物价格昂贵,饲养、给药、检测及管理都较为困难,所以目前骨质疏松研究领域的常见实验动物为大鼠、小鼠、兔、羊等,上述动物都有着各自的优势及不足。譬如大鼠缺乏Haversian系统,皮质骨内骨的重建罕见,同时终身维持活跃的骨构建,而且去卵巢后不发生脆性骨折,承载方式与人类也截然不同;小鼠则存在骨骼太小,可供实验研究的血清较少等缺点;食蟹猴作为人类的近属动物,与其他骨质疏松模型动物相比,具有突出优势:食蟹猴身体保持直立位,骨生物力学特性与人类极为相似,具有Haversian和松质骨重建活性,更为重要的是雌性动物与人类女性有相似的月经周期、动情周期和绝经,而且卵巢功能停止后骨矿密度降低、骨丢失速率等骨反应与绝经期妇女情况相似。所以,进行以食蟹猴为骨质疏松实验动物模型的研究,在骨质疏松研究领域有其不可替代的独特价值。
与人类女性生命周期相对照,食蟹猴各生理阶段出现的年龄大约是人类年龄的1/3。因此本实验选用的8~10岁食蟹猴相当于年轻成熟组,18~20食蟹猴相当于老年组。本实验所测得的两个年龄段雌性食蟹猴E2浓度与黎宗强等[5],吴天秀等[6]的检测结果相仿,老年组的雌激素水平明显低于年轻成熟组。雌激素对原发性骨质疏松症的发生起决定性作用,这一点已为公认。1940年Alabright[7]首先提出绝经后骨质疏松的发生与体内雌激素减少有关,并首先提倡应用雌激素进行治疗。
铁元素参与调节生物体内细胞诸多生理功能,骨骼的代谢也受铁代谢的影响。血清Fer是反映生物体内铁储存状况的敏感指标。血清Fer是由去铁蛋白 (apoferritin) 和铁核心Fe3+形成的复合物。铁核心Fe3+担负着结合、贮备铁以及维持体内铁的供应的重要作用。在正常女性人群中,已有研究发现随着年龄的增加,血清Fer呈现不断增高的趋势[1],尤其在绝经前后有明显的变化。Zacharski等[8]的大样本研究结果显示:女性50岁前血清Fer保持低水平并缓慢升高,50~70岁间迅速上升,之后又缓慢升高。Kato等[9]的研究证实:绝经前女性血清Fer平均浓度为43 μg/L,绝经后平均为106 μg/L。关于血清Fer随年龄升高的原因,目前认为主要是调控体内铁反应元件的雌激素水平变化引起的,即雌激素水平下降,铁反应元件功能下降,体内铁储存增加,血清Fer升高。本实验检测的两组不同年龄段雌性食蟹猴血清Fer水平变化亦如人类,老年组血清Fer水平明显高于年轻组。
2006年,Weinberg[10]首先提出了铁蓄积与骨质疏松密切相关。2011年徐又佳和林华[11]认为铁超载对于骨质疏松发生、发展有重要作用。Kim等[12]在分析了940名健康女性3年体检数据后,提出健康绝经女性骨密度下降与血清Fer的升高存在相关性,铁蓄积是加速骨量丢失的一个独立危险因素。近年来,围绕铁蓄积与骨质疏松,国内已有研究人员利用大鼠骨质疏松模型、斑马鱼模型等进行了深入研究[13],但尚未见利用最接近人类的灵长类动物模型进行相关研究。本研究通过观察不同年龄段成年纯种雌性食蟹猴血清E2与Fer,与正常不同年龄段人类女性的血清E2与Fer变化研究结果[11-12]相一致。
P1NP和CTX是临床常用的观测骨转换的重要指标,前者反应成骨细胞的活性,后者则反应破骨细胞的活性。老年女性绝经后处于高骨转换状态,即P1NP和CTX都有不同程度的升高,并以骨破坏增加为主。本实验结果提示老龄猴的P1NP和CTX较年青成熟猴有明显的降低,即表现出低骨转换趋势。
食蟹猴作为非人灵长类骨质疏松动物模型,可以为研究绝经后女性E2与铁代谢在骨质疏松发生、发展中的作用,提供有意义的基础实验数据。
| [1] | Jian JL, Pelle E, Huang X. Iron and menopause: does increased iron affectthe health of postmenopausal women?[J]. Antioxidant Redox Sign, 2009, 11 : 2939–2943. |
| [2] | He YF, Ma Y, Gao C, et al. Iron overload inhibits osteoblast biological activity through oxidative stress[J]. Biol Trace Elem Res, 2013, 152 : 292–296. |
| [3] | 何银锋, 赵理平, 赵国阳, 等. 高铁环境下成骨细胞增生和凋亡与氧化应激的关系[J]. 中华骨质疏松和骨矿盐疾病杂志, 2012, 5 : 125–129. |
| [4] | 邹移海, 徐志伟, 苏刚强. 实验动物医学[M]. 北京: 科学出版社, 2004 : 110-111. |
| [5] | 黎宗强, 卢晟盛, 江明生, 等. 雌性食蟹猴月经周期雌二醇和孕酮分泌水平的研究[J]. 中国医学研究与临床, 2004, 15 : 1–6. |
| [6] | 吴天秀, 廖进民, 陈艳, 等. 猕猴的雌激素及骨物理指标、微量元素检测[J]. 四川动物, 2008, 27 : 17–20. |
| [7] | Alabright F. Postmenopausal osteoporosis[J]. Trans Assoc Am Physis, 1940, 55 : 298–300. |
| [8] | Zacharski L, Ornstein DL, Woloshin S, et al. Association of age, sex, and race with body iron stores in adults:analysis of NHANES Ⅲ data[J]. Am Heart J, 2000, 140 : 98–104. DOI:10.1067/mhj.2000.106646 |
| [9] | Kato I, Dnistrian AM, Schwartz M, et al. Risk of iron overload among middle-aged women[J]. Int J Vitam Nutres, 2000, 70 : 119–125. |
| [10] | Weinberg ED. Iron loading: a risk factor for osteoporosis[J]. Biometals, 2006, 19 : 633–635. |
| [11] | 徐又佳, 林华. 重视铁代谢在骨质疏松症诊治中的意义[J]. 中华医学杂志, 2011, 31 : 2223–2225. |
| [12] | Kim CH, Kim HK, Bae SJ, et al. Association of elevated serum ferritin concentration with insulin resistance and impaired glucose metabolism in Korean men and women[J]. Metabolism, 2011, 60 : 414–420. DOI:10.1016/j.metabol.2010.03.007 |
| [13] | Chen B, Yan YL, Liu C, et al. Therapeutic effect of deferoxamine on iron overload-induced inhibition of osteogenesis in a zebrafish model[J]. Calcified Tissue Int, 2014, 94 : 353–360. |
| (收稿日期:2016-09-13) |

