2. 730000 兰州,甘肃省高校重大疾病分子医学与中医药防治研究重点实验室;
3. 甘肃省高校中(藏)药化学与质量研究省级重点实验室;
4. 730000 兰州,敦煌医学与转化省部共建教育部重点实验室;
5. 730000 兰州,甘肃中医药大学科研实验实训中心;
6. 730000 兰州,甘肃中医药大学公共卫生学院;
7. 730000 兰州,甘肃中医药大学基础医学院;
8. 730000 兰州,甘肃中医药大学临床医学院
2. Provincial-Level Key Laboratory for Molecular Medicine of Major Diseases and the Study on Prevention and Treatment of Traditional Chinese Medicine, Gansu University of Traditional Chinese Medicine, Lanzhou 730000, China;
3. Key Laboratory of Medicinal Chemistry and Quality Research, Colleges of Gansu Province, Lanzhou 730000, China;
4. Key Laboratory of Dunhuang Medicine, Ministry of Education, Lanzhou 730000, China;
5. Research and Test Center of Gansu University of Traditional Chinese Medicine, Lanzhou 730000, China;
6. School of Public Health of Gansu University of Traditional Chinese Medicine, Lanzhou 730000, China;
7. School of Basic Medical Science of Gansu University of Traditional Chinese Medicine, Lanzhou 730000, China;
8. Clinical Medical College of Gansu University of Traditional Chinese Medicine, Lanzhou 730000, China
膝骨关节炎(knee osteoarthritis,KOA)是一种常见的以关节软骨损失、骨质增生、软骨下骨硬化、滑膜炎性反应为特征的关节退变性疾病,最终临床表现为膝关节疼痛、僵硬及功能障碍,属于中医“痹证”。《内经》认为本病的发病根本是正虚,肾气不足,骨失所养,外因主要是风、寒、湿等邪气留滞于筋骨而阻碍气血,内因是肝肾亏虚致筋骨失养和痰瘀凝滞,属本虚标实之证,严重者可表现为关节酸痛、麻木及功能障碍等[1]。因此,中医以补益肝肾壮骨、活血通络为主要法则。周明旺等[2]在甘肃地区膝骨性关节炎患者中医体质调查分析研究中发现,KOA患者的高发偏颇体质是阳虚质、阴虚质、气虚质;KOA以虚性偏颇体质和虚实夹杂为主。KOA在临床中出现的症状膝关节肿胀多与患者的肝肾不足和精血亏损有关,临床治疗也以补肾壮骨、活血通络和祛风散寒为主。右归丸出自《景岳全书》,主要由熟地黄、山药、山茱萸、枸杞、鹿角胶、菟丝子、杜仲、当归、肉桂、制附子等组成,诸药合用,以温肾阳为主而阴阳兼顾,肝脾肾并补,妙在阴中求阳,使元阳得以归原。本课题组前期研究已经证实,右归丸通过抑制炎性反应因子的表达和抑制经典的Wnt/β-catenin信号通路中的关键蛋白的表达防治KOA[3-4]。本实验采用改良Hulth法复制KOA模型大鼠,研究右归丸对KOA模型大鼠IL-6、MMP-14、PI3K、pAkt和NF-κB等蛋白表达的影响,并进一步探讨这种作用与PI3K/Akt/NF-κB信号通路的关系。
材料与方法 实验动物SPF级SD大鼠60只,雌雄各半,体质量(180±20)g,购自甘肃中医药大学科研实验动物饲养中心。动物质量合格证号:SYXK(甘)2015-0005。
主要试剂水合氯醛(天津市光复精细化工研究所,批号:20150105);反转录试剂2×prime script RT master mix(大连宝生物工程有限公司,批号:AI20775A);荧光定量SYBR P Remix EX TaqⅡ(美国Promega公司,批号为:0000304040);β-actin、IL-6和MMP-14引物序列(Takara公司设计并合成)的具体信息为:β-actin:上游:5′-GGAGATTACTGCCCTGGCTCCTA-3′,下游:5′-G ACTCATCGT ACTCC TGCTTGCTG-3′,引物长度1 293 kb,扩增产物150 bp;IL-6:上游:5′-ATTGTATGAACAGCGATGATGCAC-3′,下游:5′-CC AGGTAGAAACGGAACTCCAGA-3′,引物长度1 339 kb,扩增产物111 bp;MMP-14:上游:5′-GAGAA CTTCGTGTTGCCTGATGAC-3′,下游:5′-TTTCTGGGCTTATCTGGGACAGA G-3′,引物长度2 448 kb,扩增产物134 bp;GAPDH抗体(Immuno Way,批号:B4501);兔抗-MMP-14多克隆抗体(Immuno Way,批号:B0110);兔抗-PI3K多克隆抗体(Abcam,批号:GR3192684-3);兔抗-pAkt多克隆抗体(Gene Tex,批号:821801334);兔抗-NF-κB多克隆抗体(Immuno Way,批号:B1101);兔抗-MMP-14多克隆抗体(Gene Tex,批号:821801372)。
主要仪器BioMATE 3S型蛋白、核酸浓度测定仪(美国Thermo公司);ChemiDocTMXRS+型凝胶成像分析系统(美国Bio-Rad公司);BX53型显微镜(日本OLYMPUS公司);ZY12306型微量加样器(ScienTiFic产品);C1000型PCR热循环仪(美国ABI公司);LightCycler 96型Real Time PCR System(美国罗氏公司);TGL16M型台式高速冷冻离心机(凯达集团成员高科技公司);OSE-Y10型电动组织研磨器(上海Tiangen公司)。
实验药物及给药剂量右归丸(仲景宛西制药股份有限公司,国药准字Z41022170,批号:151108);硫酸氨基葡萄糖片(保节力,新兴同仁药业有限公司,国药准字H20041317,批号:160302);青霉素(北制药股份有限公司,国药准字:H13020657,批号:F6042103)。
动物分组、造模及给药将60只SPF级SD大鼠适应性饲养1周后,采用数字法随机分为假手术组,模型组,硫酸氨基葡萄糖组,右归丸高、中、低剂量组,每组10只。参照文献[5-6],4%水合氯醛(0.3 mL/100 g)腹腔注射麻醉动物,待完全麻醉后,固定于手术台上,双侧膝关节手术区皮肤刮毛备皮、并用碘伏进行消毒,铺巾,无菌条件下将双侧膝关节内侧纵向切开,切口长约2 cm,逐层打开关节腔。将髌骨外推使脱位,让膝关节处于最大屈曲状态,暴露关节腔,剔除膝前交叉韧带、内侧副韧带及内侧半月板,注意勿损伤关节软骨面。用洁净的5 mL注射器吸取0.9%氯化钠注射液冲洗关节腔3~5次,行抽屉试验阳性后彻底止血,逐层缝合。将假手术组SD大鼠从膝关节内侧打开关节腔,不破坏韧带和半月板,保留关节软骨面。伤口在缝合前均滴入少量的青霉素溶液,随后逐层缝合。术后连续3 d肌肉注射青霉素20万U/d,各组大鼠均在相同条件下,自由饮水,摄食。造模成功6周后给予药物干预,硫酸氨基葡萄糖组给予硫酸氨基葡萄糖(0.17 g/kg)灌胃治疗,假手术组和模型组大鼠给予等体积蒸馏水灌胃,右归丸干预组按高、中、低剂量(4.8、2.4、1.2 g/kg)灌胃治疗,每日一次,连续8周。
指标测定大鼠一般情况观察:观察大鼠的饮食,饮水,活动度,灵敏度,精神状态,膝关节的畸形、肿胀、活动情况,双下肢肢端血运及肌肉丰满程度。
HE染色法观察各组大鼠关节软骨形态学变化:膝关节软骨脱钙后,按照HE染色方法进行染色。光镜下观察膝骨关节炎膝关节软骨细胞的形态学变化并进行Mankin评分[7]。评分标准为:软骨结构如常,软骨细胞数量如常,基质染色正常,潮线比较完整记为0分;软骨表面有不规则裂隙,软骨细胞数量弥漫性增多,基质染色减退,出现多重潮线记为1分;软骨裂隙深达肌层,软骨细胞成簇生长,基质染色明显减退,软骨下血管浸入肌层记为2分;软骨裂隙深达辐射层,软骨细胞数量明显减少,基质染色明显减退记为3分;软骨裂隙深达钙化层,基质染色完全消失记为4分;软骨层脱落记为5分。
免疫组织化学法测定各组大鼠MMP-14的蛋白表达:膝关节软骨脱钙后,4%多聚甲醛固定,将石蜡切片进行脱蜡、脱水后放在切片放入配制好的枸橼酸缓冲液盒中进行微波修复;3% H2O2室温孵育30 min;5%山羊血清封闭30 min;滴加50 μL的MMP-14多克隆抗体(一抗的稀释浓度为:1:100),同时用PBS缓冲液代替一抗设立阴性对照,将切片放入湿盒中,4 ℃过夜;滴加山羊抗兔的二抗,室温下放置30 min;滴加ABC工作液,37 ℃孵育60 min;DAB显色;苏木精复染;二甲苯透明,封固。染色以软骨细胞质中出现棕黄色颗粒为阳性染色,由甘肃中医药大学病理教研室老师采用双盲法进行阅片。每张切片上观察5个高倍视野(×200),计数阳性细胞百分比,总分=染色强度分值+阳性细胞计数分值,并取均值。染色强度和阳性细胞数的具体评分标准参照文献[8]进行。
实时荧光定量PCR法检测各组大鼠软骨组织白介素(interleukin-6, IL-6)和MMP-14的基因表达:用RNA抽提试剂提取软骨组织RNA,BioMATE 3S型蛋白、核酸浓度测定仪测定RNA含量。用Promega试剂盒说明书步骤合成cDNA第一链,按Promega实时荧光定量试剂盒操作说明书进行PCR反应,反应条件:预变性95 ℃、2 min,变性95 ℃、15 s,退火58 ℃、45 s,延伸60 ℃、1 min。共45个循环。每个样品各重复3次,数据经2-ΔΔCt处理后进行IL-6和MMP-14基因相对表达量分析。
Western blot法测定各组大鼠软骨组织PI3K、pAkt、MMP-14和NF-κB的蛋白表达:软骨组织蛋白质的提取用RIPA裂解液,蛋白质含量的测定用BCA法,并调整点样的蛋白质浓度为50 μg/10 μL,10 μL/每孔,作SDS-PAGE、转膜、封闭、滴加抗兔抗-PI3K多克隆抗体、兔抗-pAkt多克隆抗体、兔抗- MMP-14多克隆抗体和兔抗-NF-κB多克隆抗体等一抗孵育,滴加山羊抗兔IgG二抗孵育。采用ECL Plus超敏发光液染色观察,将溶液A和B等体积混匀后,按约0.125 mL/cm2膜面积进行染色,室温反应1 min后置于Image Lab 3.0进行曝光,曝光条件为:单个曝光时间10 s,总曝光时间60 s。
统计学方法采用SPSS 21.0分析软件,实验结果用均数±标准差(x±s)表示,统计学差异采用单因素方差分析(One-way-Anova),组间两两比较方差齐用LSD法,方差不齐用Dunnett's T3法,P<0.05为差异有统计学意义。
结果 大鼠一般情况实验期间未出现动物死亡现象。实验期间假手术组大鼠饮食、饮水、活动如常,反应比较灵敏,精神状态良好,膝关节未出现畸形、肿胀、活动良好,双下肢端血运正常及肌肉未发生萎缩;模型组大鼠饮食、饮水、活动情况、灵敏度及精神状态均明显变差,膝关节出现畸形、肿胀,双下肢端血运变差及肌肉发生萎缩;右归丸各干预组及硫酸氨基葡萄糖组大鼠饮食、饮水、活动情况较模型组较好,灵敏度及精神状态也有所好转,膝关节肿胀程度、肌肉萎缩程度均较模型组显著改善,肢端血运明显恢复。
对膝关节关节软骨形态学变化的影响HE染色结果显示:假手术组大鼠关节面及滑膜结构完整,软骨细胞呈水平排列,关节软骨边缘光滑;模型组大鼠关节软骨边缘严重破坏,软骨细胞排列紊乱;右归丸低、中剂量组关节软骨边缘不平整,软骨细胞排列紊乱;右归丸高剂量组和硫酸氨基葡萄糖组大鼠软骨结构趋于正常,软骨细胞分布偶见不均,关节软骨表面欠光滑(图 1)。Mankin评分结果显示:与假手术组比较,模型组大鼠Mankin评分升高,差异有统计学意义(P<0.01);与模型组比较,右归丸高剂量组和硫酸氨基葡萄糖组大鼠Mankin评分均降低,差异有统计学意义(P<0.05)(表 1)。
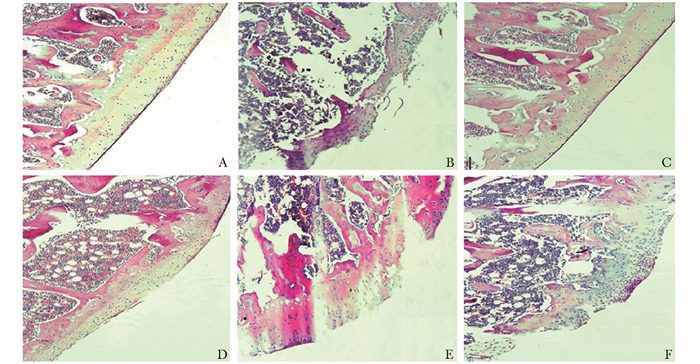
|
| 图 1 各组大鼠膝关节软骨组织病理形态变化(HE,×20) Figure 1 Morphological changes of articular cartilage tissue in each group (HE, ×20) A.假手术组;B.模型组;C.硫酸氨基葡萄糖组;D.右归丸高剂量组;E.右归丸中剂量组;F.右归丸低剂量组 |
| 组别 | Mankin评分 |
| 假手术组 | 0.33±0.073 |
| 模型组 | 4.92±0.539# |
| 硫酸氨基葡萄糖组 | 2.76±0.317** |
| 右归丸高剂量组 | 3.05±0.253* |
| 右归丸中剂量组 | 4.14±0.159 |
| 右归丸低剂量组 | 4.38±0.621 |
| KOA:膝骨关节炎;与假手术组相比,#P<0.01;与模型组相比,*P<0.05,**P<0.01 | |
实时荧光定量PCR法检测显示,与假手术组相比,模型组大鼠软骨组织IL-6和MMP-14等基因表达均明显升高(P<0.01);与模型组相比,右归丸各干预组剂量组和和硫酸氨基葡萄糖组大鼠软骨组织IL-6基因表达明显下降,右归丸中、高剂量组和和硫酸氨基葡萄糖组大鼠软骨组织MMP-14基因表达明显下降(P<0.05或P<0.01)(表 2)。
| 组别 | IL-6(2-ΔΔCt) | MMP-14(2-ΔΔCt) |
| 假手术组 | 1.00±0.04 | 1.00±0.03 |
| 模型组 | 4.66±0.02# | 5.70±0.02# |
| 硫酸氨基葡萄糖组 | 1.22±0.07** | 3.14±0.06** |
| 右归丸高剂量组 | 1.15±0.04** | 1.08±0.01** |
| 右归丸中剂量组 | 1.65±0.05** | 3.47±0.05* |
| 右归丸低剂量组 | 2.27±0.09** | 5.13±0.02 |
| KOA:膝骨关节炎;IL-6:白介素6;MMP-14:基质金属蛋白;与假手术组相比,#P<0.01;与模型组相比,*P<0.05,**P<0.01 | ||
免疫组化法测定结果显示,与假手术组相比,模型组软骨细胞的胞质MMP-14阳性染色细胞数目明显增多,蛋白表达明显增强(P<0.01)。与模型组比较,右归丸中、高剂量组和硫酸氨基葡萄糖组软骨细胞的胞质MMP-14阳性染色细胞数目明显减少,蛋白表达明显减弱(P<0.05)(表 3,图 2)。
| 组别 | MMP-14评分结果 |
| 假手术组 | 0.52±0.08 |
| 模型组 | 4.27±0.15# |
| 硫酸氨基葡萄糖组 | 0.82±0.23** |
| 右归丸高剂量组 | 0.76±0.12** |
| 右归丸中剂量组 | 3.07±0.37* |
| 右归丸低剂量组 | 4.15±0.22 |
| KOA:膝骨关节炎;MMP-14:基质金属蛋白;与假手术组相比,#P<0.01;与模型组相比,*P<0.05,**P<0.01 | |
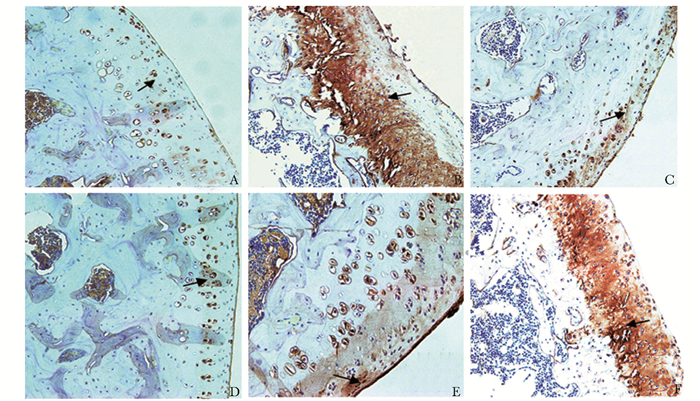
|
| 图 2 各组大鼠MMP-14蛋白阳性细胞表达结果(IHC,×20) Figure 2 Expression of MMP-14 positive cell in each group(IHC, ×20) A:假手术组;B:模型组;C:硫酸氨基葡萄糖组;D:右归丸高剂量组;E:右归丸中剂量组;F:右归丸低剂量组;MMP-14:基质金属蛋白 |
Western blot测定结果显示,与假手术组相比,模型组大鼠软骨组织PI3K、pAkt、NF-κB和MMP-14蛋白表达升高(P<0.05);与模型组相比,右归丸各干预组和硫酸氨基葡萄糖组大鼠软骨组织PI3K和NF-κB蛋白表达降低,右归丸中、高剂量组和硫酸氨基葡萄糖组大鼠软骨组织pAkt和MMP-14蛋白表达降低,差异有统计学意义(P<0.05) (表 4和图 3)。
| 组别 | PI3K | pAkt | NF-κB | MMP-14 |
| 假手术组 | 0.35±0.05 | 1.18±0.03 | 0.32±0.02 | 0.22±0.05 |
| 模型组 | 1.19±0.09# | 2.48±0.22# | 2.14±0.17# | 0.89±0.03# |
| 硫酸氨基葡萄糖组 | 0.43±0.07** | 1.65±0.08* | 0.50±0.10** | 0.35±0.02** |
| 右归丸高剂量组 | 0.45±0.05** | 1.30±0.07** | 0.62±0.13** | 0.28±0.07** |
| 右归丸中剂量组 | 0.62±0.11** | 1.51±0.13* | 0.65±0.19** | 0.59±0.03* |
| 右归丸低剂量组 | 0.67±0.11** | 2.29±0.19 | 0.73±0.16** | 0.81±0.09 |
| KOA:膝骨关节炎; PI3K:磷脂酰肌醇3-激酶; pAKT:磷酸化Akt; NF-κB:核转录因子kappa B; MMP-14:基质金属蛋白;与假手术组相比,#P<0.01;与模型组相比,*P<0.05,**P<0.01 | ||||
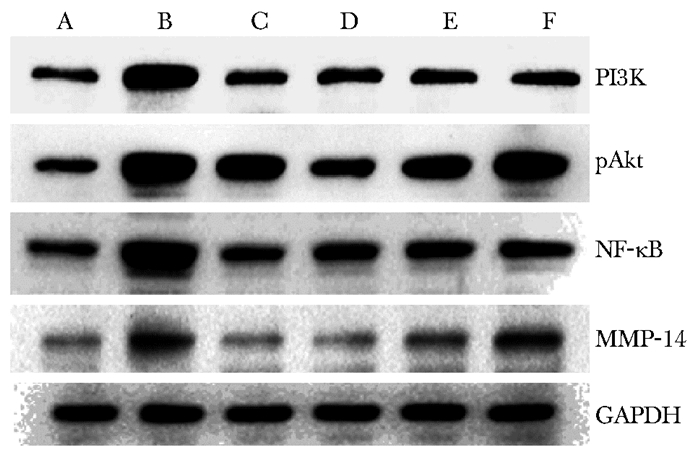
|
| 图 3 各组大鼠软骨组织PI3K、pAkt、NF-κB和MMP-14蛋白的表达 Figure 3 Expressions of PI3K, pAkt, NF-κB and MMP-14 protein of cartilaginous cell in each group A.假手术组;B.模型组;C.硫酸氨基葡萄糖组;D.右归丸高剂量组;E.右归丸中剂量组;F.右归丸低剂量组; PI3K:磷脂酰肌醇3-激酶; pAkt:磷酸化Akt; NF-κB:核转录因子kappa B; MMP-14:基质金属蛋白 |
KOA是严重影响中老年人正常工作与生活的一类骨科疾病[9]。就其发病机制而言,目前认为KOA是由软骨组织的生物力学改变、软骨代谢异常、组织相关酶失衡等方面综合作用的结果。临床上对早期和晚期发病患者均无特效药。在临床治疗上,早期以镇痛、理疗、关节腔注射玻璃酸钠以缓解患者疼痛等症状为主,晚期以人工关节置换术解除患者的疼痛和矫正关节畸形为主。但手术对机体是一种损伤,并非年轻患者的最佳选择。如何提高KOA患者的临床疗效成为医学界关注的焦点。
近年来,随着对中医药研究的深入,中药的低毒、安全优势在KOA的临床治疗中越来越受到关注。右归丸出自《景岳全书》,主要由熟地黄、山药、山茱萸、枸杞、鹿角胶、菟丝子、杜仲、当归、肉桂、制附子等组成。方中附子、肉桂、鹿角胶培补肾中元阳,温里祛寒,为君药。熟地黄、山茱萸、枸杞子、山药滋阴益肾,养肝补脾,填精补髓,取“阴中求阳”之义,为臣药。再用菟丝子、杜仲补肝肾,强腰膝,配以当归养血和血,共补肝肾精血,为佐药。诸药合用,以温肾阳为主而阴阳兼顾,肝脾肾并补,妙在阴中求阳,使元阳得以归原。依据中医的“肾主骨生髓”理论和中医的“肝肾亏虚,气血失调,经络阻塞,骨失滋养”等病因病机制论,该方能够有效地防治KOA。
有研究认为,在膝关节软骨损伤的炎性反应反应中,关节滑膜和软骨细胞应激性地分泌白细胞介素-1(interleukin-1,IL-1)、IL-6和肿瘤坏死因子(tumor necrosis factor--α,TNF-α)等炎性反应因子。IL-6在正常关节滑液以极低浓度存在,炎性反应状态下会出现大量表达,参与炎性反应,IL-6还可增强IL-1、TNF-α在KOA中的破坏作用,促进成纤维细胞合成和基质的降解,加重软骨损伤[10-11]。此外,基质金属蛋白酶(matrix metalloproteinase,MMPs)在KOA的发生、发展中也起重要的作用。研究发现,OA的发生与MMP-3、MMP-9、MMP-13等过度表达有关[12-14]。在炎性因子的作用下,MMPs通过裂解胶原分子导致关节软骨抗应能力下降,促使软骨细胞发生凋亡和软骨细胞外基质成分游离出软骨,最终使软骨发生退变。另外还发现,IL-6和MMPs在PI3K/Akt/NF-κB信号通路中可能作为下游细胞核内的调控分子调控机体的炎性反应[15]。Hu等[16]在用IL-1β诱导鼠软骨退变细胞的凋亡实验中发现,IL-1β诱导的大鼠软骨退变细胞中的pAkt含量降低。Rigoglou等[17]研究发现,NF-κB信号通路参与了KOA的发生、发展。Li等[18]在用紫草素干预IL-1β诱导的兔软骨细胞和KOA模型兔的体内外实验发现,IL-1β在兔软骨细胞中和KOA模型兔的软骨组织中均出现了MMP-1、MMP-3、MMP-13、IκBα和NF-κB等基因和蛋白表达的上调;还有研究发现,KOA模型兔中还出现了MMPs、PI3K和pAkt的高表达[19-21]。本研究组织病理学观察显示,右归丸和硫酸氨基葡萄糖组均能有效抑制关节软骨组织的增生及炎性细胞的浸润。此外,右归丸和硫酸氨基葡萄糖组均够显著降低KOA模型大鼠软骨组织IL-6、MMP-14、PI3K、pAkt和NF-κB的表达,说明右归丸和硫酸氨基葡萄糖组一方面可能是通过抑制IL-6等炎性因子来减弱KOA的炎性反应反应,另一方面可能是通过抑制MMP-14的水平进而缓解软骨基质的降解,对软骨起到一定的保护作用,还可能是通过抑制PI3K/Akt/NF-κB信号通路达到缓解KOA患者关节软骨退变的目的。
综上所述,右归丸可能通过抑制PI3K/Akt/NF-κB信号通路中PI3K和pAkt及MMP-14和IL-6的表达达到治疗KOA的目的,但具体机制尚需要进一步深入研究。
| [1] | 张嘉倩, 刘淑清. 中医治疗膝骨性关节炎研究概况[J]. 实用中医内科杂志, 2012, 26: 103–105. |
| [2] | 周明旺, 李盛华, 陈娴, 等. 甘肃地区膝骨性关节炎患者中医体质调查分析[J]. 中国中医骨伤科杂志, 2017, 25: 19–22. |
| [3] | 颜春鲁, 李盛, 安方玉, 等. 右归丸对膝骨性关节炎模型鼠基质金属蛋白酶及炎性因子表达的影响[J]. 中国骨质疏松杂志, 2018, 24: 645–650. DOI:10.3969/j.issn.1006-7108.2018.05.016 |
| [4] | 颜春鲁, 李盛, 安方玉, 等. 右归丸对鼠膝骨性关节炎的治疗作用及Wnt信号通路相关因子表达的影响[J]. 中国应用生理学杂志, 2018, 34: 177–181, 192. DOI:10.12047/j.cjap.5603.2018.043 |
| [5] | 王云峰, 白人骁, 张扬, 等. 改良Hulth模型复制膝不同时期骨关节炎的实验研究[J]. 天津医科大学学报, 2009, 15: 400–404. DOI:10.3969/j.issn.1006-8147.2009.03.019 |
| [6] | Rogart JN, Barract HJ, Chichester CO. Articular collagen degrada -tion in the Hulth-Telhag model of osteoarthritis[J]. Osteoarthr Cartil, 1999, 7: 539–547. DOI:10.1053/joca.1999.0258 |
| [7] | 李登晓, 徐璇, 朱洁, 等. 滑膜炎胶囊对兔膝骨性关节炎组织病理学及NO、SOD、COMP等的影响[J]. 上海中医杂志, 2014, 48: 86–90, 101. |
| [8] | Remmele W, Stegner HE. Recommendation for uniform definition of an immunoreactive score (IRS) for immunohistochemical estrogen receptor detection (ER-ICA) in breast cancer tissue[J]. Pathologe, 1987, 8: 138–140. |
| [9] | 艾健, 房敏, 朱清广, 等. KOA流行病学调查现状及展望[J]. 河南中医, 2013, B10: 523–523. |
| [10] | Hassan F, Trebinjac S, Murrell WD, et al. The effectiveness of prolotherapy in treating knee osteoarthritis in adults: a systematic review[J]. Br Med Bul, 2017, 4: 1–18. |
| [11] | Radojčić MR, Thudium CS, Henriksen K, et al. Biomarker of extracellμLar matrix remodelling C1M and proinflammatory cytokine IL-6 are related to synovitis and pain in endstage knee osteoarthritis patients[J]. Pain, 2017, 22: 1–16. |
| [12] | 吴剑, 鲍同柱. 基质金属蛋白酶在骨性关节炎中的研究进展[J]. 实用医学杂志, 2009, 25: 812–813. DOI:10.3969/j.issn.1006-5725.2009.05.063 |
| [13] | 龚志贤, 罗凌威, 卢敏, 等. 跌打通痹膏对兔KOA关节软骨MMP-13、Ⅱ型胶原mRNA表达的影响[J]. 湖南中医药大学学报, 2016, 36: 18–21. |
| [14] | 雒永生, 关永林, 柳永明, 等. 中药洗剂对兔KOA模型组织形态学及关节液中MMP-3的影响[J]. 西部中医药, 2016, 29: 26–29. |
| [15] | Corbett MS, Rice SJ, Madurasinghe V, et al. Response to letter to the Editor: comment on Corbett et al. entitled Acupuncture and other physical treatments for the relief of pain due to osteoarthritis of the knee: network meta-analysis[J]. Osteoarthr Cartil, 2014, 22: 712–713. DOI:10.1016/j.joca.2014.02.005 |
| [16] | Hu PF, Chen WP, Bao JP, et al. Paeoniflorin inhibits IL-1β-induced chondrocyte apoptosis by regulating the Bax/Bcl-2/caspase-3 signaling pathway[J]. Mol Med Rep, 2018, 17: 6194–6200. DOI:10.3892/mmr.2018.8631 |
| [17] | Rigoglou S, Papavassiliou AG. The NF-κB signaling pathway in osteoarthritis[J]. Int J Biochem Cell Biol, 2013, 45: 2580–2584. DOI:10.1016/j.biocel.2013.08.018 |
| [18] | Li F, Yin Z, Zhou B, et al. Shikonin inhibits inflammatory responses in rabbit chondrocytes and shows chondroprotection in osteoarthritic rabbit knee[J]. Int Immunopharmacol, 2015, 29: 656–662. DOI:10.1016/j.intimp.2015.09.014 |
| [19] | 崔志勇. 有氧运动对兔骨关节炎软骨细胞凋亡及相关基因蛋白表达的影响[J]. 动物医学进展, 2017, 38: 82–87. |
| [20] | Gelse K, Mühle C, Knaup K, et al. Chondrogenic differentiation of growth factor-stimulated precursor cells in cartilage repair tissue is associated with increased HIF-1alpha activity[J]. Osteoarthr Cartil, 2008, 16: 1457–1465. DOI:10.1016/j.joca.2008.04.006 |
| [21] | Katsara O, Attur M, Ruoff R, et al. Increased activity of the chondrocyte translational apparatus accompanies osteoarthritic changes in human and rodent knee cartilage[J]. Arthritis Rheumatol, 2017, 69: 586–597. DOI:10.1002/art.39947 |
| (收稿日期:2018-12-10) |

