淫羊藿,别名三枝九叶草、仙灵脾、千两金、干鸡筋等,始载于《神农本草经》,是我国应用最广泛、历史最悠久的中草药之一,其主要功效为补肾阳、强筋骨、祛风湿等[1]。现代植物化学研究表明,淫羊藿的主要活性成分为淫羊藿苷,是一种C8位被异戊烯基所取代的黄酮类化合物的衍生物(图 1)。大量研究表明,淫羊藿苷能够阻止绝经后大鼠的骨量流失,具有防治骨质疏松症的临床应用潜力[2]。但淫羊藿苷的作用机制至今还不明确,传统观点认为该天然产物是一种植物雌激素,以弱雌激素样活性发挥类似雌激素受体调节剂的作用,但越来越多的证据显示,淫羊藿苷还可能存在其他的作用机制。本文就这方面的研究进展做一分析和探讨。
|
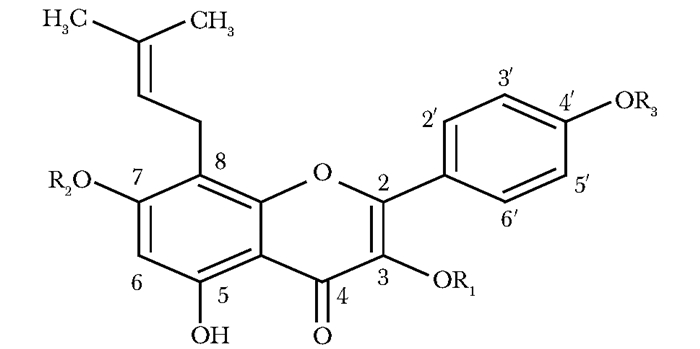
| 图 1 淫羊藿苷分子结构 Figure 1 Molecular structure of icariin (R1 glucose, R2 rhamnose, R3 CH3) R1为葡萄糖;R2为鼠李糖;R3为甲基 |
大量研究发现,淫羊藿苷能够促进骨髓间充质干细胞向成骨性分化及成骨细胞的矿化成熟,同时抑制破骨细胞的骨吸收并诱导其凋亡[3-6]。Zhao等[7]报道,淫羊藿苷可以诱导小鼠成骨细胞系MC3T3-E1表达Runx2,并促进骨形态发生蛋白(bone morphogenetic protein 4,BMP-4)的产生,从而激活BMP信号途径。Hsieh等[8]发现淫羊藿苷剂量依赖性地提高成骨细胞的增生与矿化成熟,这一活性可被BMP抑制剂(Noggin)和一氧化氮合酶(nitric oxide synthetase,NOS)拮抗剂(L-NAME)所抑制,这表明淫羊藿苷的成骨作用与BMP和NO信号途径密切相关。Zhai等[9]发现淫羊藿苷通过参与PI3K-AKT-eNOS-NO-cGMP-PKG信号途径促进骨髓间充质干细胞的成骨性分化。马小妮等[10]则报道,淫羊藿苷可以上调护骨素(osteoprotegrin,OPG)与核因子κB受体活化因子配体(receptor activator for nuclear factor-κB ligang,RANKL) OPG/RANKL的比值,在此过程中,骨髓基质细胞或骨细胞都分泌RANKL和OPG,RANKL与破骨细胞前体细胞表面的核因子κB受体活化因子(receptor activator for nuclear factor-κB,RANK)结合,促进了破骨细胞的形成,而OPG与RANKL竞争性结合,可以阻止RANKL与RANK之间的结合,从而抑制破骨细胞发生及其骨吸收活性。Hsieh等[11]还发现,淫羊藿苷抑制脂多糖(lipopolysaccharide,LPS)诱导的破骨细胞发生,这一作用机制与p38丝裂原活化蛋白激酶(p38MAPK)和c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)信号途径密切相关。有关淫羊藿苷的动物实验表明,淫羊藿苷能够提高生长期大鼠的峰值骨密度并阻止切除卵巢引起的大鼠骨量流失[12-14]。Zhang等[15]用淫羊藿黄酮(淫羊藿苷:金雀异黄酮:大豆苷元=20:5:1)开展一项为期24个月的随机双盲对照临床研究,结果显示该黄酮复合物可以阻止已绝经10~18年的老年妇女的骨量流失,同时不会引起子宫内膜厚度的增加。以上研究结果表明,淫羊藿苷能够促进骨形成、抑制骨吸收,具有潜在的、良好的临床应用价值。
淫羊藿苷具有植物雌激素活性作为一种黄酮类化合物的衍生物,人们很自然地认为淫羊藿苷应是一种植物雌激素[15-16]。事实上,人们的确发现淫羊藿苷可影响骨细胞及其前体细胞的雌激素受体α(estrogen receptor α,ERα)的表达水平,雌激素受体拮抗剂ICI182780可显著抑制淫羊藿苷的成骨活性[17-18]。高峰等[19]则认为淫羊藿苷具有雌激素样作用,属于植物雌激素;刘珊等[20]报道雌激素受体β(estrogen receptor β,ERβ)在淫羊藿苷作用机制中发挥了重要作用,通过调节BMP-2、Runx2和Cbfα1等因子的表达,促进成骨细胞的分化及成熟,抑制破骨细胞的骨吸收活性。鲍加荣等[21]比较了淫羊藿苷与17β-雌二醇提高卵巢切除大鼠的股骨、脊柱骨和全身骨密度的疗效,发现高剂量淫羊藿苷能使大鼠股骨、脊柱和全身骨密度明显升高,认为高剂量淫羊藿苷发挥了雌激素样作用。王世平等[22]用高、中、低剂量的淫羊藿苷对去势大鼠灌胃,结果3组小鼠的子宫系数明显提高,子宫内膜上皮明显增厚,提示淫羊藿苷具有明显的植物雌激素活性。以上观点均认为淫羊藿苷在促进骨形成方面发挥了植物雌激素样作用,把淫羊藿苷归为植物雌激素。
淫羊藿苷可能不是植物雌激素植物雌激素的概念起源于金雀异黄酮等大豆异黄酮类天然产物其在分子结构上与雌二醇相似,并且这些天然产物可与纯化的雌激素受体在体外发生结合反应,后续的研究进一步发现,许多黄酮类化合物都有此特征,故植物雌激素的适用范围和实际使用范围逐渐扩大[23-24]。根据植物雌激素理论,黄酮类化合物所具有的成骨活性应与其雌激素活性呈正相关,即雌激素活性越高,则成骨活性越高。但本实验室在对金雀异黄酮和淫羊藿苷进行比较研究时发现,虽然金雀异黄酮的雌激素活性明显高于淫羊藿苷,但淫羊藿苷促进成骨细胞分化成熟的活性却显著高于金雀异黄酮[25-26]。虽然17β-雌二醇和淫羊藿苷都能刺激大鼠成骨细胞系UMR-106的增生,提高其碱性磷酸酶(alkaline phosphatase,ALP)活性和OPG/RANKL比值,但17β-雌二醇能提高基于雌激素反应元件(estrogen response element,ERE)的荧光素酶报告基因活性,而淫羊藿苷却无此活性,表明前者是通过经典雌激素途径发挥成骨活性,而后者却可能通过其他途径发挥成骨活性[27]。在以上报道的启发下,本课题组进一步调研了相关文献报道,结果发现下列多方面不匹配淫羊藿苷作为植物雌激素的证据。
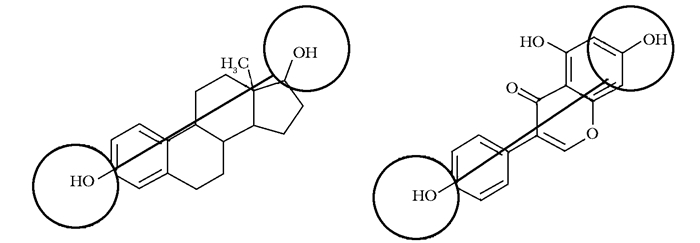
分子结构由图 2可以看出,金雀异黄酮与17-β雌二醇的分子结构具有极高的相似度,其中金雀异黄酮C7羟基和C4'羟基之间的距离与17-β雌二醇的C3羟基与C17羟基之间的距离相等,这是决定金雀异黄酮对雌激素受体具有较高亲和力的关键因素[24]。但将淫羊藿苷与17-β雌二醇相比,两者的差异则显而易见。首先,淫羊藿苷作为黄酮衍生物,其B环通过C2而不是C3与A环相连,导致C7羟基和C4'羟基的空间距离与金雀异黄酮上两者的距离不同;其次,淫羊藿苷的C7羟基和C4'羟基分别被葡萄糖(glc)和甲氧基所取代;第三,淫羊藿苷C8具有异戊烯基团,该基团会阻碍黄酮母核与雌激素受体的结合(图 3)[26]。叶海勇等[27]研究淫羊藿苷及其代谢产物的雌激素活性,发现淫羊藿苷本身并不具有雌激素活性,但当C3鼠李糖基、C7葡萄糖基和C4'甲氧基先后被还原为羟基后,其雌激素活性逐步增加,说明淫羊藿苷分子上的糖基、异戊烯基和甲氧基等都不利于雌激素活性。
|
| 图 3 淫羊藿苷(左)与金雀异黄酮(右)的分子结构 Figure 3 Molecular structures of icariin (left) and Genistein (right) |
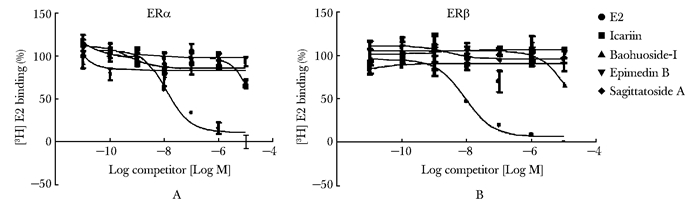
能与提纯ERα或ERβ在体外发生结合反应是植物雌激素的重要特征之一,亲和力的大小通常采用目标化合物与氘标记的雌二醇竞争性地与ERα或ERβ结合的能力来表示[24]。绝大多数异黄酮(如金雀异黄酮、大豆苷元、芒柄花素等)和黄酮(如槲皮素、苜蓿素、柚皮素等)的雌激素受体亲和力已经得到检测和报道[23],但针对黄酮类化合物淫羊藿的分析直到2014年才由Xiao等[28]完成。他们为探讨淫羊藿黄酮的骨保护活性是否与其雌激素活性相关而检测了包括淫羊藿苷、宝藿苷-1、朝藿定B和箭叶淫羊藿苷A在内的4种淫羊藿黄酮的雌激素受体亲和力,结果发现4者皆不能与纯化的ERα或ERβ在体外发生亲合反应(图 4),并且除箭叶淫羊藿苷A外,都不能激活基于ERE的荧光素酶报告基因活性。由此推测,黄酮类化合物淫羊藿的骨保护活性很可能通过非经典雌激素途径实现。
刺激人乳腺癌细胞系MCF-7或T47D增生活性是在细胞水平评价雌激素活性的主要手段之一。Ye等[29]将淫羊藿苷的C3葡萄糖基和C7鼠李糖基水解去除后,得到了淫羊藿素,进而将C4'甲氧基还原为羟基后得到了去甲基淫羊藿素,通过比较刺激MCF-7增生活性,得到了如下结果:去甲基淫羊藿素>淫羊藿素>淫羊藿苷,即去甲基淫羊藿素具有最强的雌激素样活性,淫羊藿素较弱,而淫羊藿苷没有雌激素活性。这一实验结果与淫羊藿苷不与雌激素受体发生亲核反应及不能激活基于ERE的荧光素酶报告基因是一致的,进一步说明黄酮类化合物的雌激素活性与C3、C7和C4'的取代基密切相关。
成骨活性是否受ICI182780抑制生理活性是否受到雌激素受体拮抗剂ICI182780抑制是判断植物雌激素的常用方法。由于雌激素发挥生理活性是由雌激素受体介导的,所以如果某植物天然产物或其衍生物的生理活性能够为ICI182780所抑制,则可判定其作用机制必定与雌激素途径相关。Song等[18]报道,淫羊藿苷促进小鼠细胞系MC3T3-E1的成骨性分化、提高Col1、ALP和OPN mRNA表达的作用可被ICI182780所抑制;Xiao等[28]发现淫羊藿苷刺激大鼠成骨细胞系UMR-106的细胞增生、提高其ALP活性和OPG/RANKL的作用均被ICI182780所抑制;Zhang等[30]报道淫羊藿苷和宝藿苷-1诱导破骨细胞凋亡、抑制破骨细胞增生和骨吸收活性的作用可被ICI182780阻断;本研究组实验也观察到淫羊藿次苷Ⅱ促进骨髓间充质干细胞成骨性分化的现象在加入10-6mol/L ICI182780后即消失殆尽[31]。这些实验结果表明,淫羊藿苷的骨保护作用与雌激素受体密切相关,是唯一有利于淫羊藿苷作为植物雌激素的证据。
淫羊藿苷发挥骨保护作用的可能机制本文从结构-功能关系、雌激素受体亲和力、刺激性腺组织细胞增生活性及能否为ICI182780所抑制4个方面分析了淫羊藿苷作为植物雌激素的可能性,分析结果表明,除能被ICI182780抑制外,其余各方面都不支持淫羊藿苷是植物雌激素。需要说明的是,淫羊藿苷经口服后发挥生理活性的是其代谢产物,而非原药[32],但细胞水平研究由于采用的是体外培养细胞,胞内外都没有与体内相对应的代谢系统及肠道微生物环境,因此发挥作用的是淫羊藿苷原药。正是细胞水平的研究结果提示,没有雌激素活性的原药也具有促进骨形成和抑制骨吸收的活性,说明原药的骨保护活性与雌激素途径无关。至于其代谢产物,由于C3、C7和C4'的取代基已被还原为羟基,具备了雌激素活性,因而其骨保护活性应为雌激素活性与原药活性的叠加,这就是发现淫羊藿苷代谢产物的成骨活性高于原药的原因[33]。
如何解释淫羊藿苷的成骨和抑骨活性都被ICI182780抑制的现象?结合结构-功能分析和雌激素受体亲和力的分析结果,笔者提出两点假说:第一,淫羊藿苷发挥成骨或抑骨作用的受体不是雌激素受体,而可能是其他已知或未知的受体蛋白。虽然代谢产物具备了雌激素活性,但由于其自身结构特点,雌激素活性不可能很高,如前所述,虽然淫羊藿苷的雌激素活性低于金雀异黄酮,但其成骨活性却高于后者,说明淫羊藿苷及其代谢产物发挥骨保护活性的主要途径应该不是雌激素途径;第二,雌激素受体虽然不是淫羊藿苷的直接受体,却可能参与胞内信号转导过程并发挥了不可或缺的作用。近年来已经发现,雌激素受体可以在不与雌激素配体结合的情况下被活化,即所谓不依赖于配体的激活现象。例如表皮生长因子(epidermal growth factor,EGF)在与其酪氨酸酶活性受体(receptor tyrosine kinase,RTK)结合后激活丝裂元活化蛋白激酶MAPK,MAPK磷酸化ERα的Ser118,从而活化了雌激素受体[34];人参活性成分ginsenoside Rg1活化人乳腺癌细胞中的雌激素受体也是通过RTK/MEK/MAPK途径实现的[35]。这些较早期的研究报道提示,淫羊藿苷可能在与其非雌激素受体结合后,首先激活MAPK等信号途径,然后由MAPK或其他蛋白激酶磷酸化雌激素受体,活化的雌激素受体再以经典或非经典途径激活下游的成骨相关信号级联反应。
总结与展望淫羊藿是我国最具代表性的中草药之一,迄今已报道的有关淫羊藿黄酮抗骨质疏松活性的研究大部分由我国研究者完成。作为一种黄酮类化合物的衍生物,许多研究者称淫羊藿苷为植物雌激素,但对其进行结构-功能分析,结果表明,该化合物的分子结构与雌激素相差较大,关键部位的羟基被糖基和甲氧基所取代,加上C8异戊烯基的存在,使其难以与雌激素受体结合。体外结合实验也证明,淫羊藿苷与ERα和ERβ均无亲和反应。此外,淫羊藿苷还不具有刺激乳腺癌细胞系MCF-7增生的能力,这一切都表明,淫羊藿苷不可能以雌激素样作用发挥成骨和抑骨的双重活性。但其活性受到雌激素受体的特异性拮抗剂ICI182780的抑制,表明其作用机制与雌激素受体有关,并且是必不可少的。为此笔者提出淫羊藿苷发挥成骨活性的假说:淫羊藿苷与一种未知或已知的受体蛋白(非ERα或ERβ)结合后激活了MAPK或其他信号途径,MAPK或其他蛋白激酶将ERα或ERβ磷酸化,活化的雌激素受体进而激活下游促进骨形成的信号级联反应。
上述假说是为了解释淫羊藿苷原药的作用机制,其经口服后的代谢产物由于具备了雌激素活性,有可能作为植物雌激素发挥生理作用,但不排除它们以本假说方式激活雌激素受体的可能性,甚至哪一条途径发挥了更重要的作用还有待深入研究。当下亟待开展的研究工作是设法找到胞内外与淫羊藿苷结合的受体并阐明其活化雌激素受体的信号转导机制,明确了淫羊藿苷的骨保护作用机制,就可以大大促进以淫羊藿黄酮为先导化合物的抗骨质疏松新药研究。
| [1] | Li C, Qiang L, Mei Q, et al. Pharmacological effects and pharmacokinetic properties of icariin, the major bioactive component in Herba Epimedii[J]. Life Sci, 2015, 126 : 57–68. DOI:10.1016/j.lfs.2015.01.006 |
| [2] | Zhai YK, Guo X, Pan YL, et al. A systematic review of the efficacy and pharmacological profile of Herba Epimedii in osteoporosis therapy[J]. Pharmazie, 2013, 68 : 713–722. |
| [3] | 翟远坤, 葛宝丰, 马慧萍, 等. 淫羊藿苷促进体外培养大鼠骨髓间充质干细胞的成骨性分化[J]. 中国中药杂志, 2010, 35 : 3219–3222. |
| [4] | Chen KM, Ge BF, Ma HP, et al. Icariin, a flavonoid from the herb Epimedium enhances the osteogenic differentiation of rat primary bone marrow stromal cells[J]. Pharmazie, 2005, 60 : 939–942. |
| [5] | 吕明波, 刘兴炎, 葛宝丰, 等. 淫羊藿苷对小鼠骨髓源性破骨细胞诱导生成及骨吸收功能的影响[J]. 中国骨质疏松杂志, 2007, 13 : 315–319. |
| [6] | Chen KM, Ge BF, Liu XY, et al. Icariin inhibits the osteoclast formation induced by RANKL and macrophage-colony stimulating factor in mouse bone marrow culture[J]. Pharmazie, 2007, 62 : 388–391. |
| [7] | Zhao J, Ohba S, Shinkai M, et al. Icariin induces osteogenic differentiation in vitro in a BMP-and Runx2-dependent manner[J]. Biochem Biophys Res Commun, 2008, 369 : 444–448. DOI:10.1016/j.bbrc.2008.02.054 |
| [8] | Hsieh TP, Sheu SY, Sun JS, et al. Icariinisolatedfrom Epimedium pubescens regulates osteoblasts anabolism through BMP-2, SMAD4, and Cbfa1 expression[J]. Phytomedicine, 2010, 17 : 414–423. DOI:10.1016/j.phymed.2009.08.007 |
| [9] | Zhai YK, Guo XY, Ge BF, et al. Icariin stimulates the osteogenic differentiation of rat bone marrow stromal cells via activating the PI3K-AKT-eNOS-NO-cGMP-PKG signal pathway[J]. Bone, 2014, 66 : 189–198. DOI:10.1016/j.bone.2014.06.016 |
| [10] | 马小妮, 葛宝丰, 陈克明, 等. 淫羊藿苷通过OPG/RANKL信号途径调节骨吸收的机理研究[J]. 中国骨质疏松杂志, 2013, 19 : 1–5. |
| [11] | Hsieh TP, Sheu SY, Sun JS, et al. Icariin inhibits osteoclast differentiation and bone resorption by suppression of MAPKs/NF-kappaB regulated HIF-1alpha and PGE (2) synthesis[J]. Phytomedicine, 2011, 18 : 176–185. DOI:10.1016/j.phymed.2010.04.003 |
| [12] | 成魁, 葛宝丰, 甄平, 等. 口服淫羊藿苷可提高大鼠的峰值骨密度和骨质量[J]. 中国骨质疏松杂志, 2014, 20 : 120–124. |
| [13] | Nian H, Ma MH, Nian SS, et al. Antiosteoporotic activity of icariin in ovariectomized rats[J]. Phytomedicine, 2009, 16 : 320–326. DOI:10.1016/j.phymed.2008.12.006 |
| [14] | Chen WF, Mok SK, Wang XL, et al. Total flavonoid fraction of the Herba epimedii extract suppresses urinary calcium excretion and improves bone properties in ovariectomised mice[J]. Br J Nutr, 2011, 105 : 180–189. DOI:10.1017/S0007114510003247 |
| [15] | Zhang G, Qin L, Shi YY. Epimedium-derived phytoestrogen flavonoids exert beneficial effect on preventing bone loss in late postmenopausal women:a 24-month randomized, double-blind and placebo-controlled trial[J]. J Bone Miner Res, 2007, 22 : 1072–1079. DOI:10.1359/jbmr.070405 |
| [16] | 秦岭, 石印玉. 建立防治骨质疏松症的中草药研发国际标准的倡议[J]. 中国骨质疏松杂志, 2004, 10 : 356–361. |
| [17] | Mok SK, Chen WF, Lai WP, et al. Icariin protects against bone loss induced by oestrogen deficiency and activates oestrogen receptor-dependent osteoblastic functions in UMR 106 cells[J]. Br J Pharmacol, 2010, 159 : 939–949. DOI:10.1111/j.1476-5381.2009.00593.x |
| [18] | Song L, Zhao JS, Zhang XZ, et al. Icariin induces osteoblast proliferation, differentiation and mineralization through estrogen receptor-mediated ERK and JNK signal activation[J]. Eur J Pharmacol, 2013, 714 : 15–22. DOI:10.1016/j.ejphar.2013.05.039 |
| [19] | 高峰, 莫新民, 李劲平. 淫羊藿苷治疗去势大鼠骨质疏松症基因表达谱分析[J]. 中国中医药信息杂志, 2013, 20 : 43–45. |
| [20] | 刘珊, 李劲平, 杨琳, 等. 淫羊藿苷对去势大鼠ERβ基因表达及血清E2水平的影响[J]. 湖南中医杂志, 2016, 32 : 150–152. |
| [21] | 鲍加荣, 杨继文, 李树峰, 等. 淫羊藿苷对去卵巢大鼠骨质疏松症的影响[J]. 卫生研究, 2005, 34 : 191–193. |
| [22] | 王世平, 文娱, 张毅, 等. 淫羊藿苷的拟雌激素作用研究[J]. 贵州医药, 2010, 34 : 1042–1043. |
| [23] | Jordan VC, Mittal S, Gosden B, et al. Structure-activity relationships of estrogens[J]. Environ Health Perspect, 1985, 61 : 97–110. DOI:10.1289/ehp.856197 |
| [24] | Wuttke W, Jarry H, Seidlová-Wuttke D. Isoflavones-safe food additives or dangerous drugs?[J]. Ageing Res Rev, 2007, 6 : 150–188. DOI:10.1016/j.arr.2007.05.001 |
| [25] | 石文贵, 马小妮, 谢艳芳, 等. 淫羊藿苷促成骨细胞分化成熟主要不依赖其雌激素活性[J]. 中国中药杂志, 2014, 39 : 2704–2709. |
| [26] | Ming LG, Chen KM, Xian CJ. Functions and action mechanisms of flavonoids genistein and icariin in regulating bone remodeling[J]. J Cell Physiol, 2013, 228 : 513–21. DOI:10.1002/jcp.v228.3 |
| [27] | 叶海涌, 刘健, 楼宜嘉. 淫羊藿苷衍生物的制备及其雌激素样作用研究[J]. 浙江大学学报:医学版, 2005, 34 : 131–136. |
| [28] | Xiao HH, Fung CY, Mok SK, et al. Flavonoids from Herba epimedii selectively activate estrogen receptor alpha (ERα) and stimulate ER-dependent osteoblastic functions in UMR-106 cells[J]. J Steroid Biochem Mol Biol, 2014, 143 : 141–151. DOI:10.1016/j.jsbmb.2014.02.019 |
| [29] | Ye HY, Lou YJ. Estrogenic effects of two derivatives of icariin on human breast cancer MCF-7 cells[J]. Phytomedicine, 2005, 12 : 735–741. DOI:10.1016/j.phymed.2004.10.002 |
| [30] | Zhang DW, Cheng Y, Wang NL, et al. Effects of total flavonoids and flavonol glycosides from Epimedium koreanum Nakai on the proliferation and differentiation of primary osteoblasts[J]. Phytomedicine, 2008, 15 : 55–61. DOI:10.1016/j.phymed.2007.04.002 |
| [31] | 翟远坤, 陈克明, 葛宝丰, 等. 淫羊藿次苷Ⅱ通过激活雌激素信号通路促进骨髓间充质干细胞的成骨性分化[J]. 中国药理学通报, 2011, 27 : 1451–1457. |
| [32] | 邱峰, 陈英杰, 鹿野美弘, 等. 淫羊藿苷在大鼠体内的代谢[J]. 药学学报, 1999, 34 : 222–226. |
| [33] | 翟远坤, 葛宝丰, 陈克明, 等. 淫羊藿苷与其代谢产物淫羊藿次苷II对骨髓间充质干细胞成骨性分化影响的比较研究[J]. 中药材, 2010, 33 : 1896–1900. |
| [34] | Chen DS, Washbrook E, Sarwar N, et al. Phosphorylation of human estrogen receptor a at serine 118 by two distinct signal transduction pathways revealed by phosphorylation-specific antisera[J]. Oncogene, 2002, 21 : 4921–4931. DOI:10.1038/sj.onc.1205420 |
| [35] | Lau WS, Chan RYK, Guo DA, et al. Ginsenoside Rg1 exerts estrogen-like activities via ligand-independent activation of ERα pathway[J]. J Steriod Biochem Mol Biol, 2008, 108 : 64–71. DOI:10.1016/j.jsbmb.2007.06.005 |
| (收稿日期:2016-06-08) |