胱氨酸病是一种罕见的遗传性疾病,最早由Abderhalden等[1]在1903年首次报道。之后,国外不同研究先后描述该病的多器官受累表现,包括肾脏病变所致范可尼综合征和眼部病变所致角膜病等,使该病的临床表型谱逐渐清晰。胱氨酸病为常染色体隐形遗传,该病的流行病学数据多来自欧美国家,我国仅有个别病例报道。
胱氨酸病的发病机制为细胞内溶酶体胱氨酸转运障碍,可累及所有细胞和组织器官,因此患者可存在多系统受累的临床表现[2]。随着对该病遗传学研究的深入,已明确该病为CTNS基因突变所致。CTNS基因位于17p13.2,包含12个外显子,编码L-胱氨酸转运蛋白[3]。CTNS基因突变导致L-胱氨酸转运蛋白功能缺陷,胱氨酸在溶酶体内蓄积而致病[4]。目前,全世界已有100余种CTNS基因致病突变被报道。
根据不同的发病年龄和肾脏病变情况,胱氨酸病大致可分为3型,即肾病型、中间型和眼型[5]。其中肾病型最常见,表现为范可尼综合征、慢性肾功能不全至终末期肾衰竭[6-7]。国内目前鲜有儿童胱氨酸病的病案报道。本研究报道1个中国家系中2例胱氨酸病儿童的临床表现、生化特征和遗传突变。
对象与方法 对象包括来自1个家庭的4人,患儿父母为姑表近亲结婚,父母均无异常表现。2例患儿均患有胱氨酸病,病例1系14岁男童,因“双下肢乏力、畸形13年”就诊;病例2系7岁男童,于出生数月后筛查尿常规,发现“尿糖阳性”,而后就诊。对2例患儿及其父母进行临床资料收集和外周血生物样本采集。本研究获得中国医学科学院北京协和医院伦理委员会批准。
方法采用DNA提取试剂盒(Qiagen公司,德国)提取患者及其家庭成员外周血基因组DNA。CTNS基因的DNA序列由在线数据库获得(GenBank, NG_012489.1)。采用Oligo7软件设计引物,对编码CDS区11个外显子和外显子-内含子剪切区进行PCR扩增(表 1)。采用ABI3730XL DNA分析仪进行测序。
| 外显子 | 引物 | 序列(5′→3′) | 片段(bp) | 退火温度(℃) |
| 1 | 正向 | CAGTCCTTTATGAGCCATC | 285 | 52 |
| 反向 | CTGAATGATTCTAAACCCT | |||
| 2 | 正向 | TCACAGAATAGGGCTCGTCA | 312 | 57.3 |
| 反向 | CAAGAATAGCGCATCTGAA | |||
| 3 | 正向 | ACCTAGCATTTCCTAAGCCT | 274 | 53.7 |
| 反向 | CCAGCTCTTAATTCAAATGTGT | |||
| 4 | 正向 | TTCCCTAGCGTGTTGCATA | 333 | 56.9 |
| 反向 | CACAAGAAAGCGTATCCTC | |||
| 5 | 正向 | GTGACATCTCAAAATGTTGGAC | 546 | 58.7 |
| 反向 | CCTGTTTTCCTGCTTTCCCA | |||
| 6 | 正向 | TTCAATAGCCTGCCTTCGTC | 718 | 61.8 |
| 反向 | CAAAGTCCTAGCCCGTCCA | |||
| 7 | 正向 | GGTGCCCTACATCAAGGTA | 346 | 58.4 |
| 反向 | GACCTGGATGAATGAACACA | |||
| 8 | 正向 | TCTAAGCCCGCCCTATCCG | 378 | 60.7 |
| 反向 | TGTGGCTTTCCGTCCTGTT | |||
| 9 | 正向 | AGAACCGCTTTTGTTTGGAG | 364 | 60.2 |
| 反向 | CTACGAAGGCCCCTAGGTG | |||
| 10 | 正向 | CCAAGGAGAGACCCACCTAG | 623 | 60.3 |
| 反向 | TGCAGAAACGCTGGTAGTTTG | |||
| 11 | 正向 | TTCAATAGCCTGCCTTCGTC | 328 | 60.1 |
| 反向 | CAAAGTCCTAGCCCGTCCA |
病例1:母亲孕期平顺,足月顺产。2002年(1岁时)家人发现患儿出现双下肢无力,O型腿。曾就诊于当地医院,查尿常规示“尿糖、尿蛋白阳性”,未明确诊断,未予特殊治疗。后患儿双下肢畸形加重,于2005年再次就诊,查动脉血气分析示pH值为7.33,BE -10.4 mmol/L,生化示血钙2.24 mmol/L,血磷0.6 mmol/L,血钾3.97 mmol/L,碱性磷酸酶575 U/L(20~220 U/L),尿氨基酸阳性,骨骼X线片提示佝偻病改变,诊断为“范可尼综合征”,给予中性磷制剂和枸橼酸合剂口服治疗。患者于2008年复诊时发现甲状腺功能减退症(具体结果不详),加用左甲状腺素钠(优甲乐)37.5 μg,1次/d口服治疗。同时患儿因身材矮小,于外院接受重组生长激素治疗2年,身高共增长15 cm。用药后患儿双下肢畸形逐渐减轻,间断感双下肢无力。13岁时患者双下肢乏力加重,于2015年3月就诊北京协和医院内分泌科门诊。查体:身高142 cm(<第3百分位),体质量38 kg,血压正常。视力和听力无异常。无特殊面容,无龋齿或牙齿脱落,肋骨串珠征(+),心、肺和腹未见异常,双下肢膝外翻。查动脉血气分析:pH值为7.14,BE -10.4 mmol/L。生化提示血钾3.74 mmol/L,血糖5.1 mmol/L。血肌酐34.7 μmol/L,血钙2.06 mmol/L,血磷0.6 mmol/L,碱性磷酸酶791 U/L(42~390 U/L)。尿常规示pH值为7.5,尿糖、尿蛋白阳性。上述检查化验提示患儿存在代谢性酸中毒、低磷血症、反常性碱性尿、糖尿和蛋白尿。超声检查显示双肾弥漫性病变;双膝关节放射片提示双侧股骨干弯曲,双膝关节外翻,骨软化征象。患儿诊断为“范可尼综合征,胱氨酸病?”,继续口服中性磷合剂、枸橼酸合剂、碳酸氢钠片纠正酸碱平衡和电解质紊乱,并加用骨化三醇治疗,继续左甲状腺素钠补充治疗。患儿经治疗后双下肢乏力较前缓解,代谢性酸中毒和低磷血症有部分减轻。
病例2:母亲孕期平顺,足月顺产。自1岁开始逐渐出现步态缓慢,双下肢乏力,就诊于外院,生化检查提示存在低磷血症和代谢性酸中毒,开始使用枸橼酸合剂、中性磷合剂和碳酸氢钠片药物治疗,步态改善。2015年3月为进一步诊治就诊于北京协和医院内分泌科门诊。查体:身高117 cm(第10百分位水平),体质量21 kg,血压正常。无特殊面容,有鸡胸和肋骨串珠,心、肺和腹未见异常,双下肢无明显畸形。继续上述药物治疗,血气分析提示代谢性酸中毒得以改善(pH值为7.35,BE -6.0 mmol/L)。生化提示血钾4.2 mmol/L,血肌酐45 μmol/L,血钙2.29 mmol/L,血磷0.81 mmol/L,碱性磷酸酶466 U/L(42~390 U/L)。尿常规示pH值为7.5,尿糖和尿蛋白阳性。双下肢X光影像呈佝偻病样改变。肾脏B超提示双肾弥漫性病变,输尿管及膀胱未见异常。患儿诊断为“范可尼综合征,胱氨酸病?”。继续给予补磷、纠正酸中毒,并加用活性维生素D治疗后,患儿体力可,无乏力及骨痛,双下肢无明显畸形。
2例患者来自同一家系,均表现为肾小管功能障碍,包括糖尿、蛋白尿、氨基酸尿、酸中毒以及高磷酸盐尿导致低磷性佝偻病。目前,2例患者均未见眼部、神经肌肉系统病变相关症状。经基因诊断后,嘱家长限制患儿高蛋白食物摄入,给予患儿纠正酸碱平衡和电解质紊乱,并加用骨化三醇治疗佝偻病。此外,病例1同时存在甲状腺功能减退症,继续给予甲状腺素补充治疗。
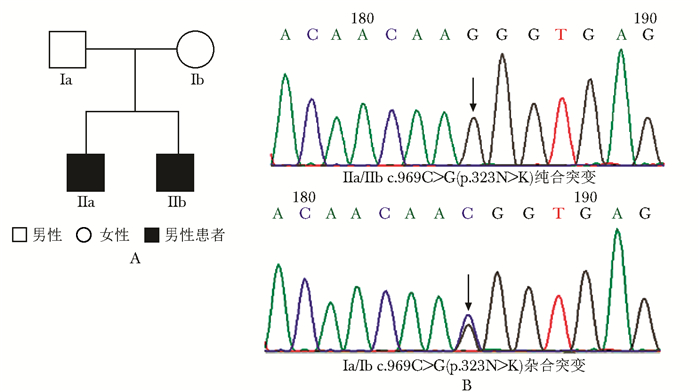
致病基因突变分析通过直接测序发现,2例临床可疑胱氨酸病患者存在CTNS纯合突变(c.969C>G,p.323N>K),患儿父母为该位点的杂合突变携带者,符合常染色体隐性遗传模式(图 1)。
|
| 图 1 家系成员图(A)与CTNS基因突变测序图(B) Figure 1 Pedigrees of the cases (A) and genetic analysis performed by direct sequencing(B) 两例患儿均为CTNS基因c.969C>G纯合突变,其父母均携带该位点杂合突变;箭头示突变位点 |
胱氨酸病是一种罕见的先天性疾病,世界不同国家人群中新生儿发病率不同,均大于1/10万,中国对该病仅有少数的病例报道[8-10]。胱氨酸病患者根据发病年龄和肾脏病变严重程度,被归为不同的临床类型。婴儿发生的肾型胱氨酸病是最常见且为最严重的表型。肾脏病变可有范可尼综合征、慢性肾功能不全,最终可进展为终末期肾衰竭[7]。少数患者可在儿童期甚至青少年发病,为晚发的肾型胱氨酸病。疾病临床表现较婴儿型轻,肾小管功能障碍较轻,且慢性肾脏病及其他肾外并发症的进展较为缓慢[11]。由于CTNS种系突变可累及全身各组织器官出现溶酶体胱氨酸代谢障碍,因此该病除常见的肾脏表现外,仍可有其他肾外表现,包括角膜胱氨酸沉积,内分泌功能紊乱和神经肌肉系统损害[5]。
本文报道1个胱氨酸病中国家系,家系中2例患儿经基因突变检测确诊为该病。患儿临床表现包括肾小管功能损害、生长速度迟缓和佝偻病,为胱氨酸病常见临床表现。值得注意的是,病例1在7岁时被发现存在甲状腺功能减退症。既往对胱氨酸病患者的报道发现该病患者可并发原发性甲状腺功能减退[12]。该并发症的出现是由于长期的胱氨酸沉积于甲状腺,使得甲状腺滤泡上皮纤维化并萎缩,进而出现甲状腺功能低下,通常发生在患者10~20岁[13]。内分泌相关其他的并发症还包括胰岛素分泌减少、男性性功能减退等[14-15]。因此,对胱氨酸病患者在随访过程中,应注意评价各器官脏器的功能,在治疗肾脏病的同时,及早发现和干预其他并发症的进展。
此外,本研究中2例患儿均存在生长迟缓,尤以病例1较为显著。病例1在针对肾脏范可尼综合征相关治疗的同时,曾因身材矮小接受重组生长激素治疗。身高在治疗2年内分别增长9和6 cm,生长速度改善较明显。病例2于1岁起病,接受纠正酸中毒和电解质紊乱口服药物治疗,早期治疗有利于病情缓解,就诊时身高、体质量位于该年龄段儿童第10百分位。既往研究对胱氨酸病患者生长曲线进行描述。新生儿发病的胱氨酸病患者出生身长、体质量均正常,而生后6~12个月生长速度明显减慢,身长降至同龄儿第3百分位以下;未给予有效的药物干预的情况下,生长迟滞持续存在[16]。目前,对胱氨酸病的系统性治疗主要包括适当的营养支持、纠正酸碱平衡紊乱、水和电解质平衡的维持、佝偻病的防治以及必要的激素替代治疗。患儿代谢平衡紊乱的纠正和骨病的治疗可改善患儿生长状态。Besouw等[17]提出如患儿未接受胱氨酸耗竭治疗,可考虑给予生长激素替代治疗以改善患儿生长状况。但是,胱氨酸病患儿一般并无生长激素缺乏,目前对胱氨酸病患者存在生长迟滞的情况下,是否给予生长激素治疗尚无充分的循证医学证据。
目前已有超过100种CTNS突变被报道,但是不同种族人群中常见突变位点迥异[5]。北美及北欧人群中,57 kb大片段缺失突变最为常见,而该突变在其他裔人群中鲜见[18-19]。2016年,Elmonem等[5]对胱氨酸病进行了较为全面的综述,对该病基因型-表型相关性进行分析,发现同时发生于两个等位基因上的截短突变或对蛋白功能影响较大的突变类型,患者往往表现为新生儿重型胱氨酸病;而携带轻微突变类型的患者则表现为青少年发病的肾型或眼型胱氨酸病。本研究家系2例患儿为CTNS基因的纯合突变(c.969 C>G)。该位点在其他患者中已被报道,临床表现为青少年发病的中间型胱氨酸病[20-21]。本研究报道的2例患儿均为1岁左右起病,较文献报道的患者起病更早,主要表现为肾小管损害,目前未出现其他器官系统损害的相关临床征象。
本研究通过基因检测,明确诊断2例胱氨酸病患者,对其临床表现、生化特点进行描述,可进一步加深临床医生对该病的认识,也丰富了中国人群胱氨酸病的致病突变谱。
| [1] | Taivassalo T, Hussain SN, Abderhalden E. Familiare cystindiathese[J]. J Physiol Chem, 1903, 38: 557–561. DOI:10.1515/bchm2.1903.38.5-6.557 |
| [2] | Nesterova G, Gahl WA. Cystinosis:the evolution of a treatable disease[J]. Pediatr Nephrol, 2013, 28: 51–59. DOI:10.1007/s00467-012-2242-5 |
| [3] | Town M, Jean G, Cherqui S, et al. A novel gene encoding an integral membrane protein is mutated in nephropathic cystinosis[J]. Nat Genet, 1988, 18: 319–324. |
| [4] | Cherqui S, Courtoy PJ. The renal Fanconi syndrome in cystinosis:pathogenic insights and therapeutic perspectives[J]. Nat Rev Nephrol, 2017, 13: 115–131. |
| [5] | Elmonem MA, Veys KR, Soliman NA, et al. Cystinosis:a review[J]. Orphanet J Rare Dis, 2016, 11: 47. DOI:10.1186/s13023-016-0426-y |
| [6] | Schnaper HW, Cottel J, Merrill S, et al. Early occurence of end-stage renal disease in a patient with infantile cystinosis[J]. J Pediatr, 1992, 120: 575–578. DOI:10.1016/S0022-3476(05)82486-2 |
| [7] | Long WS, Seashore MR, Siegel NJ, et al. Idiopathic Fanconi Syndrome with progressive renal failure:a case report and discussion[J]. Yale J Biol Med, 1990, 63: 15–28. |
| [8] | Hult M, Darin N, von Döbeln U, et al. Epidemiology of lysosomal storage diseases in Sweden[J]. Acta Paediatr, 2014, 103: 1258–1263. DOI:10.1111/apa.2014.103.issue-12 |
| [9] | Elmonem MA, Mahmoud IG, Mehaney DA, et al. Lysosomal storage disorders in Egyptian children[J]. Ind J Pediatr, 2016, 83: 805–813. DOI:10.1007/s12098-015-2014-x |
| [10] | Soliman NA, Elmonem MA, van den Heuvel L, et al. Mutational spectrum of the CTNS gene in Egyptian patients with nephropathic cystinosis[J]. JIMD Rep, 2014, 14: 87–97. DOI:10.1007/978-3-662-43748-3 |
| [11] | Servais A, Morinière V, Grünfeld JP, et al. Late-onset nephropathic cystinosis:clinical presentation, outcome, and genotyping[J]. Clin J Am Soc Nephrol, 2008, 3: 27–35. DOI:10.2215/CJN.01740407 |
| [12] | Chan AM, Lynch MJ, Bailey JD, et al. Hypothyroidism in cystinosis. A clinical, endocrinologic and histologic study involving sixteen patients with cystinosis[J]. Am J Med, 1970, 48: 678–692. DOI:10.1016/S0002-9343(70)80002-X |
| [13] | Gahl WA, Reed GF, Thoene JG, et al. Cysteamine therapy for children with nephropathic cystinosis[J]. N Engl J Med, 1987, 316: 971–977. DOI:10.1056/NEJM198704163161602 |
| [14] | Filler G, Amendt P, von Bredow MA, et al. Slowly deteriorating insulin secretion and C-peptide production characterizes diabetes mellitus in infantile cystinosis[J]. Eur J Pediatr, 1998, 157: 738–742. DOI:10.1007/s004310050926 |
| [15] | Chik CL, Friedman A, Merriam GR, et al. Pituitary testicular function in nephropathiccystinosis[J]. Ann Intern Med, 1993, 119: 568–475. DOI:10.7326/0003-4819-119-7_Part_1-199310010-00004 |
| [16] | Besouw M, Levtchenko E. Growth retardation in children with cystinosis[J]. Minerva Pediatr, 2010, 62: 307–314. |
| [17] | Besouw MT, Van Dyck M, Francois I, et al. Detailed studies of growth hormone secretion in cystinosis patients[J]. Pediatr Nephrol, 2012, 27: 2123–2127. DOI:10.1007/s00467-012-2213-x |
| [18] | Levtchenko E, van den Heuvel L, Emma F, et al. Clinical utility gene card for:cystinosis[J]. Eur J Hum Genet, 2014, 22(5). |
| [19] | Shotelersuk V, Larson D, Anikster Y, et al. CTNS mutations in an American-based population of cystinosis patients[J]. Am J Hum Genet, 1998, 63: 1352–1362. DOI:10.1086/302118 |
| [20] | Thoene J, Lemons R, Anikster Y, et al. Mutations of CTNS causing intermediate cystinosis[J]. Mol Genet Metab, 1999, 67: 283–293. DOI:10.1006/mgme.1999.2876 |
| [21] | Chuang YW, Wen MC, Wu MJ, et al. Follow-up and treatment of renal transplantation with nephropathic cystinosis in central Taiwan[J]. Transplant Proc, 2012, 44: 80–82. DOI:10.1016/j.transproceed.2011.12.071 |
| (收稿日期:2017-04-17) |

