2. 110004 沈阳,中国医科大学附属盛京医院第七普通外科
2. The Seventh Department of General Surgery, Shengjing Hospital of China Medical University, Shenyang 110004, China
姜黄素(curcumin)是一种提取自干姜科(family Zingiberaceae)姜黄属(Curcuma longa)根茎中的天然多酚化合物,其在诸多亚洲国家中作为草药和日常饮食添加剂使用的历史颇为久远[1]。已知的姜黄素类(curcuminoid)如双阿魏酰甲烷(diferuloylmethane)主要由姜黄素构成(77%质量百分比,即77wt%),另两种分别是去甲氧基姜黄素(demethoxy curcumin,17wt%)和双去甲氧基姜黄素(bis-demethoxy curcumin,3wt%),其化学结构式见图 1[2]。姜黄素的化学名为1,7-双(4-羟基-3-甲氧基苯基)-1,6-庚二烯-3,5-二酮(1,7-bis-(4-hydroxy-3-methoxyphenyl)-hepta-1,6-diene-3,5-dione),化学式为C21H2006,pKa值为8.54。其化学结构使其极难溶于水,但易溶于甲醇、乙醇、二甲基亚砜(dimethyl sulphoxide,DMSO)和丙酮[2]。大量的研究表明姜黄素具有多种药理学活性,如抗氧化和抗炎作用[3],抗癌活性[4]和降血糖作用[5]等。一项Ⅰ期临床试验中即使口服姜黄素剂量达到12 g/d依然具有很好的耐受性,未发现与姜黄素有关的临床毒性[6]。
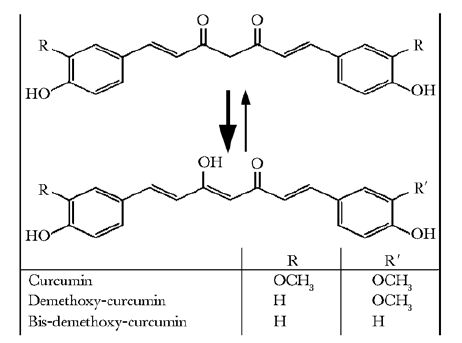
|
| 图 1 姜黄素类化学结构 Figure 1 Chemical structures of the curcuminoids |
骨重塑是一种动态稳定的平衡系统,若成骨细胞介导的骨形成和破骨细胞介导的骨吸收之间的微妙平衡被破坏而加速骨质丢失,就会出现骨强度降低和脆性增加,进而造成骨质疏松症甚至骨折[7]。在细胞水平,姜黄素能够调控多种重要的靶分子,如转录因子[核因子-kappa Beta(nuclear factor-kappa Beta,NF-κB)、激活蛋白-1(activator protein-1,AP-1)和β-链蛋白(β-catenin)],酶[环氧化酶2(cyclo-oxygenase-2,COX-2)和5-脂肪氧合酶(5-lipoxygenase,5-LOX)],细胞因子[肿瘤坏死因子-α(tumor necrosis factor- α,TNF-α)、白细胞介素-1 和-6(interleukin-1和-6,IL-1和-6],受体[表皮生长因子受体(epithelial growth factor receptor,EGFR)和低密度脂蛋白受体(low-density lipoprotein receptor,LDLR)]等[8]。因为上述靶分子多参与骨重塑的调控,研究人员因而认为姜黄素也可以影响骨骼系统[9]。
姜黄素对破骨细胞作用的体外研究多个研究组的体外实验结果表明姜黄素可以通过不同通路以不同方式抑制破骨细胞分化成熟或者促进其凋亡[10-18]。破骨细胞是一种起源于单核/巨噬细胞系造血干细胞的多核巨细胞,其分化成熟是一个多通道多层级系统并且依赖肿瘤坏死因子家族(tumor necrosis factor,TNF)细胞因子-核因子受体激活物-κB配体(receptor activator for nuclear factor-κ B ligand,RANKL)以及巨噬细胞集落刺激因子(macrophage colony-stimulating factor,M-CSF)[19]。M-CSF对破骨细胞前体的增生和生存起至关重要的作用,而RANKL与其受体RANK结合被认为是破骨细胞发生(osteoclastogenesis)的起始信号。RANKL主要由成骨细胞和间质细胞表达,与RANK结合后使TNF受体相关因子(TRAF)家族蛋白(主要是TRAF6)形成三聚体而激活,后者进一步激活NF-κB和MAPK(mitogen-activated kinases)信号[20]。NF-κB信号又可分为经典的NF-κB信号通路和NF-κB旁路途径。在经典的NF-κB信号通路,活化的TRAF6激活κB抑制物激酶(inhibitor of κB kinase,IKK),后者使κB抑制物(Iκ)磷酸化而被泛素-蛋白酶体系统降解从而释放出异二聚体化的NF-κB(主要为p50-RelA)而发挥作用[21]。除NF-κB信号以外,RANK/TRAF6/AP-1信号在破骨细胞的分化中也起到十分重要的作用。转录因子AP-1是由Fos(c-Fos、FosB、Fra-、Fra-2),Jun(c-Jun、JunB、JunD) 和 ATF (ATFa、ATF2、ATF3、ATF4、B-ATF)蛋白亚基构成的二聚体复合物,其中c-Fos和c-Jun是其重要的功能组分。Ozaki等[11, 15]用10 μmol/L姜黄素处理分离纯化的兔破骨细胞后发现凋亡率显著增加,并且这种促凋亡效果具有时间和剂量依赖性。凝胶迁移率实验分析结果说明促凋亡作用主要通过抑制NF-κB信号而不是AP-1信号。Metzler等[13]的研究用1和10 μmol/L姜黄素处理人外周血分离的前破骨细胞后TRAP(+)细胞数量与对照组相比分别降低了56%和81%,骨吸收活性则分别降低了56%和99%,呈现出明显的剂量相关性。此外,1和10 μmol/L姜黄素处理也显著抑制RANKL诱导的NF-κB激活(分别下降约43%和79%)。通过Western blot法检测IκB磷酸化水平发现姜黄素对IKK活性有明显的抑制作用。Bharti等[12]还发现在RANKL刺激RAW264.7细胞诱导分化24 h后再加用姜黄素(10 μmol/L)处理,对破骨细胞形成的抑制效果最明显。而RANKL刺激48 h后再加入姜黄素,其抑制效果反而随着时间的增加而逐渐降低。因此作者认为姜黄素作用于RANKL诱导破骨细胞形成通路的早期阶段,这一结论与NF-κB激活是破骨细胞前体对RANKL刺激的极早期反馈相一致[22]。此外,RANKL能够激活野生型RAW264.7细胞中的NF-κB,但是不能激活稳转IκBα显性失活细胞中的NF-κB,也不能诱导其分化,这更进一步说明了NF-κB在RANKL诱导破骨细胞形成中的决定性作用[12]。
RANKL对于破骨细胞分化的起始作用更加突显了成骨细胞和间质细胞在该过程中的重要性。事实上,多种促破骨细胞分化因子都以成骨细胞和间质细胞为靶细胞,促进其分泌RANKL。研究发现炎性细胞因子白细胞介素(interleukin,IL)-1可刺激成骨细胞和间质细胞表达RANKL而促进破骨细胞前体分化[23]。IL-1也可以提高环氧化酶2(cyclo-oxygenase,COX)-2的活性,进一步促进前列腺素E2(prostaglandin E2,PGE2)合成,PGE2又可以促进RANKL表达[24]。Oh等[10]用不同浓度(<4 μmol/L)的姜黄素与IL-1α(10 ng/mL)共培养C57BL/6J小鼠骨髓间质干细胞(bone marrow mesenchymal stem cell,BMSC),结果显示姜黄素以剂量依赖的方式下调IL-1α诱导的RANKL表达水平,显著抑制IL-1α对破骨细胞形成的刺激作用,但对IL-1α抑制OPG表达无明显作用。此外,姜黄素对IL-1α促进COX-2 mRNA表达无明显影响,向共培养体系中加入NS398(一种选择性COX-2抑制剂)能显著降低TRAP(+)细胞数量,但并未逆转姜黄素的抑制效果,提示姜黄素抑制破骨细胞形成与COX-2无关。同样的,甲状旁腺素(parathyroid hormone,PTH)也刺激成骨细胞和间质细胞表达RANKL。这可以解释在破骨细胞本身缺乏PTH受体的情况下,若PTH分泌过多,破骨细胞分化仍然明显加速的现象[25]。Yamaguchi等[16]发现姜黄素(0.1~100.0 μmol/L)对大鼠股骨骨干和干骺端体外培养系统中钙含量无明显影响,说明姜黄素不能在该条件下促进骨形成。有趣的是,姜黄素(0.01~10.00 μmol/L)能够显著抑制PTH(0.1 μmol/L)对破骨细胞形成的刺激作用,但却不能抑制股骨组织培养中PTH诱导的骨钙含量降低。
活性氧簇(reactive oxygen species,ROS)在细胞生存和分化成熟过程中扮演着第二信使和信号转导调控的重要角色。氧化应激(oxidative stress)状态下,ROS水平升高会刺激破骨细胞分化,促进骨吸收活性。同时,ROS也调控包括NF-κB信号在内的多种与破骨细胞分化有关的信号通路[26]。由于NF-κB抑制剂可以显著降低RANKL诱导的NFATc1水平[20],而在破骨细胞分化末期,NFATc1又与Fos和Jun蛋白共同诱导破骨细胞特异性基因表达[27]。因此,NFATc1被认为是破骨细胞分化过程中转录因子NF-κB和AP-1共同的靶基因。Moon等[17]和Kim等[18]的研究证实姜黄素(<5 μmol/L)可以显著抑制小鼠骨髓细胞内高半胱氨酸(homocysteine)活性,上调抗氧化酶-谷胱甘肽过氧化酶-1(glutathione peroxidase-1)的表达水平和活性,降低细胞内ROS生成水平,从而抑制破骨细胞分化。同时,上述作用与姜黄素抑制破骨细胞内RANKL诱导的IκB磷酸化,抑制c-Fos和NFATc1表达有关。雌激素缺乏可损害胞内抗氧化系统,诱导加重细胞内氧化应激,同时促进RANKL分泌。反过来,RANKL分泌增加又可以刺激骨髓细胞产生更多的ROS[28],而ROS正是破骨细胞分化的信号之一[26]。姜黄素发挥其抗氧化作用,降低细胞内ROS水平,可能是其抑制破骨细胞分化的可能机制之一。
姜黄素对成骨细胞作用的体外研究成骨细胞起源于未分化的多能间质细胞,其增生和分化成熟与骨形成作用密切相关。目前,姜黄素对成骨细胞作用的研究依然较少[29-30]。P21WAF1/CIP1是一种细胞周期依赖性蛋白激酶抑制物(cyclin-dependent kinase inhibitor,CKI),属于Cip/Kip家族,在成骨细胞分化过程中起“制动”作用[31]。姜黄素(10 μmol/L)能够促进体外分离培养的大鼠颅骨来源成骨细胞(ROB)中P21WAF1/CIP1 mRNA表达,抑制组蛋白H1磷酸化而抑制染色质凝缩,诱导G1期细胞周期停滞从而抑制成骨细胞增生。此外,姜黄素(<10 μmol/L)还以剂量和时间依赖形式抑制钙离子沉积和矿化小结的形成,但是对碱性磷酸酶活性和骨钙素的mRNA表达水平无明显影响[29]。
实验证明细胞内ATP水平可以调控细胞死亡方式:高代谢高ATP水平促进胞内ROS产生,进一步激活caspase-3而诱导细胞凋亡;低ATP水平主要诱导细胞坏死[32]。Chan等[30]用不同浓度姜黄素(12.5~200.0 μmol/L)与人成骨细胞系HFOb1.19共培养后发现成骨细胞生存被显著抑制,其中12.5~25.0 μmol/L 姜黄素提高了胞内ATP水平和ROS浓度,促进caspase-3激活和PARP剪切,主要诱导成骨细胞凋亡;50~200 μmol/L姜黄素则降低胞内ATP水平,对胞内ROS浓度和caspase-3活化无明显影响,主要诱导细胞坏死。而且,成骨细胞从凋亡向坏死的快速转变只出现在一个相对狭窄的姜黄素浓度范围内(25~50 μmol/L),即浓度太高时对成骨细胞呈现抑制作用。
尽管姜黄素在之前的体外研究中展现出对破骨细胞一致的抑制作用,因而被视为一种可能用于“治疗”骨质疏松症的药物成分,但是其作用于成骨细胞的体外研究结果却并不积极正面,这可能与实验过程中姜黄素的浓度和处理对象不同有关。在Notoya等[29]的实验中,姜黄素的浓度与前人体外破骨细胞实验中浓度近似(≤10 μmol/L),却发现姜黄素可以抑制大鼠原代成骨细胞增生和功能。而Chan等[30]将姜黄素浓度提高至12.5~200.0 μmol/L后,其仍然展现出对人成骨细胞系HFOb1.19的负性抑制作用。尽管如此,与体内研究相比,体外试验仍然是一种处理环境相对可控,潜在干扰因素较少的试验方式。因此,姜黄素对于骨重塑过程的影响以及作用方向仍然需要体内研究进一步明确。
姜黄素对骨骼系统作用的体内研究由于在之前的体外研究中展现出了对破骨细胞分化和骨吸收功能的抑制性,姜黄素被认为是可能缓解骨质疏松性骨丢失、提高骨强度的潜在药物成分。以双侧卵巢摘除(ovariectomize,OVX)大鼠构建绝经后骨质疏松模型可模拟雌激素缺乏时由于破骨细胞功能亢进和骨更新加快而导致的小梁骨过度丢失,这也是目前姜黄素体内骨保护作用的主要研究[33-35]。
French等[33]经饲料给予OVX大鼠补充姜黄素(1.5~15.0 mg/d)。结果显示与对照组相比,姜黄素可以改善OVX大鼠腰椎BMD但不能改善股骨BMD值。此外,姜黄素还可以降低血骨钙素和胶原片段浓度,提示其对OVX大鼠体内破骨细胞介导的骨吸收有抑制效果,但差异无统计学意义。有趣的是,补充姜黄素15 mg/d可以显著提高OVX大鼠股骨尺寸,这也导致股骨致骨折能量(energy to fracture)和姜黄素剂量(1.5、5、15 mg/d)之间存在明显的剂量反应关系,这一现象可能与雌激素缺乏早期主要以小梁骨快速丢失,而皮质骨改变不明显和长骨纵向生长增加有关[36]。Folwarczna等[34]在摘除大鼠双侧卵巢前后给予其口服姜黄素(10 mg/kg·d)4周后发现,当大鼠体内雌激素水平正常时,姜黄素可以显著降低血雌二醇水平,轻度提高松质骨形成,但会抑制骨矿化作用。当雌激素缺乏时,姜黄素能够明显降低血清总胆固醇水平,轻微改善骨组织形态学指标,但是对骨矿化作用和股骨颈机械强度无明显积极影响。因此,研究人员认为以10 mg/kg·d的剂量口服姜黄素并不能改善大鼠因雌激素缺乏而出现的骨质疏松。与之前的体内研究未能得出姜黄素对骨骼系统有积极作用的结论不同,Hussan等[35]的研究结论似乎更为积极和明确。实验中Hussan等[35]将姜黄素口服剂量提高至110 mg/kg共60 d,结果证明姜黄素可以显著改善因雌激素缺乏而受损的各项骨组织形态学指标,如骨量、骨小梁厚度和骨小梁数量等。同时,姜黄素亦能明显提高OVX大鼠体内成骨细胞数量,抑制破骨细胞数量并降低骨表面侵蚀面积(eroded surface)。
除了OVX大鼠骨质疏松模型以外,姜黄素在APP/PS1转基因小鼠阿尔茨海默氏症模型[37]和链脲霉素诱导大鼠糖尿病模型(streptozotocin-induced diabetes)中均展现出明确的骨保护效果。Hie等[14]用链脲霉素(streptozotocin)诱导大鼠糖尿病模型并每日经饲料补充姜黄素(120 mg/d),8 d后获得骨髓细胞并体外培养,其中糖尿病组大鼠骨髓细胞形成TRAP(+)细胞的能力更强。而补充姜黄素可降低TRAP(+)细胞数量至接近对照组水平。此外,姜黄素可显著降低因糖尿病所致的破骨细胞前体数量增加,同时也可下调糖尿病组大鼠细胞内升高的c-Fos和c-Jun的mRNA和蛋白表达水平。以上结果说明姜黄素可以通过抑制AP-1信号抑制糖尿病大鼠体内破骨细胞形成。在APP/PS1转基因小鼠,姜黄素(600 mg/kg)可以使升高的TNF-α和IL-6水平回落至野生型对照小鼠水平。 这说明上述炎性细胞因子可能参与姜黄素对骨组织的保护作用,但具体机制尚不清楚[37]。
值得注意的是,姜黄素在上述不同的体内研究中均是通过每日经饲料口服给药,但是在给药量较小时(French等[33]应用1.5~15.0 mg/d 以及Folwarczna等[34]应用10 mg/kg·d)并未在体内展现出显著的骨保护作用,甚至出现轻微的抑制骨矿化作用,但差异无统计学意义。联系之前的体外试验结果:姜黄素在低浓度时不仅能够抑制破骨细胞的分化成熟和骨吸收功能,也能同时抑制成骨细胞增生和功能,但目前尚不清楚这是否能够在一定程度上解释为何姜黄素在低给药量时未能正向调控骨重塑过程。然而,提高给药量和延长给药时间却可以在动物模型体内产生明确的骨保护作用[14, 35, 37]。
展望近20年来,姜黄素因其展现出多种药理活性而备受关注,但是关于姜黄素在体内外对于骨重塑影响的研究依然相对匮乏,而且结论似乎并不统一,这可能与实验系统中姜黄素的剂量浓度不同以及处理对象不同有关[9]。虽然姜黄素的有效性和安全性得到了多方证实,但是其较差的生物利用度仍是目前制约其应用的主要问题[38]。随着临床研究的开展以及作用机制研究的逐步深入,相信在不久的将来姜黄素一定会获得更广泛的应用空间。
| [1] | Li Y, Zhang T. Targeting cancer stem cells by curcumin and clinical applications[J]. Cancer Lett, 2014, 346 : 197–205. DOI:10.1016/j.canlet.2014.01.012 |
| [2] | Ravindran PN, Nirmal Babu K, Sivaraman K. Turmeric: The GenusCurcuma[M]. London & New York: CRC Press: Taylor & Francis Group, LLC, Boca Raton, 2007 : 193-256. |
| [3] | Liu L, Shang Y, Li M, et al. Curcumin ameliorates asthmatic airway inflammation by activating nuclear factor-E2-related factor 2/haem oxygenase (HO)-1 signalling pathway[J]. Clin Exp Pharmacol Physiol, 2015, 42 : 520–529. DOI:10.1111/cep.2015.42.issue-5 |
| [4] | Seo BR, Min KJ, Cho IJ, et al. Curcumin significantly enhances dual PI3K/Akt and mTOR inhibitor NVP-BEZ235-induced apoptosis in human renal carcinoma Caki cells through down-regulation of p53-dependent Bcl-2 expression and inhibition of Mcl-1 protein stability[J]. PLoS One, 2014, 9 : e95588. DOI:10.1371/journal.pone.0095588 |
| [5] | El-Azab MF, Attia FM, El-Mowafy AM. Novel role of curcumin combined with bone marrow transplantation in reversing experimental diabetes: Effects on pancreatic islet regeneration,oxidative stress,and inflammatory cytokines[J]. Eur J Pharmacol, 2011, 658 : 41–48. DOI:10.1016/j.ejphar.2011.02.010 |
| [6] | Lao CD, Ruffin MT 4th, Normolle D, et al. Dose escalation of a curcuminoid formulation[J]. BMC Complement Altern Med, 2006, 6 : 10. DOI:10.1186/1472-6882-6-10 |
| [7] | Pisani P, Renna MD, Conversano F, et al. Major osteoporotic fragility fractures: Risk factor updates and societal impact[J]. World J Orthop, 2016, 7 : 171–181. DOI:10.5312/wjo.v7.i3.171 |
| [8] | Gupta SC, Kismali G, Aggarwal BB. Curcumin,a component of turmeric: from farm to pharmacy[J]. Biofactors, 2013, 39 : 2–13. DOI:10.1002/biof.1079 |
| [9] | Peddada KV, Peddada KV, Shukla SK, et al. Role of curcumin in common musculoskeletal disorders: a review of current laboratory,translational,and clinical data[J]. Orthop Surg, 2015, 7 : 222–231. DOI:10.1111/os.2015.7.issue-3 |
| [10] | Oh S, Kyung TW, Choi HS. Curcumin inhibits osteoclastogenesis by decreasing receptor activator of nuclear factor-kappaB ligand (RANKL) in bone marrow stromal cells[J]. Mol Cells, 2008, 26 : 486–489. |
| [11] | Ozaki K, Kawata Y, Amano S, et al. Stimulatory effect of curcumin on osteoclast apoptosis[J]. Biochem Pharmacol, 2000, 59 : 1577–1581. DOI:10.1016/S0006-2952(00)00277-X |
| [12] | Bharti AC, Takada Y, Aggarwal BB. Curcumin (diferuloylmethane) inhibits receptor activator of NF-kappa B ligand-induced NF-kappa B activation in osteoclast precursors and suppresses osteoclastogenesis[J]. J Immunol, 2004, 172 : 5940–5947. DOI:10.4049/jimmunol.172.10.5940 |
| [13] | Metzler IV, Krebbel H, Kuckelkorn U, et al. Curcumin diminishes human osteoclastogenesis by inhibition of the signalosome-associated I kappaB kinase[J]. J Cancer Res Clin Oncol, 2009, 135 : 173–179. DOI:10.1007/s00432-008-0461-8 |
| [14] | Hie M, Yamazaki M, Tsukamoto I. Curcumin suppresses increased bone resorption by inhibiting osteoclastogenesis in rats with streptozotocin-induced diabetes[J]. Eur J Pharmacol, 2009, 621 : 1–9. DOI:10.1016/j.ejphar.2009.08.025 |
| [15] | Ozaki K, Takeda H, Iwahashi H, et al. NF-kappaB inhibitors stimulate apoptosis of rabbit mature osteoclasts and inhibit bone resorption by these cells[J]. FEBS Lett, 1997, 410 : 297–300. DOI:10.1016/S0014-5793(97)00653-4 |
| [16] | Yamaguchi M, Hamamoto R, Uchiyama S, et al. Effects of flavonoid on calcium content in femoral tissue culture and parathyroid hormone-stimulated osteoclastogenesis in bone marrow culture in vitro[J]. Mol Cell Biochem, 2007, 303 : 83–88. DOI:10.1007/s11010-007-9458-x |
| [17] | Moon HJ, Ko WK, Han SW, et al. Antioxidants,like coenzyme Q10,selenite,and curcumin,inhibited osteoclast differentiation by suppressing reactive oxygen species generation[J]. Biochem Biophys Res Commun, 2012, 418 : 247–253. DOI:10.1016/j.bbrc.2012.01.005 |
| [18] | Kim WK, Ke K, Sul OJ, et al. Curcumin protects against ovariectomy-induced bone loss and decreases osteoclastogenesis[J]. J Cell Biochem, 2011, 112 : 3159–3166. DOI:10.1002/jcb.v112.11 |
| [19] | Boyle WJ, Simonet WS, Lacey DL. Osteoclast differentiation and activation[J]. Nature, 2003, 423 : 337–342. DOI:10.1038/nature01658 |
| [20] | Asagiri M, Takayanagi H. The molecular understanding of osteoclast differentiation[J]. Bone, 2007, 40 : 251–264. DOI:10.1016/j.bone.2006.09.023 |
| [21] | Soysa NS, Alles N. NF-kappaB functions in osteoclasts[J]. Biochem Biophys Res Commun, 2009, 378 : 1–5. DOI:10.1016/j.bbrc.2008.10.146 |
| [22] | Takatsuna H, Asagiri M, Kubota T, et al. Inhibition of RANKL-induced osteoclastogenesis by (-)-DHMEQ,a novel NF-kappaB inhibitor,through downregulation of NFATc1[J]. J Bone Miner Res, 2005, 20 : 653–662. |
| [23] | Suda K, Udagawa N, Sato N, et al. Suppression of osteoprotegerin expression by prostaglandin E2 is crucially involved in lipopolysaccharide-induced osteoclast formation[J]. J Immunol, 2004, 172 : 2504–2510. DOI:10.4049/jimmunol.172.4.2504 |
| [24] | Kim JH, Kim EY, Lee B, et al. The effects of Lycii Radicis Cortex on RANKL-induced osteoclast differentiation and activation in RAW 264.7 cells[J]. Int J Mol Med, 2016, 37 : 649–658. |
| [25] | Lee SK, Lorenzo JA. Parathyroid hormone stimulates TRANCE and inhibits osteoprotegerin messenger ribonucleic acid expression in murine bone marrow cultures: correlation with osteoclast-like cell formation[J]. Endocrinology, 1999, 140 : 3552–3561. |
| [26] | Joo JH, Huh JE, Lee JH, et al. A novel pyrazole derivative protects from ovariectomy-induced osteoporosis through the inhibition of NADPH oxidase[J]. Sci Rep, 2016, 6 : 22389. DOI:10.1038/srep22389 |
| [27] | Wagner EF, Eferl R. Fos/AP-1 proteins in bone and the immune system[J]. Immunol Rev, 2005, 208 : 126–140. DOI:10.1111/imr.2005.208.issue-1 |
| [28] | Muthusami S, Ramachandran I, Muthusamy B, et al. Ovariectomy induces oxidative stress and impairs bone antioxidant system in adult rats[J]. Clin Chim Acta, 2005, 360 : 81–86. DOI:10.1016/j.cccn.2005.04.014 |
| [29] | Notoya M, Nishimura H, Woo JT, et al. Curcumin inhibits the proliferation and mineralization of cultured osteoblasts[J]. Eur J Pharmacol, 2006, 534 : 55–62. DOI:10.1016/j.ejphar.2006.01.028 |
| [30] | Chan WH, Wu HY, Chang WH. Dosage effects of curcumin on cell death types in a human osteoblast cell line[J]. Food Chem Toxicol, 2006, 44 : 1362–1371. DOI:10.1016/j.fct.2006.03.001 |
| [31] | Denicourt C, Dowdy SF. Cip/Kip proteins: more than just CDKs inhibitors[J]. Genes Dev, 2004, 18 : 851–855. DOI:10.1101/gad.1205304 |
| [32] | Chan WH, Wu CC, Yu JS. Curcumin inhibits UV irradiation-induced oxidative stress and apoptotic biochemical changes in human epidermoid carcinoma A431 cells[J]. J Cell Biochem, 2003, 90 : 327–338. DOI:10.1002/(ISSN)1097-4644 |
| [33] | French DL, Muir JM, Webber CE. The ovariectomized,mature rat model of postmenopausal osteoporosis: an assessment of the bone sparing effects of curcumin[J]. Phytomedicine, 2008, 15 : 1069–1078. DOI:10.1016/j.phymed.2008.06.007 |
| [34] | Folwarczna J, Zych M, Trzeciak HI. Effects of curcumin on the skeletal system in rats[J]. Pharmacol Rep, 2010, 62 : 900–909. DOI:10.1016/S1734-1140(10)70350-9 |
| [35] | Hussan F, Ibraheem NG, Kamarudin TA, et al. Curcumin protects against ovariectomy-induced bone changes in rat model[J]. Evid Based Complement Alternat Med, 2012, 2012 : 174916. |
| [36] | Sophocleous A, Idris AI. Rodent models of osteoporosis[J]. Bonekey Rep, 2014, 3 : 614. DOI:10.1038/bonekey.2014.109 |
| [37] | Yang MW, Wang TH, Yan PP, et al. Curcumin improves bone microarchitecture and enhances mineral density in APP/PS1 transgenic mice[J]. Phytomedicine, 2011, 18 : 205–213. DOI:10.1016/j.phymed.2010.05.011 |
| [38] | Anand P, Kunnumakkara AB, Newman RA, et al. Bioavailability of curcumin: problems and promises[J]. Mol Pharm, 2007, 4 : 807–818. DOI:10.1021/mp700113r |
| (收稿日期:2015-12-02) |

