2. 215123 苏州,苏州大学唐仲英医学研究院血液学研究中心;
3. 215004 苏州,苏州大学骨质疏松症诊疗技术研究所
2. Hematology Center of Cyrus Tang Medical Institute, Soochow University School of Medicine, Suzhou 215123, China;
3. Osteoporosis Institute of Soochow University, Suzhou 215004, China
骨髓微环境(niche)包括造血干细胞(hematopoietic stem cells,HSCs)在内的多种细胞,对骨髓和骨的代谢均有重要的支持作用[1]。近年来,有临床研究报道造血干细胞移植的患者移植后骨量减低、骨质疏松症发生率很高[2-5],这些变化可能与HSCs 变化对成骨细胞产生负向影响有关;另一方面,成骨细胞受到间充质干细胞(mesenchymal stem cells,MSCs)影响,而MSCs与HSCs属于细胞来源的上游层面,作者在研究铁蓄积对成骨细胞影响中,发现铁蓄积对成骨细胞上游MSCs有显著影响。既然HSCs变化可引起骨质疏松,那么铁蓄积是否会对HSCs产生影响,进而对骨质疏松形成产生一定作用?这对全面了解铁蓄积与骨质疏松的关系,进一步了解铁蓄积对骨质疏松形成的作用靶点有潜在意义。本研究运用铁蓄积骨质疏松模型,观察HSCs数量、功能变化,旨在了解、分析铁蓄积对骨量变化和HSCs变化的影响。
材料与方法 实验动物选取6~8周SPF级雄性C57小鼠[苏州大学实验动物中心,实验动物许可证号:SYXK(苏)2014-0030],12只,体质量(25±1)g;小鼠分为对照组和铁蓄积骨质疏松组,每组6只。铁蓄积骨质疏松采用腹腔注射枸橼酸铁铵(ferric ammonium citrate,FAC)0.1 g/kg,每周1次,共8周[6];对照组采用腹腔注射0.9%氯化钠注射液处理0.1 g/kg,每周1次,共8周,8周后麻醉处死。
血清铁蛋白和骨转换指标检测小鼠麻醉后眼眶取血,ELISA法检测血清铁蛋白(ferritin,FER)(ABCam),骨转换指标包括成骨标志物胶原1型氨基端前肽(procollagen type 1 N-terminal propeptide,P1NP)(USCNlife)、破骨标志物CTX(IDS),具体操作步骤按说明书进行。
Micro-CT扫描各组小鼠处死后分离单侧股骨,使用micro-CT扫描,进行股骨远端骨小梁三维形态重建和空间结构参数分析。分析参数包括:骨密度(bone mineral density,BMD)、骨体积分数(bone volume/tissue volume,BV/TV)、骨小梁厚度(trabecular thickness,Tb.Th)、骨小梁数(trabecular number,Tb.N)。
流式细胞仪检测骨髓中造血干细胞比例小鼠处死后使用PBS冲洗股骨和胫骨骨髓,使用Ficoll-Paque(GE Healthcare)分离单个核细胞,根据Lin-细胞分离试剂盒(Miltenyi Biotec)说明通过免疫磁珠分离法获得Lin-细胞,使用流式细胞仪(Aria Ⅲ,BD Biosciences,Franklin Lakes,NJ)检测Lin-Sca-1+c-Kit+细胞占骨髓细胞比例。
外周血检测小鼠处死后眼眶取血,加入肝素钠后使用血细胞分析仪测定外周血白细胞(white blood cell,WBC)、红细胞(red blood cell,RBC)、红细胞压积(hematokrit,HCT)、红细胞平均体积(mean corpuscular volume,MCV)、血小板(platelet,PLT)、血红蛋白(hemoglobin,HGB)。
集落形成实验(colony-forming units,CFU)小鼠骨髓分离Lin-细胞至含2% FBS (Gibco)的IMDM(Hyclone)培养基中,按照HSC-CFU标准(Miltenyi Biotec)加入35 mm培养皿。培养箱37 ℃,5% CO2湿润条件下培养7~9 d后计数集落。
统计学方法采用统计软件SPSS19.0进行统计,实验数据以均数±标准差(x±s)表示,组间比较行t检验,以P<0.05表示差异有统计学意义。
结果 血清铁蛋白、胶原1型氨基端前肽、CTX检测结果ELISA检测结果显示,FAC组干预8周后FER水平较明显升高,差异具有统计学意义(P<0.05)(图 1);成骨细胞核心指标P1NP水平明显受抑制、破骨细胞核心指标CTX水平明显升高,与对照组比较差异具有统计学意义(P<0.05)(图 1)。
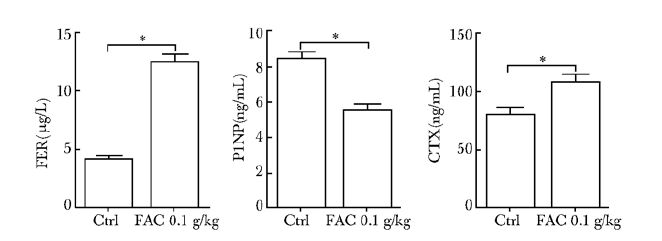
|
| 图 1 铁蓄积模型组与对照组血清FER、P1NP、CTX Figure 1 Serum FER,P1NP,CTX levels compared between iron accumulation model group and control group FER:血清铁蛋白; P1NP:胶原1型氨基端前肽; CTX:破骨标志物; FAC:枸橼酸铁铵; *P<0.05 |
外周血检查结果显示,FAC组干预8周与对照组比较小鼠外周血白细胞、红细胞、红细胞压积、红细胞平均体积、血红蛋白并无明显变化(P>0.05),FAC组血小板有升高趋势(P<0.05)(图 2)。
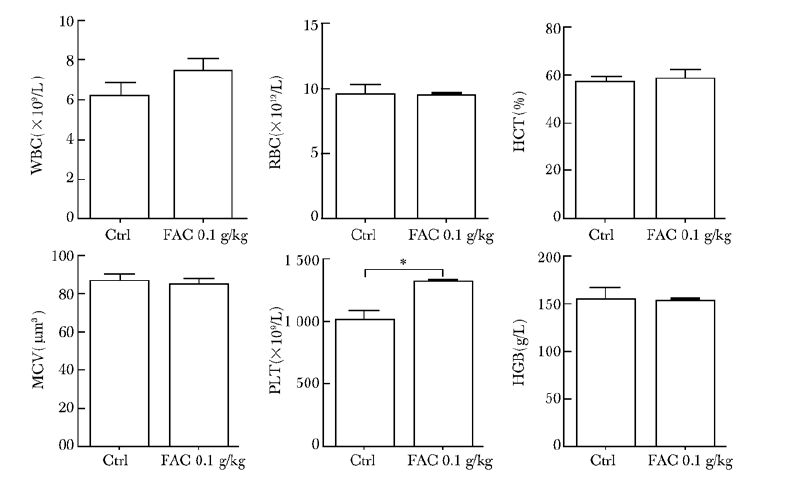
|
| 图 2 铁蓄积模型组与对照组外周血比较 Figure 2 Peripheral blood routin test compared between iron accumulation model group and control group FAC:枸橼酸铁铵; WBC:白细胞; RBC:红细胞; HCT:红细胞压积; MCV:红细胞平均体积; PLT:血小板; HGB:血红蛋白;*P<0.05 |
股骨远端micro-CT检测结果显示,FAC组干预8周后骨小梁结构破坏、骨小梁变稀疏、连续性下降;骨小梁空间结构参数显示:FAC组BMD、BV/TV、Tb.th、Tb/N值比对照组明显下降(P<0.05)(表 1、图 3)。
| 组别 | BMD(mg/mm3) | BV/TV(%) | Tb.th(mm) | Tb.N(N/mm) |
| Ctrl(n=5) | 104.68±8.56 | 19.92±1.92 | 0.098±0.008 | 1.45±0.13 |
| FAC(n=5) | 50.41±10.27* | 10.18±1.76* | 0.057±0.012* | 1.02±0.21* |
| Ctrl:对照组;FAC:枸橼酸铁铵; BMD:体积骨密度值;BV/TV:骨体积分数;Tb.th:骨小梁厚度;Tb.N:骨小梁数;与Ctrl组比较,*P<0.05 | ||||
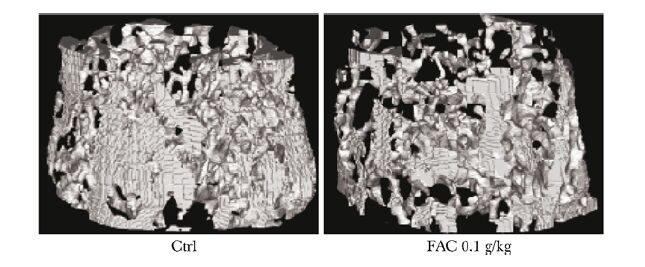
|
| 图 3 铁蓄积模型组与对照组micro-CT股骨远端骨小梁三维重建图 Figure 3 Distal femoral trabecular (by micro-CT) three -dimensional reconstruction compared between iron accumulation model group and control group FAC:枸橼酸铁铵 |
骨髓Lin-细胞流式细胞仪检测结果显示,与对照组相比,FAC组干预8周小鼠骨髓内LSK细胞占骨髓细胞比例明显升高(P<0.05)(图 4)。
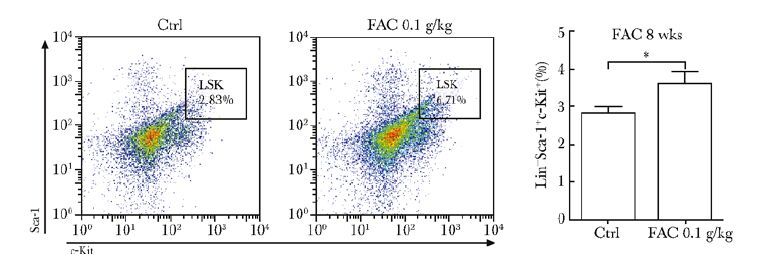
|
| 图 4 铁蓄积模型组与对照组流式细胞仪检测骨髓HSCs比较 Figure 4 Detection analysis HSCs accounts for the proportion of bone marrow cells by flow cytometry compared between iron accumulation model group and control group HSCs:造血干细胞; Ctrl:对照组;FAC:枸橼酸铁铵; *P<0.05 |
FAC组与对照组比较,FAC组干预8周小鼠LSK细胞体外集落形成数目明显增多(P<0.05),集落密集(图 5)。

|
| 图 5 铁蓄积模型组与对照组LSK细胞集落形成实验的比较 Figure 5 LSK cell colony forming experiment compared between iron accumulation model group and control group Ctrl:对照组;FAC:枸橼酸铁铵; *P<0.05 |
近些年许多临床研究提出:“铁蓄积”是骨质疏松症的一个独立危险因素[7-9];对铁蓄积与骨代谢相关性基础研究提出:铁蓄积对成骨细胞功能有显著抑制作用[10],同时也发现铁蓄积对成骨细胞上游的MSCs有抑制影响,主要是铁蓄积通过增加ROS水平抑制MSCs的成骨分化作用,同时有利于MSCs成脂分化作用[11]。
另一个领域:有研究认为造血干细胞(HSCs)与成骨细胞有潜在相关性。造血干细胞能够增生、分化,最后成为“成熟血液细胞”进入外周血系统,这一过程都离不开骨髓造血微环境(BMHME)的调节;BMHME由骨髓基质细胞(BMSC)组成,BMSC与MSCs都具有分化成骨细胞的重要功能;这也说明体内造血干细胞与成骨细胞之间有着非常密切的空间关系。关于造血干细胞(HSCs)与骨质疏松症相关性的研究报道有许多,主要是临床中有发现造血干细胞移植(HSCT)会导致患者骨量减低、骨质疏松症发生,Kauppila等[2]报道:横断面研究25例造血干细胞移植患者,移植后至少1年(平均3年)发现5名患者骨密度(BMD)下降到骨质疏松水平;Lee等[3]对11例HSCT患者3年前瞻性研究认为,移植后6个月骨量开始下降,11例患者腰椎平均下降5.7%、股骨颈平均下降6.9%~8.7%;Schulte等[4]对较大样本(280例)HSCT患者研究发现,移植后6~24个月期间BMD下降明显,此后维持BMD低水平,48个月后BMD仍然没有恢复至原始水平;另外,Syrjala 等[5]的长期观察认为,137例HSCT患者移植后10年骨质疏松症并发症依然较为多见。
铁蓄积对成骨细胞有影响,对间充质干细胞有影响,那么,对造血干细胞会不会有影响?这对了解铁代谢与骨代谢相关性有比较重要的实验价值。造血干细胞移植患者骨量下降、骨质疏松症现象增加原因非常复杂,目前的实验研究也很少涉及。造血干细胞移植主要是患者免疫功能医源性降低、异体HSCs短期显著增多;HSCs工作需要造血干细胞微环境,微环境是体内组织中干细胞进行自我更新并能产生祖细胞的环境;成骨细胞及血管内皮细胞是造血干细胞微环境的重要组成部分[12-13];所以,造血干细胞数量改变、造血干细胞功能改变对骨代谢影响可能是了解“HSCs与骨代谢相关性”的一个起点,本研究了解铁蓄积骨质疏松模型中造血干细胞数量改变、造血干细胞功能改变对全面了解“铁蓄积与骨质疏松症关系”有一定启发意义。
本实验使用腹腔注射8周FAC制作铁蓄积骨质疏松模型[6],血清ELISA结果证实体内血清铁蛋白升高。Micro-CT结果显示股骨远端骨量下降、骨小梁稀疏,血清成骨标志物P1NP下降、破骨标志物CTX上升,表明骨质疏松模型成功。
在铁蓄积骨质疏松模型中,血液系统检查显示外周血WBC、RBC、HCT、MCV、HGB无明显变化,说明本研究动物模型的铁蓄积水平,没有影响体内血细胞变化。然而,本实验中,血小板数量升高,这可能与血小板对铁蓄积产生的ROS比较敏感有关[14-15]。铁蓄积引起的血小板升高的现象和HSCs有无关联有待研究。
关于HSCs和成骨细胞,本实验显示铁蓄积骨质疏松模型骨髓内Lin-Sca-1+c-Kit+标记的HSCs细胞占骨髓细胞比例升高,细胞功能学显示细胞分化能力增强,实验组8周的HSCs功能明显增高。Elizabeth等发现小鼠辐照后移植具有造血功能的SP细胞后可形成骨先质细胞群,提示造血系细胞有成骨细胞前体细胞功能[1]。在白血病动物模型中造血系统受到破坏后可以观察到骨量下降、BMD减低、成骨矿化减弱、成骨细胞受到抑制[16];甲状旁腺素(PTH)在促进成骨细胞同时也对HSCs有促进作用[17],Yu等[18]临床使用特立帕肽(PTH)治疗绝经后女性骨质疏松症,发现治疗3个月起循环HSCs数量升高40%±14%,外周血常规并无明显变化,HSCs增加的峰值与脊柱BMD、骨转换指标增加的峰值吻合,HSCs可能参与成骨过程,同时成骨细胞对维持HSCs起一定作用[19]。 本实验中,模型组体内铁增加后成骨标志物P1NP指标下降,提示成骨功能降低,但同时HSCs数量升高,这与其他的“HSCs与成骨细胞”结果不同,我们考虑:可能与体内铁蓄积首先导致成骨细胞功能抑制,HSCs代偿性升高(可弥补体内成骨功能)有一定相关性,当然,这一现象的深入探究还有待进一步相关实验资料分析。
关于HSCs和破骨细胞,本实验显示HSCs增加、破骨细胞功能指标CTX也升高。有研究认为急性髓系白血病动物模型中,破骨细胞有一过性升高[16];这个结果提示造血系统异常与破骨细胞可能存在关联:造血干细胞可分化为单核细胞,单核细胞可分化为破骨细胞。所以,本实验CTX升高(破骨细胞功能增加)可能源于铁蓄积模型小鼠体内造血干细胞升高导致破骨细胞前体细胞增多、分化程度升高。
本实验在铁蓄积骨质疏松模型中最早开展铁蓄积对骨髓HSCs数量、功能相关性研究,结果也属于现象层面,具体相关机制仍有待下一步研究。但是,铁蓄积骨质疏松中HSCs指标异常很可能在这类骨质疏松症有着潜在的实际临床意义,同时,实验结果、资料也非常有助于完善对铁蓄积骨质疏松症的发病机制、防治方法的研究和认识。
| [1] | Olmsted-Davis, Gugala Z, Camargo F, et al. Primitive adult hematopoietic stem cells can function as osteoblast precursors[J]. Proc Natl Acad Sci USA, 2003, 100 : 15877–15882. DOI:10.1073/pnas.2632959100 |
| [2] | Kauppila M, Irjala K, Koskinen P, et al. Bone mineral density after allogeneic bone marrow transplantation[J]. Bone Marrow Transplant, 1999, 24 : 885–889. DOI:10.1038/sj.bmt.1701989 |
| [3] | Lee WY, Kang MI, Baek KH, et al. The skeletal site-differential changes in bone mineral density following bone marrow transplantation: 3-year prospective study[J]. J Korean Med Sci, 2002, 17 : 749–754. DOI:10.3346/jkms.2002.17.6.749 |
| [4] | Schulte CM, Beelen DW. Bone loss following hematopoietic stem cell transplantation: a long-term follow-up[J]. Blood, 2004, 103 : 3635–3643. |
| [5] | Syrjala KL, Langer SL, Abrams JR, et al. Late effects of hematopoietic cell transplantation among 10-year adult survivors compared with case-matched controls[J]. J Clin Oncol, 2005, 23 : 6596–6606. DOI:10.1200/JCO.2005.12.674 |
| [6] | Tsay J, Yang Z, Ross FP, et al. Bone loss caused by iron overload in a murine model: importance of oxidative stress[J]. Blood, 2010, 116 : 2582–2589. DOI:10.1182/blood-2009-12-260083 |
| [7] | Weinberg ED. Iron loading: a risk factor for osteoporosis[J]. Biometals, 2006, 19 : 633–635. DOI:10.1007/s10534-006-9000-8 |
| [8] | Huang X, Xu Y, Partridge NC. Dancing with sex hormones, could iron contribute to the gender difference in osteoporosis?[J]. Bone, 2013, 55 : 458–460. DOI:10.1016/j.bone.2013.03.008 |
| [9] | Kim BJ, Ahn SH, Bae SJ, et al. Iron overload accelerates bone loss in healthy postmenopausal women and middle-aged men: a 3-year retrospective longitudinal study[J]. J Bone Miner Res, 2012, 27 : 2279–2290. DOI:10.1002/jbmr.v27.11 |
| [10] | He YF, Ma Y, Gao C, et al. Iron overload inhibits osteoblast biological activity through oxidative stress[J]. Biol Trace Elem Res, 2013, 152 : 292–296. DOI:10.1007/s12011-013-9605-z |
| [11] | Lu W, Zhao M, Rajbhandary S, et al. Free iron catalyzes oxidative damage to hematopoietic cells/mesenchymal stem cells in vitro and suppresses hematopoiesis in iron overload patients[J]. Eur J Haematol, 2013, 91 : 249–261. DOI:10.1111/ejh.2013.91.issue-3 |
| [12] | Fei CM, Chang CK. Roles of osteoblasts in hematopoietic stem cell niche and relationship between osteoblasts and hematopoietic diseases[J]. Zhongguo Shiyan Xueyexue Zazhi, 2014, 22 : 1133–1136. |
| [13] | Wu C, Giaccia AJ, Rankin EB. Osteoblasts: a novel source of erythropoietin[J]. Curr Osteoporos Rep, 2014, 12 : 428–432. DOI:10.1007/s11914-014-0236-x |
| [14] | Popov VM, Vladareanu AM, Bumbea H, et al. Hemorrhagic risk due to platelet dysfunction in myelodysplastic patients, correlations with anemia severity and iron overload[J]. Blood Coagul Fibrinolysis, 2015, 26 : 743–749. |
| [15] | Breccia M, Voso MT, Aloe Spiriti MA, et al. An increase in hemoglobin, platelets and white blood cells levels by iron chelation as single treatment in multitransfused patients with myelodysplastic syndromes: clinical evidences and possible biological mechanisms[J]. Ann Hematol, 2015, 94 : 771–777. DOI:10.1007/s00277-015-2341-z |
| [16] | Frisch BJ, Ashton JM, Xing L, et al. Functional inhibition of osteoblastic cells in an in vivo mouse model of myeloid leukemia[J]. Blood, 2012, 119 : 540–550. DOI:10.1182/blood-2011-04-348151 |
| [17] | Whitfield JF. Parathyroid hormone (PTH) and hematopoiesis: new support for some old observations[J]. J Cell Biochem, 2005, 96 : 278–284. DOI:10.1002/(ISSN)1097-4644 |
| [18] | Yu EW, Kumbhani R, Siwila-Sackman E, et al. Teriparatide (PTH 1-34) treatment increases peripheral hematopoietic stem cells in postmenopausal women[J]. J Bone Miner Res, 2014, 29 : 1380–1386. DOI:10.1002/jbmr.2171 |
| [19] | Kook SH, Yun CY, Sim HJ, et al. Smad4 in osteoblasts exerts a differential impact on HSC fate depending on osteoblast maturation stage[J]. Leukemia, 2016, [Epud abead of print]. |
| (收稿日期:2016-07-13) |

