2. 100190 北京, 中国科学院理化技术研究所光化学转换与功能材料重点实验室
2. Key Laboratory of Photochemical Conversion and Optoelectronic Materials, Technical Institute of Physics and Chemistry, Chinese Academy of Science, Beijing 100190, China
全世界骨质疏松的发病率在慢性疾病中已升至第7位,患病人数超过2亿,我国患病人数已达9 000万。由于骨质疏松性骨折而导致的慢性疼痛,残疾甚至死亡,严重影响患者的生活质量,给患者家庭和社会带来了沉重的负担[1]。
胶原肽(collagen peptides,CP)是胶原或明胶经蛋白酶降解产物,富含人体所需的甘氨酸、脯氨酸、羟脯氨酸等,具有较高的消化吸收性及安全性。目前,CP作为口服补充剂在恢复骨关节方面的应用已受到越来越多的关注[2]。人体口服试验表明,每天摄入10 g CP可有效缓解关节疼痛及关节功能恶化的风险[3]。对于骨质疏松症患者而言,降钙素加CP比单独使用降钙素更能抑制骨胶原蛋白的分解[4]。Nomura等[5]发现CP可以抑制去卵巢大鼠的骨丢失。钙是防治骨质疏松最广泛应用的骨骼健康补充剂,然而目前普遍的用药方式通常是只服用CP或钙制剂其中的一种,而CP与钙制剂单独或联合服用,对骨质疏松患者骨丢失的预防或治疗效果的研究尚未见报道。本研究将SD大鼠去卵巢后分为预防组(术后2周开始灌胃,1次/d,连续3个月)及治疗组(术后3个月开始灌胃,1次/d,连续3个月),将CP与柠檬酸钙(calcium citrate,CC)单独或联合分别给预防组及治疗组SD大鼠灌胃,应用血清生化指标,股骨骨密度(bone mineral density,BMD)及生物力学指标评价CP与CC单独或联合服用去卵巢大鼠预防或治疗效果,以为绝经后骨质疏松的防治提供理论依据。
材料和方法 材料牛骨CP由中国包头东宝生物技术股份有限公司提供,CC购自中国江苏连云港东泰食品配料有限公司。
方法80只12周龄雌性SD大鼠,体质量为(300±20)g,从北京大学医学部动物实验中心购买,实验动物许可证号:SCXK(京)2011-0012。提前1周驯化满足实验条件。饲养在温度为21~25 ℃房间,湿度为50%~60%,昼夜交替的SPF级动物实验室内,给予大鼠常规饮食,可自由饮用洁净水。
将SD大鼠分成10组,每组8只。手术前,先用水合氯醛(4 mL/kg)对大鼠进行麻醉,其中8组进行2侧卵巢切除手术,剩余2组在相同部位去除少量脂肪作为假手术组(Sham)。大鼠根据体质量分为预防(术后2周开始灌胃,每天1次,连续3个月)及治疗(术后3个月开始灌胃,1次/d,连续3个月)2种给药方案,每种给药方案分为以下5组(n=8):假手术组(Sham),去卵巢组 (ovariectomy,OVX),去卵巢大鼠服用CP(750 mg/kg),去卵巢大鼠服用CP(750 mg/kg)和CC(75 mg/kg),去卵巢大鼠服用CC(75 mg/kg),上述药物用双蒸水配制,每只每次注射1 mL。给药末期,大鼠空腹12 h,水合氯醛对大鼠进行麻醉后,腹主动脉采集血液样本,分离血清。然后将大鼠解剖,剔除肌肉和筋膜,取大鼠右股骨用盐水覆盖的纱布包埋,-20 ℃保存。
血清碱性磷酸酶含量检测:采用全自动生化分析仪(Model 7060; Hitachi,Tokyo,Japan)检测血清碱性磷酸酶(alkaline phosphatase,ALP)含量。
血清骨钙素含量检测:血清骨钙素(osteocalcin,OC)含量按OC放射免疫分析操作说明检测(北京北方生物技术研究所),批内CV<10%,批间CV<15%。
股骨BMD分析:右股骨BMD的检测采用美国通用公司的Lunar PIXImus BMD测量仪,配制以适合的软件用于实验室小动物的BMD评估。测量时,由同一操作者测量并将所有小鼠置于同一方向。
股骨生物力学检测:实验前先用游标卡尺测量股骨的长度和宽度,然后使用美国Brookfield公司的Texturepro CT V1.3 Build 14仪器采用三点弯曲力学试验方法分析股骨生物力学。实验时股骨放在水平架上,与圆边距离约20 mm。注意确保所有标本以完全相同的方式放置,尽可能减少误差,然后分别记录断裂强度、形变量及能量吸收。
统计学方法采用SPSS17.0 统计软件分析,数据处理均用均值±标准差($\bar x \pm s$)表示,数据经正态性检验和方差齐性检验,方差齐性采用单因素方差分析最小显著差法(LSD)组间比较,方差不齐性采用Dunnetts T3 方法进行组间比较,以P<0.05为差异有统计学意义。
结果 动物体质量变化CP与CC对去卵巢大鼠骨丢失预防及治疗的效果通过骨质疏松模型大鼠进行验证。在研究起始阶段,OVX大鼠和Sham大鼠体质量并没有明显不同,去卵巢3或6个月后,OVX大鼠体质量与Sham大鼠相比显著升高(P=0.000),但去卵巢大鼠之间比较,体质量差异无统计学意义(P>0.05)(图 1)。
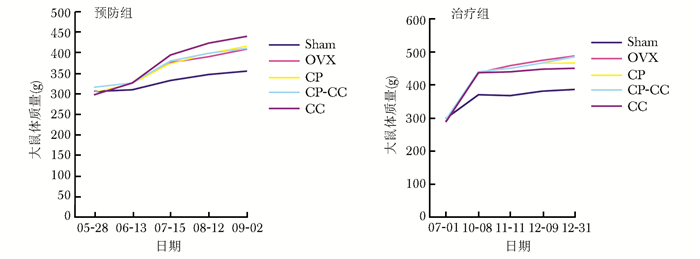
|
| 图 1 大鼠体质量变化曲线 Fig 1 Change curves of body weight of the rats Sham:假手术组;OVX:去卵巢组; CP:去卵巢大鼠服用750 mg/kg 胶原肽组;CP-CC:去卵巢大鼠服用CP 750 mg/kg和CC 75 mg/kg组;CC:去卵巢大鼠服用CC 75 mg/kg组 |
预防组,OVX大鼠血清ALP、OC含量显著高于Sham大鼠(P=0.000,P=0.040);与OVX大鼠相比,CP处理后OVX大鼠血清ALP含量显著降低(P=0.020,P=0.000),而CP-CC与 CC处理后,ALP含量差异有统计学意义(P=0.000);但上述各处理方式对OC含量没有显著变化(表 1)。
| ($\bar x \pm s$) | |||||
| 组别 | n | 预防组 | 治疗组 | ||
| ALP(U/L) | OC(ng/mL) | ALP(U/L) | OC(ng/mL) | ||
| 与OVX组比校,*P<0.05,**P<0.01;Sham:假手术组;OVX:去卵巢组; CP:去卵巢大鼠服用CP 750 mg/kg 胶原肽组;CP-CC:去卵巢大鼠服用CP 750 mg/kg和CC 75 mg/kg组;CC:去卵巢大鼠服用CC 75 mg/kg组 | |||||
| Sham | 8 | 69.83±15.83* | 1.44±0.39* | 31.80±7.79* | 1.75±0.52* |
| OVX | 8 | 115.40±28.00 | 1.94±0.35 | 69.80±15.30 | 2.53±0.52 |
| CP | 8 | 79.13±32.28* | 1.67±0.4 | 61.33±15.63* | 2.18±0.4 |
| CP-CC | 8 | 74.89±18.31** | 2.18±0.46 | 51.33±5.96* | 2.28±0.33 |
| CC | 8 | 75.00±24.54** | 1.85±0.47 | 65.14±7.10 | 1.92±0.44* |
治疗组OVX大鼠血清ALP、OC含量显著高于Sham大鼠(P=0.030,P=0.010),呈现出与预防组相同的变化趋势。CP或CP-CC处理后,OVX大鼠血清ALP含量显著降低(P=0.030,P=0.000)。此外,CC处理对 OVX大鼠血清ALP含量没有显著影响,但却使OC含量显著降低(P=0.020)(表 1)。
股骨BMD变化预防组OVX大鼠股骨BMD与Sham大鼠相比显著降低(P=0.000)。CP-CC或CC处理后,显著抑制OVX大鼠股骨BMD的降低(P=0.050,P=0.040),但单独服用CP对OVX大鼠股骨BMD没有明显影响(P=0.200)。
治疗组OVX大鼠股骨BMD与Sham大鼠相比显著降低(P=0.000)。CP或CP-CC处理后,显著抑制OVX大鼠股骨BMD的降低(P=0.020,P=0.040),单独服用CC却对治疗组没有显著影响(图 2)。
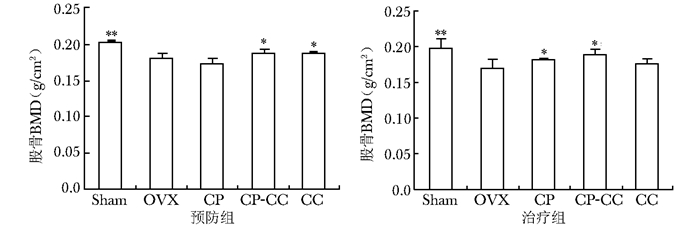
|
| 图 2 股骨BMD Fig 2 Femoral BMD 与OVX组相比*P<0.05,**P<0.01;Sham:假手术组;OVX:去卵巢组; CP:去卵巢大鼠服用CP 750 mg/kg组;CP-CC:去卵巢大鼠服用CP 750 mg/kg和CC 75 mg/kg组;CC:去卵巢大鼠服用CC 75 mg/kg组;BMD:骨密度;每组n=8 |
预防组OVX大鼠股骨断裂强度与Sham大鼠相比均有降低趋势,但各组形变量与能量吸收差异没有统计学意义(P>0.05)。与OVX组大鼠相比,服用CP或CP-CC后对预防组OVX大鼠股骨断裂强度降低有抑制趋势,服用CC后大鼠股骨断裂强度差异有统计学意义(P=0.000)。
治疗组OVX大鼠股骨断裂强度形变量与能量吸收呈现出与预防组相同的变化趋势,服用CP-CC后对显著降低OVX大鼠股骨断裂强度(P=0.040),服用CP或CC后对OVX大鼠股骨断裂强度降低有抑制趋势,但差异无统计学意义(P>0.05)(表 2)。
| ($\bar x \pm s$) | |||||||
| 组别 | n | 预防组 | 治疗组 | ||||
| 断裂强度(N) | 形变量(mm) | 能量吸收(mJ) | 断裂强度(N) | 形变量(mm) | 能量吸收(mJ) | ||
| 与OVX组比校,*P<0.05,** P<0.01;Sham:假手术组;OVX:去卵巢组; CP:去卵巢大鼠服用CP 750 mg/kg组;CP-CC:去卵巢大鼠服用CP 750 mg/kg和CC 75 mg/kg组;CC:去卵巢大鼠服用CC 75 mg/kg组 | |||||||
| Sham | 8 | 163.51±14.49 | 0.66±0.11 | 94.5±17.68 | 161.14±30.10 | 0.74±0.20 | 54±17.13 |
| OVX | 8 | 153.22±17.38 | 0.66±0.15 | 94.65±10.01 | 148.6±8.02 | 0.74±0.21 | 52.8±11.79 |
| CP | 8 | 171.13±19.90 | 0.71±0.07 | 98.18±9.16 | 154.45±22.7 | 0.86±0.23 | 55.13±19.09 |
| CP-CC | 8 | 164.29±13.54 | 0.66±0.11 | 94.5±25.44 | 169.04± 12.82* | 0.80±0.16 | 60.32±6.24 |
| CC | 8 | 184.63±6.80* | 0.71±0.16 | 103.3±11.52 | 152.31± 7.19 | 0.82±0.12 | 57.06±9.12 |
CP作为潜在的可阻止骨质流失的口服补充剂,主要通过刺激骨形成防止骨质流失[6]。钙是骨矿化的底物,由于钙摄入增加可抑制PTH的分泌,所以对骨有抗吸收作用,而补充CC则主要预防钙盐的流失[7]。在本研究中CP剂量为750 mg/kg,相当于CP的商业用量每人10 g/d[8];CC剂量为75 mg/kg,相当于骨质疏松患者补钙用量每人800~1 000 mg/d。本研究将去卵巢大鼠分为预防组及治疗组,尽管2组动物基线数据不同,动物处死时年龄不同,但是2组动物的给药方式,给药剂量及给药持续时间是相同的,而且预防组及治疗组给药前初始体质量没有显著变化,因此在临床上可以分别模拟妇女绝经早期和晚期后导致的骨质疏松。绝经早期妇女过量的骨丢失通常是由于雌激素缺乏而导致破骨细胞介导的过量的骨吸收所致;绝经晚期妇女,破骨细胞活性受抑制及骨形成不足对骨质疏松的进展起主要作用,这为刺激骨形成疗法提供了依据[9]。
骨形成标志物是成骨细胞在其不同发育阶段的直接或间接的表达产物,反映成骨细胞功能和骨形成状况,主要包括血清ALP、OC等[10, 11]。本研究结果表明,OVX大鼠血清ALP、 OC含量与Sham大鼠相比显著升高,提示骨形成增加,骨代谢加强。CP无论单独或与CC联合服用均能显著抑制OVX大鼠增加的ALP含量,单独服用CP尽管对OVX大鼠增加的OC含量没有显著的抑制效应,但仍表现出下降的趋势,表明CP对去卵巢大鼠骨代谢加强具有抑制效应。而单独服用CC能显著预防组抑制OVX大鼠增加的血清ALP及治疗组中OC含量,却对治疗组中OVX大鼠增加的ALP含量没有显著的抑制效应,可能与钙剂治疗对骨量的短期(1 年)和长期(2年及以上有关)效应有关。据报道,钙剂在治疗的前6~12个月,可降低骨再形成速率,但在治疗后的第2年及随后几年并没有发现有统计学意义的有利作用[11]。CP-CC联合服用对OVX大鼠OC含量没有显著影响,可能因为放射免疫法抗体识别的主要是血清OC的羧基端,由于OC在血中呈现全段分子和不同片段共存的非均一性导致血清OC含量并不能反映真实情况,目前应用单克隆抗体能同时测血中全段OC和N端及中间大片段,可明显提高实验的准确性、稳定性[12]。但本研究结果是否与实验方法有关还有望在今后的研究中利用单克隆抗体加以验证。
OVX大鼠股骨BMD与Sham大鼠相比降低(P<0.05),表明骨质疏松的骨量丢失与雌激素缺乏有密切的关系,治疗组中CP-CC与单独服用CP或CC相比对阻止去卵巢大鼠BMD的减小具有显著的改善效果,因此对治疗绝经后骨质疏松妇女的骨丢失具有重要的指导意义。单独服用CP能显著抑制治疗组OVX大鼠股骨BMD的降低,进一步验证了之前的报道:水解猪皮胶原蛋白(相对分子质量<3 000)可以阻止大鼠因去卵巢导致的骨质流失,能够改善腰椎的微观结构[6]。然而,单独服用CP对预防组OVX大鼠股骨BMD的降低没有显著抑制效应,可能由于生长期大鼠卵巢切除术后发生的松质骨丢失,大部分是由于钙化软骨的吸收增加所致的钙流失所致。在卵巢切除术后,破骨细胞数量增加,尽管骨形成保持不变或增加,但骨吸收净增加超过骨形成。但是在此期间口服补充CC由于其显著增加OVX大鼠BMD(P<0.05),无疑是一种具有前景的替代方案。
骨生物力学特性检测是评价骨质量不可缺少的指标,骨断裂强度直接反映骨的结构与骨强度、硬度之间的关系[13, 14, 15]。通过生物力学实验结果表明服用CP-CC后对治疗组OVX大鼠股骨断裂强度显著增加,服用CC能显著增加预防组OVX大鼠股骨断裂强度,进一步证明补钙可用于绝经早期妇女骨质疏松的预防,而补CP-CC可用于绝经早期或晚期妇女骨质疏松的预防和治疗。此外,实验组各组间形变量与能量吸收差异无统计学意义(P>0.05),表明小鼠卵巢切除后骨抵抗破坏和变形的能力均没有显著变化,这是否与不同的仪器设备或操作有关,需在今后实验中进一步研究。
| [1] | Chen H,Zhou X,Fujita H,et al. Age-related changes in trabecular and cortical bone microstructure[J]. Int J Endocrinol,2013,2013:213-234. |
| [2] | Kawaguchi T,Nanbu PN,Kurokawa M. Distribution of prolylhydroxyproline and its metabolites after oral administration in rats[J]. Biol Pharm Bull,2012,35: 422-427. |
| [3] | Clark KL,Sebastianelli W,Flechsenhar KR,et al. 24-Week study on the use of collagen hydrolysate as a dietary supplement in athletes with activity-related joint pain[J]. Curr Med Res Opin,2008,24: 1485-1496. |
| [4] | Adam M,Spacek P,Hulejová H,et al. Postmenopausal osteoporosis. Treatment with calcitonin and a diet rich in collagen proteins[J]. CCs Lek Cesk,1996,135: 74-78. |
| [5] | Nomura Y,Oohashi K,Watanabe M,et al. Increase in bone mineral density through oral administration of shark gelatin to ovariectomized rats[J]. Nutrition,2005,21: 1120-1126. |
| [6] | Kim HK,Kim MG,Leem KH. Osteogenic activity of collagen peptide via ERK/MAPK pathway mediated boosting of collagen synthesis and its therapeutic efficacy in osteoporotic bone by back-scattered electron imaging and microarchitecture analysis[J]. Molecules,2013,18: 15474-15489. |
| [7] | NIH. Consensus conference: optimal calcium intake[J]. JAMA,1994,272:1942-1948. |
| [8] | Bello AE,Oesser S. Collagen hydrolysate for the treatment of osteoarthritis and other joint disorders: a review of the literature[J]. Curr Med Res Opin,2006,22: 2221-2232. |
| [9] | Liu ZH. Bone mineral and clinic[M]. Beijing: Chinese Science and Technology Press,2006:641. |
| [10] | Singer FR,Eyre DR. Using biochemical markers of bone turnover in clinical practice[J]. Clevel Clin J Med,2008, 5: 739-750. |
| [11] | Elders PJM,Netelenbos JC,Lips P, et al.Calcium supplementation reduces vertebral bone loss in perimen-opausal women: a controlled trial in 248 women etween 46 and 55 years of age[J]. J Clin Endocrinol Metab,1991,73: 533-540. |
| [12] | Delmas PD,Eastell R,Garnero P,et al. The use of biochemical markers of bone turnover in oseoporosis[J]. Osteoporos Int,2000,Suppl: S2-S17. |
| [13] | Miskey JR. Osteoporosis and bone function adaption: mechanobiological regulation of bone architecture in growing and adult bone,a review[J]. J Rehabil Res Dev,2000,37: 189-199. |
| [14] | Cui W,Liu CL. Basic bone biomechanics (Ⅰ) [J]. Chin J Osteop,1997,3:82-85. |
| [15] | Chu YM,Jiang BQ,Zhang DY,et al.Effect of bone mass,microarchitecture and impact direction on biomechanical properties of bone in ovariectomy-induced osterporotic rats[J]. Chin J Osteop,2007,13:651-665. |
| (收稿日期:2015-05-15) |

