Kozlowski型脊柱干骺端发育不良(Kozlowski type Spondylmetaphyseal dysplasia,SMDK)是一种以脊柱侧弯、扁平状椎体和干骺端发育异常为特征的罕见遗传性骨病,其遗传方式为常染色体显性遗传。SMDK童年时期起病,婴儿期多表现正常,及早发现和治疗对于改善预后及开展遗传干预有重要意义。
本文通过对1例Kozlowski型脊柱干骺端发育不良家系进行致病基因鉴定和临床表现分析,同时对相关文献进行复习,探讨SMDK患者典型的临床表现、基因型和表型的关系及其发病机制,旨在提高临床医生对此类罕见遗传性骨代谢病的认识。
对象与方法 对象本研究对象经上海交通大学附属第六人民医院伦理委员会批准,参与研究的全部家系成员均签署知情同意书。
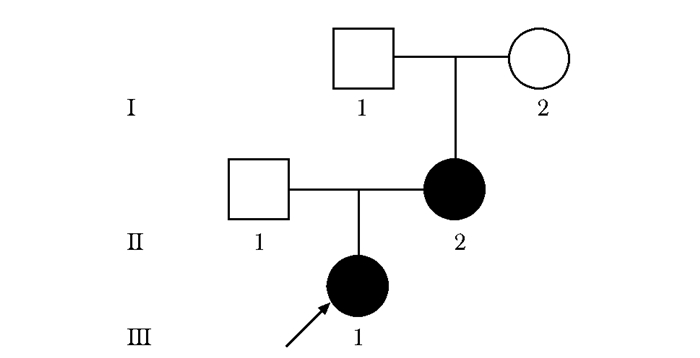
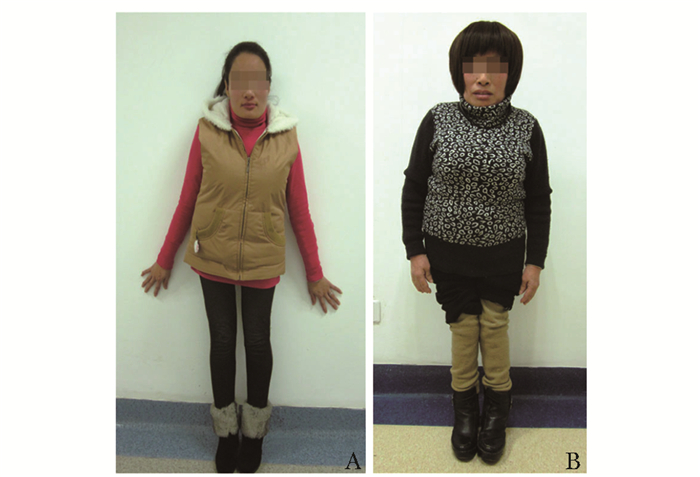
先证者为24岁的女性(图 1,Ⅲ-1),父母非近亲婚配,其为第一胎,足月剖腹产,出生时身高体质量与同龄儿相当。7岁时出现脊柱侧弯。患者因双膝关节畸形伴有脊柱侧弯10余年来上海交通大学附属第六人民医院就诊。查体:身高135 cm,体质量55 kg,脊柱明显侧弯。髋关节内翻畸形,膝关节外翻畸形,呈X型腿并伴有手指粗短(图 2)。听力、视力和智力正常。患者母亲52岁(图 1,Ⅱ-2),身高140 cm,体质量50 kg。患者母亲自幼身高较同龄人矮小。因先证者正处于妊娠期,故未对其进行X线检测,仅对其母亲进行了双手、骨盆、双侧股骨、胸腰椎正侧位X线检查。
|
| 图 1 SMDK患者家系图 Figure 1 Pedigree of the family with SMDK SMDK:Kozlowski型脊柱干骺端发育不良 |
|
| 图 2 先证者及其母亲的照片 Figure 2 Photograph of the proband and her mother A:先证者;B.先证者母亲 |
外周血基因组DNA提取:患者签署知情同意书后,采集患者和100名正常人外周血2 mL,用EDTA二钠抗凝。采用全血DNA提取试剂盒(上海莱枫生物科技公司试剂盒)提取血样本DNA。用分光光度仪检测DNA浓度。
PCR扩增及突变检测:从在线数据库(GenBank accession NC_000012)中获得瞬时感受器电位离子通道亚家族蛋白4编码基因(transient rece-ptor potentialcation channel subfamily V member4,TRPV4)的DNA序列。利用之前报道的引物PCR扩增TRPV4基因的16个外显子(包括外显子内含子交界区)[1]。所有引物均由上海Invitrogene公司合成(表 1)。采用PCR反应试剂盒(美国Promega公司)进行外显子扩增。反应体系为2×Go Taq Master Mix 12.5 μL,上下游引物(10 μmol/L)各0.5 μL,超纯水10.5 μL,DNA样本1 μL。PCR反应条件为:预变性94 ℃ 5 min,变性94 ℃ 30 s,退火57~64.5 ℃(根据不同引物调整),72 ℃延伸1 min,34个循环,最后终端延伸72 ℃10 min。PCR反应产物经电泳鉴定特异性后,送上海天昊公司进行Sanger测序分析。
| 外显子 | 引物 | 序列(5′→3′) | 退火温度(℃) |
| 1 | 正向 | CGCCTCGGAGGAAATTGTCTGCTG | 62 |
| 反向 | GGGAGATCCGCGCTTCCTGAATcc | ||
| 2 | 正向 | CGCGCGGCTGGAACCTGA | 62.3 |
| 反向 | CGGACGGGCCACGGAGATGT | ||
| 3 | 正向 | CACGTGGGAGGGGGCTTCCTG | 62.7 |
| 反向 | GAGGGGTGGATGATGAATGGGTGA | ||
| 4 | 正向 | TGGGTCCCTAAGGCCAGGGACAG | 61.9 |
| 反向 | CCAATGCAGTCCACCGACCCAAA | ||
| 5 | 正向 | GCCAGGACATCTGACCCCCTACCC | 58.7 |
| 反向 | TGCTGGCACTTAGGCCCAGATCA | ||
| 6 | 正向 | ACCCCCACCCCCAGCAAGC | 61.8 |
| 反向 | TCAGGGCTGCAGACACCAACCA | ||
| 7 | 正向 | CCTCAGAGCGCCACGGTGTCC | 58.4 |
| 反向 | GGGGTTGGCATGTTGGGAGGTG | ||
| 8 | 正向 | TCTGGGGAGGCGTCATGTGCTG | 59.2 |
| 反向 | TGGGTCCTAGAGGCTGGGGCTGT | ||
| 9 | 正向 | GAGAAAGCGCTGTCCGGGTGGA | 60.7 |
| 反向 | GAGGTTGTGCCCCAGTCCTGCAT | ||
| 10 | 正向 | GAGCTGGGAGGAGGAAGACTC | 62.4 |
| 反向 | GTGGCTTTGTCCTGACTTTGG | ||
| 11 | 正向 | GGCTTGGAGGCGTGTCTTC | 57.3 |
| 反向 | GGCTGCTATTGTCCCCTATACATC | ||
| 12 | 正向 | CTAGCTTTCTCCTCCAGCAA | 57.4 |
| 反向 | TAGGCAGCTCTGGGAAGTCAG | ||
| 13 | 正向 | CGTTGTCTCATTTCTGCCACCAGAGC | 62.3 |
| 反向 | CAATGGGTAGACGACGCTGGAGCA | ||
| 14 | 正向 | GGGGTTCCCCATGACCCTCTGC | 64.5 |
| 反向 | CCCGGAAAGAAGCAGGACTGCTCAA | ||
| 15 | 正向 | CCCCCACCCCTCCCTCTGATGT | 61.7 |
| 反向 | AGGTGGAGGGGCTCTGGCGTTG | ||
| 16 | 正向 | CCAGAGGCGAGGGACCAGTGGA | 62.7 |
| 反向 | GCCTCCCGGTCAGGACTTCTGC |
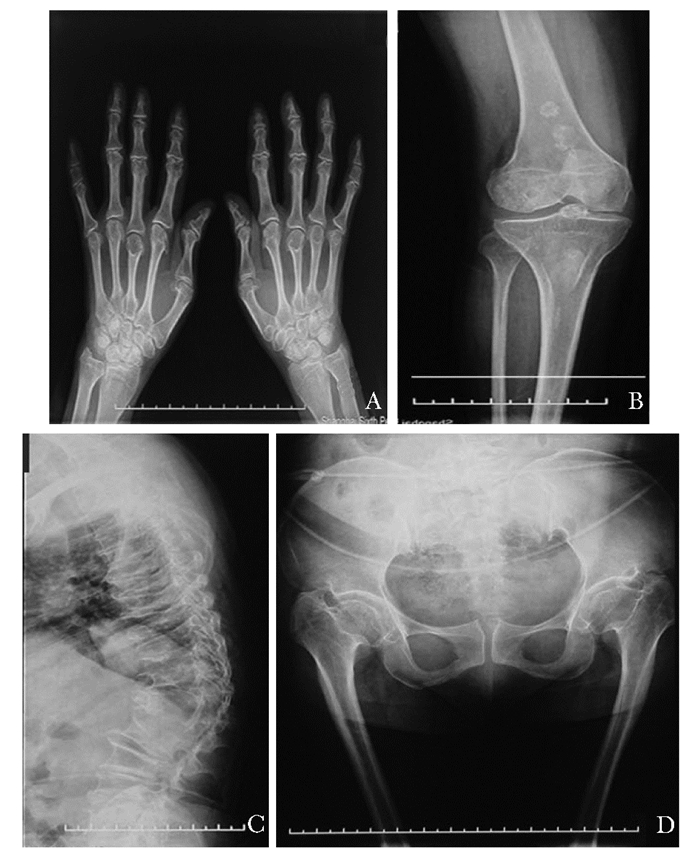
先证者母亲双手掌骨近端变尖,指骨干骺端增宽,指掌骨明显变粗短,两侧尺桡骨未见明显异常(图 3A);双侧股骨干骺端增宽,结构紊乱,密度增高,其内内有不规则条索状及团块状高密度影,且右侧胫骨平台中央成刺状突出,关节间隙未见缩窄(图 3B);胸椎诸椎体变扁同时间隙增宽,椎弓根变长。侧位片呈现椎体变扁,椎体前缘呈楔形改变(图 3C);髋臼畸形顶扁平、双侧髂骨周边呈现不规则形态,双侧近端股骨呈现矛状(图 3D)。
|
| 图 3 SMDK X线表现 Figure 3 Radiology manifestations of patient diagnosed with SMDK A.双手掌骨近端变尖,指骨干骺端增宽,指掌骨明显变粗短; B.双侧股骨增宽的干骺端; C.胸椎侧位片呈现扁平的胸椎; D.髋臼顶扁平,双侧髂骨周边呈现不规则形态,双侧近端股骨呈现矛状; SMDK:Kozlowski型脊柱干骺端发育不良 |
先证者与其母亲的N端骨钙素,Ⅰ型胶原交联羧基末端肽降解产物(β-cross linked C-telope-ptide of type Ⅰ collagen,β-CTX)均升高,25羟维生素D(25 hydroxyvitamin D, 25OHD)水平低,血钙及血磷正常(表 2)。
| 血清生化指标 | OC(μg/L) | β-CTX(ng/L) | 25OHD(μg/L) | Ca(μg/L) | P(μg/L) |
| 正常范围 | 4.91~22.31 | 绝经前<573,绝经后<1 008 | >20 | 2.25~2.75 | 0.81~1.45 |
| 先证者 | 27.1 | 547 | 17.34 | 2.26 | 1.28 |
| 先证者母亲 | 28.3 | 614 | 18.36 | 2.23 | 1.25 |
| OC:骨钙素;β-CTX:Ⅰ型胶原交联C-末端肽;25OHD:25羟维生素D; Ca:血钙;P:血磷 | |||||
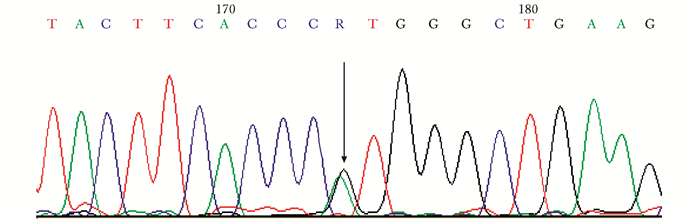
先证者及其母亲的TRPV4基因存在相同的杂合突变位点,先证者11号外显子发生错义突变(c.1781G>A)(图 4),所编码蛋白质第594位氨基酸由精氨酸变为组氨酸(p.Arg594His)。在其家系的其余成员及100名健康对照人群中均未发现有此突变。
|
| 图 4 TRPV4基因11号外显子1781位G发生错义突变 Figure 4 Genetic analysis showing the missense mutation(c.1781G > A)of TRPV4 gene TRPV4:瞬时感受器电位离子通道亚家族蛋白4 |
目前认为SMDK是由包括COL2A1基因和TRPV4基因在内的多种基因突变导致的。同时亦有1例GPX4基因突变导致SMDK的报道[2]。Ⅱ型胶原纤维α1基因(collagen 2A1,COL2A1),COL2A1基因编码产物为Ⅱ型胶原蛋白[3]。COL2A1基因突变会导致Ⅱ型胶原纤维结构发生改变,或引起维系胶原蛋白的三级结构稳定性的一些因素(如偶极子-偶极子相互作用和范德华力相互作用)改变从而致使胶原分子降解加快[4],而这些异常均会引发疾病。一般将此基因突变导致的一系列疾病统称为Ⅱ型胶原病,临床常见病种主要有两大类:骨骼-软骨发育不良和骨关节炎疾病。前者包括Kniest发育不良、Ⅱ型软骨成长不全(achondrogenesis type 2,ACG2)、软骨形成不足(hypochondrogenesis,HCG)、脊柱干骺端发育不良(spondylometaphyseal dysplasia,SMD)以及临床表型较轻的先天性脊柱骨骺发育不良(spondyloepiphyseal dysplasia congenita,SEDC)和脊柱周围发育不良等[5-6]。骨关节疾病则相对较少,包括骨关节炎和双侧缺血性股骨头坏死等。2013年Matsubayashi等[7]报道了1例由COL2A1基因杂合突变所引起的SMD病例。而国内尚无COL2A1基因突变导致SMD的报道,而仅在2007年和2013年发现两例此基因突变导致的SEDC的病例报道,1例为COL2A1基因的23号外显子(C.1510 G>A)错义突变[8],1例为COL2A1基因42号外显子(c.2735G>A)错义突变[9]。因此,若在临床上遇见类似病例,应考虑COL2A1基因突变的可能性。
TRPV4是香草素受体渗透压感受通道(vanilloid receptor related osmotically activated channel)成员[10]。是一种非选择性阳离子通道,对钙离子具有适中的通透性[11-12]。TRPV4基因有6个跨膜区(T1~T6)和位于T5和T6之前的襻环结构,通道的氨基酸存在3~4个锚连蛋白重复区(ankyrin repeat domain, ANK)。可被生物体内外环境中机械力、热和低渗透压等各种理化刺激所激活,参与机体内环境稳态的维持,同时也对生长发育起重要作用[13]。在骨骼发育领域,TRVP4基因目前已被证实与包括短躯干症3型(barchyolmia type 3)、SMDK、类扭伤型侏儒(parastremmatic dwarfism)、脊柱骨骺发育不良(spondylepiphseal dysplasia maroteaux type,SED)和变形性骨发育不良(metatropicdysplasia,MD)等多种骨骼疾病相关[14]。2009年研究报道了6例TRPV4基因突变所致的SMDK,共报道了3个新发突变位点,其中4例为11号外显子错义突变(c.1781G>A,p.R594H)、1例为6号外显子错义突变(c.A992>G,p.D333G)、1例为13号外显子错义突变(c.2146G>T,p.A716S)[15]。本研究先证者同样是11号外显子(c.1781G>A,p.R594H)突变携带者,由此为确诊SMDK提供了依据。同时该研究在4例相同突变位点(c.1718G>A)的患者中,脊柱侧弯程度、关节的挛缩程度和骨盆形态等临床表型却迥然不同,其中某些患者的表型与MD颇为相似[15]。由此可见,SMDK是一种有遗传异质性的疾病。本文先证者所携带的(c.1781G>A,p.R594H)突变位点位于TRPV4基因的跨膜区,594号精氨酸被证实在TRPV家族内高度保守并且被证实对化学信号刺激(钙离子浓度)的检测和传导非常重要。而运用携带突变位点质粒的重组细胞进行的体外电生理实验显示,无论是否给予此离子通道激动剂,细胞内钙离子内流均高度增加。由此推测,SMDK可能与持续性软骨细胞钙离子内流相关[14]。同时其他研究也显示TRPV4基因在成骨细胞及破骨细胞同时表达,而刺激TRPV4基因可以促进软骨生成,这或许是骨骼发育不良的另一个成因[15-16]。除了此报道之外,2010年Dal等[17]报道了SMDK患者第15号外显子(c.2389G>A,p.E797K)发生杂合突变,国内亦有1例15号外显子(c.2389G>A,p.E797K)突变所致的SMDK的报道[18]。
SMDK的诊断应结合患者的临床症状、X线表现及致病基因突变检测。在临床上,患者可表现为生长发育迟缓、躯干短小、脊柱进行性弯曲畸形,但血液生化指标一般无明显异常,放射学检查可表现为脊柱侧位片上呈现胸椎诸椎体变扁,同时伴有上下椎体间隙增宽。而在脊柱正位片上呈现楔形椎弓根变长。骨盆平片可表现为髋臼顶较为扁平,而双侧近端股骨呈现凹凸不平的矛状。根据Nemec等[19]研究,幼年患者除上文描述的扁平状髋臼顶外,骨盆正位X线有如下特点:髋臼和股骨骨骺间距较同龄儿增宽,同时伴有腕骨骨化延迟。而随着年龄的增加,患者股骨近端干骺端和骨骺的生长板面出现硬化,骨骺生长板较同龄人加宽。
结合文献复习分析本病例有以下特点:(1)患者躯干短小、脊柱侧弯、X线提示扁平状椎体等典型临床特征;(2)鉴定明确先证者TRPV4基因携带突变位点是已经在研究报道中发现的热点突变[14],并且体外研究已证实此热点突变导致功能改变;(3)在正常人群中并未找到该突变。本例患者正是基于上述临床及致病突变鉴定而确诊为SMDK。
综上所述,本例患者为TRPV4基因错义突变(c.1781G>A,p.Arg594His)导致的SMDK,结合先证者和家系成员临床表现及基因测序结果,通过文献复习,总结了此疾病的临床表现和突变位点,证实突变的基因和临床表型在SMDK病中具有一定的相关性,有助于此类疾病的深入研究。
| [1] | Rock MJ, Prenen J, Funari VA, et al. Gain-of-function mutations in TRPV4 cause autosomal dominant brachyolmia[J]. Nat Genet, 2008, 40: 999–1003. DOI:10.1038/ng.166 |
| [2] | Smith AC, Mears AJ, Bunker R, et al. Mutations in the enzyme glutathione peroxidase 4 cause Sedaghatian-type spondylometaphyseal dysplasia[J]. J Med Genet, 2014, 51: 470. DOI:10.1136/jmedgenet-2013-102218 |
| [3] | Steplewski A, Ito H, Rucker E, et al. Position of single amino acid substitutions in the collagen triple helix determines their effect on structure of collagen fibrils[J]. J Struct Biol, 2004, 148: 326–337. DOI:10.1016/j.jsb.2004.07.006 |
| [4] | Kuivaniemi H, Tromp G, Prockop DJ. Mutations in fibrillar collagens (types Ⅰ, Ⅱ, Ⅲ, and Ⅺ), fibril-associated collagen (type Ⅸ), and network-forming collagen (type Ⅹ) cause a spectrum of diseases of bone, cartilage, and blood vessels[J]. Human Mutat, 1997, 9: 300. DOI:10.1002/(ISSN)1098-1004 |
| [5] | Lachman RS, Tiller GE, Jr G J, et al. Collagen, genes and the skeletal dysplasias on the edge of a new era:a review and update[J]. Eur J Radiol, 1992, 14: 1–10. DOI:10.1016/0720-048X(92)90052-B |
| [6] | Spranger J, Winterpacht A, Zabel B. The type Ⅱ collagenopathies:a spectrum of chondrodysplasias[J]. Eur J Pediatr, 1994, 153: 56–65. |
| [7] | Matsubayashi S, Ikema M, Ninomiya Y, et al. COL2A1 mutation in spondylometaphyseal dysplasia algerian type[J]. Mol Syndromol, 2013, 4: 148. |
| [8] | 崔英霞, 夏欣一, 王云华, 等. 先天性脊柱骨骺发育不良家系COL2A1基因的突变[J]. 医学研究生学报, 2007, 20: 467–470. DOI:10.3969/j.issn.1008-8199.2007.05.006 |
| [9] | 苏楠, 谢杨丽, 杨京, 等. 1例先天性脊柱骨骺发育不良患者COL2A1基因新突变[J]. 中华骨质疏松和骨矿盐疾病杂志, 2013, 6: 203–206. DOI:10.3969/j.issn.1674-2591.2013.03.003 |
| [10] | Plant TD, Strotmann R. TRPV4[J]. Handbook Exp Pharmacol, 2007, 86: 189. |
| [11] | Liedtke W, Choe Y, Martí-Renom MA, et al. Vanilloid receptor-related osmotically activated channel (VR-OAC), a candidate vertebrate osmoreceptor[J]. Cell, 2000, 103: 525–535. DOI:10.1016/S0092-8674(00)00143-4 |
| [12] | Strotmann R, Harteneck C, Nunnenmacher K, et al. OTRPC4, a nonselective cation channel that confers sensitivity to extracellularosmolarity[J]. Nat Cell Biol, 2000, 2: 695. DOI:10.1038/35036318 |
| [13] | Montell C, Birnbaumer L, Flockerzi V, et al. A unified nomenclature for the superfamily of TRP cation channels[J]. Mol Cell, 2002, 9: 229. DOI:10.1016/S1097-2765(02)00448-3 |
| [14] | Vriens D, Camacho J, Luong N, et al. Mutations in the gene encoding the calcium-permeable ion channel TRPV4 produce spondylometaphyseal dysplasia, Kozlowski type and metatropicdysplasia[J]. Am J Human Genet, 2009, 84: 307–315. DOI:10.1016/j.ajhg.2009.01.021 |
| [15] | Dai J, Cho TJ, Unger S, et al. TRPV4-pathy, a novel channelopathy affecting diverse systems[J]. J Human Genet, 2010, 55: 400–402. DOI:10.1038/jhg.2010.37 |
| [16] | Camacho N, Krakow D, Johnykutty S, et al. Domi-nant TRPV4 mutations innonlethal and lethal metat-ropic dysplasia[J]. Am J Med Genet Part A, 2010, 152A: 1167–1177. |
| [17] | Dai J, Kim OH, Cho TJ, et al. Novel and recurrent TRPV4 mutations and their association with distinct phenotypes within the TRPV4 dysplasia family[J]. J Medical Genet, 2010, 47: 704. DOI:10.1136/jmg.2009.075358 |
| [18] | 索磊, 栾佐. Kozlowski型脊椎干骺端发育不良1例报告[J]. 临床儿科杂志, 2015, 33: 576–578. DOI:10.3969/j.issn.1000-3606.2015.06.019 |
| [19] | Nemec SF, Cohn DH, Krakow D, et al. The importance of conventional adiography in the mutational analysis of skeletal dysplasias (the TRPV4 mutational family)[J]. Pediatr Radiol, 2012, 42: 15–23. DOI:10.1007/s00247-011-2229-6 |
| (收稿日期:2017-11-01) |

