骨质疏松症是一种以骨量降低、骨微结构破坏、骨脆性增加、骨折风险增加为特征的全身性骨骼疾病,随着人口老龄化,骨质疏松症已成为全球范围内的公众健康问题。目前可用于临床的评估骨质疏松的金标准为双能X线骨密度,但会受到骨质增生、压缩性骨折等的影响,故定量CT(quantitative CT,QCT)测量骨密度也被越来越多的使用;生化方面骨转换生化标志物的变化可用来反映骨吸收与骨形成的动态平衡状况,并且该变化早于骨密度的改变。骨质疏松的终点事件即为骨质疏松骨折,最易受累的部位为脊柱、股骨近端及桡骨远端。骨折直观评估为X线片以及CT、MRI等影像学检查,少见有效的生化标志物监测骨折的严重程度以及愈合情况。
骨转换生化标志物来自小梁骨和皮质骨的转换,它们反映了整个骨框架的代谢活动而不是单个细胞或矿化的过程。目前国内外可以通过生物化学检测技术获得的骨代谢指标可分为骨代谢调节激素、细胞与体液因子、骨吸收、骨形成标志物,目前临床上常用的稳定的骨吸收标志物为1型胶原交联羧基末端肽(C-terminal crosslinking telopeptides of type 1 collagen,CTX),稳定的骨形成标志物为1型前胶原氨基末端前肽(N-terminal propeptide of type 1 collage,P1NP)。本研究对骨质疏松性椎体骨折患者进行上述指标的检测,以期发现其变化规律,指导临床治疗方案的调整。
对象和方法 对象147例在北京积水潭医院骨科住院的老年椎体骨折患者,于2013年12月至2014年12月入院治疗,均为低能量造成的脆性骨折;多在术前完善了椎体MRI平扫+压脂像,监测指标包括血清钙、磷、25羟维生素D(25 hydroxy vitamin D,25OHD)、P1NP及CTX、QCT骨密度。上述指标均为患者保守治疗期间所得,未受椎体成形术等手术影响。排除标准:暴力骨折,曾接受双膦酸盐、活性维生素D、降钙素、雌激素和雌激素受体调节剂等影响骨代谢的药物治疗;继发性骨质疏松患者,包括甲状旁腺功能减退或亢进、库欣综合征、糖尿病患者;慢性肝病、慢性阻塞性肺疾病患者和血肌酐水平>177 mol/L的慢性肾病患者,血钙磷异常的患者;风湿或类风湿关节炎患者;近2年患胃溃疡、克罗恩病、节段性小肠炎和慢性痢疾等患者;非遗传性影响骨密度的神经或肌肉疾病患者;心脑疾病后遗症影响四肢活动者;所有恶性肿瘤患者;过早绝经(<40岁)者;患有皮肤疾病无法接受阳光照射者。
方法所有患者登记骨折时间以及标本采集、QCT检查时间;所有受试者晨起采集空腹血3 mL,血清经低温离心分离后置于-20 ℃保存,避免样品反复冻融。采用电化学发光免疫(Roche公司,COBAS)试剂盒定量测定血清P1NP、CTX、25OHD水平,灵敏度分别为<5 、<0.07和<3.00 μg/mL,批间变异系数和批内变异系数均<10%。
骨密度测定:所有受试者均于采血3 d左右应用腰椎定量CT(QCT,东芝Aquilion64排CT扫描机,美国Mindways公司的QCT骨密度测量系统)测定腰椎骨密度(除外骨折椎体)。
统计学方法应用SPSS 19统计学软件,计量资料以均数±标准差($\bar x \pm s$)表示,非正态资料以中位数(25%,75%)表示;均值比较采用t检验,非正态参数比较采用非参数检验;骨代谢标志物随骨折后时间改变的趋势以散点图表示,并进行相关性检验,以P<0.05为差异有统计学意义。
结果 一般情况147例老年骨折患者中,女性120例(79.4%),男性27例(20.6%),年龄52~90 岁,平均年龄(69.6±9.8) 岁;平均QCT值为67.6±28.5,T值为-3.8±1.0,Z值为-1.3(-1.9,-0.6);观察时间为骨折后1~84 d(1~12周)(表 1)。
| ($\bar x \pm s$) | |||||||||
| 例数 | 年龄 | BMI(kg/m2) | 钙(mmol/L) | 磷(mmol/L) | P1NP(μg/L) | CTX(μg/L) | 25OHD(μg/L) | QCT-T值 | |
| BMI:体质量指数;P1NP:1型原胶原氨基末端肽;CTX:1型胶原交联羧基末端肽;25OHD:25羟维生素D;QCT:定量CT;T值:患者与同性别和种族青年人的骨密度参考值比较 | |||||||||
| 男性 | 27 | 73.3±9.8 | 24.3±3.3 | 2.27±0.10 | 1.07±0.22 | 72.2±37.3 | 0.7±0.3 | 14.5±8.2 | -4.4±0.7 |
| 女性 | 120 | 68.8±9.6 | 23.6±3.7 | 2.34±0.12 | 1.18±0.16 | 66.1±37.1 | 0.7±0.4 | 14.9±7.1 | -4.0±1.1 |
| P | 0.031 | 0.440 | 0.002 | 0.032 | 0.447 | 0.901 | 0.803 | 0.280 | |
椎体骨折后,反应骨代谢合成的指标P1NP出现明显上升,P1NP在骨折后第2周即达高峰,升高幅度为基线值1.5~2.0倍,之后基本维持在该水平,至观察时间结束时亦未见明显下降。
ANOVA方差分析检验(Dunnett法)结果显示椎体骨折后第1周P1NP水平明显低于2、3、5、8、12周(P值分别为0.000、0.000、0.029、0.009、0.007)。第5周P1NP水平偏低,Anova方差分析检验(Hochberg法)结果显示第5周和第2、3、8、12周的P1NP水平差异无统计学意义(P值分别为1.000、0.999、1.000、1.000)(表 2)。
| 时间(周) | n | lnP1NP | P1NP(μg/L) |
| W:周;N:例数;P1NP:1型原胶原氨基末端肽;ln P1NP:P1NP取ln值 | |||
| 1 | 45 | 3.8±0.4 | 46.0(33.2,58.7) |
| 2 | 25 | 4.2±0.5 | 78.9(42.2,104.4) |
| 3 | 28 | 4.3±0.3 | 74.2(58.5,86.8) |
| 5 | 14 | 4.1±0.4 | 56.1(50.8,75.2) |
| 8 | 15 | 4.2±0.5 | 65.4(42.2,83.1) |
| 12 | 20 | 4.2±0.5 | 67.9(45.4,81.2) |
椎体骨折后,反应骨代谢破坏的指标CTX亦出现明显上升,CTX在骨折后第2周亦达高峰,升高幅度为基线值1.5~2.0 倍,之后在第3周出现明显下降。
ANOVA方差分析检验(Dunnett法),结果显示椎体骨折后第1周CTX水平明显低于第2周(P=0.000),但和第3、5、8、12周相比差异无统计学意义(P值分别为0.108、0.488、0.476、0.574)。
第2周CTX水平较3~12周较高,ANOVA方差分析检验(Hochberg法),结果显示第2周和第3、5、8、12周的CTX水平差异有统计学意义(P值分别为0.368、0.283、0.252、0.074)(表 3)。
| 时间(周) | n | lnCTX | CTX(μg/L) |
| W:周;CTX:1型胶原交联羧基末端肽;ln CTX:CTX取ln值 | |||
| 1 | 45 | -0.7±0.5 | 0.5(0.3,0.7) |
| 2 | 25 | -0.2±0.4 | 0.8(0.6,1.0) |
| 3 | 28 | -0.5±0.4 | 0.6(0.5,0.8) |
| 5 | 14 | -0.6±0.4 | 0.5(0.4,0.8) |
| 8 | 15 | -0.6±0.4 | 0.5(0.4,0.7) |
| 12 | 20 | -0.6±0.7 | 0.7(0.3,0.8) |
骨折后P1NP即开始上升,相关分析结果提示,椎体骨折后一周内P1NP上升与血磷、25OHD、患者年龄呈直线相关关系,而同QCT-T值并无明确相关性(图 1)。其中血磷越高,P1NP上升越高,呈正相关关系(r=0.420,P=0.004);25OHD水平越高,P1NP亦上升越高,呈负相关关系(r=0.319,P=0.035);患者年龄越大,P1NP上升水平越低,呈负相关关系(r=-0.313,P=0.036)。骨折后P1NP的变化与患者基线骨密度水平并无明确相关性(r=0.045,P=0.839)。
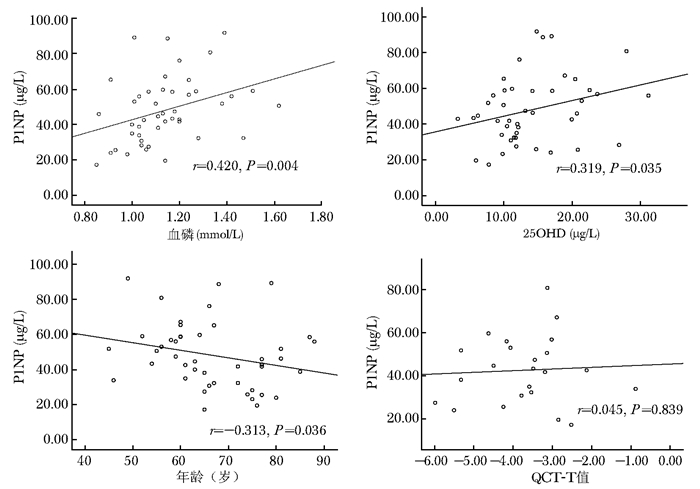
|
| 图 1 椎体骨折后1周内P1NP与血磷、25OHD、患者年龄、QCT-T值的相关性 Fig 1 Correlation of P1NP and serum phosphorus, 25 hydroxy vitamin D(25OHD), age, QCT-T value during the first week of healing of vertebral fracture P1NP:1型前胶原氨基末端肽;QCT:定量CT |
骨折后CTX开始上升,椎体骨折后1周内CTX上升幅度与血磷水平呈直线相关关系,而25OHD、患者年龄、QCT-T值均无明确直线相关关系(图 2)。其中血磷水平越高,CTX上升越高(r=0.495,P=0.001);骨折后CTX的变化与患者25OHD(r=0.285,P=0.061)、年龄(r=-0.079,P=0.607)、基线骨密度水平(r=0.055,P=0.804)并无明确相关。
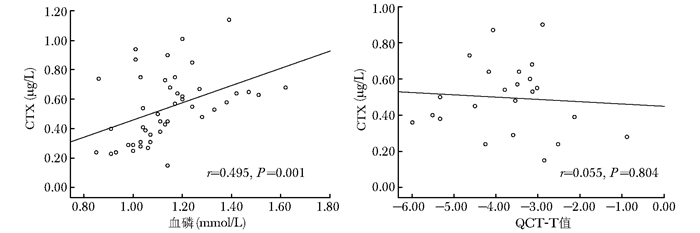
|
| 图 2 椎体骨折后1周内CTX和血磷、QCT-T值的相关性 Fig 2 Correlation of CTX and serum phosphorus, QCT-T value during the first week of healing of vertebral fracture CTX:1型胶原交联羧基末端肽;QCT:定量CT |
椎体骨折后P1NP和CTX均呈上升趋势,两者间呈直线相关关系(r=0.503,P=0.000)。
椎体骨折后P1NP与CTX和性别、BMI均无相关关系,其中P1NP与性别的相关系数r=-0.032,P=0.789;P1NP与BMI的相关系数r=0.082,P=0.604;CTX与性别的相关系数r=-0,038,P=0.805;CTX与BMI的相关系数r=-0.086,P=0.587(图 3)。
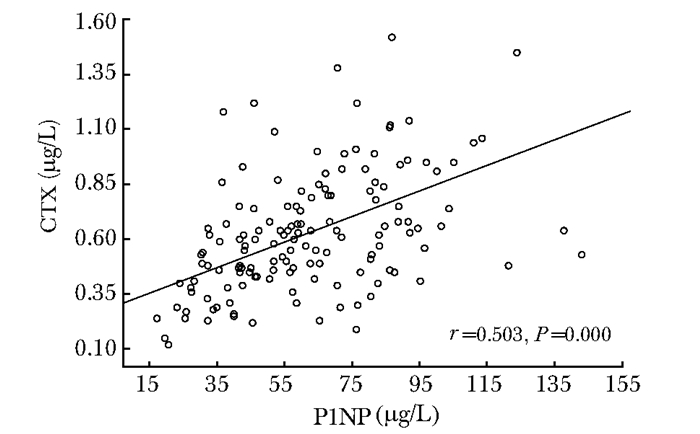
|
| 图 3 椎体骨折后1周内P1NP与CTX的相关性 Fig 3 Correlation of P1NP and CTX during the first week of healing of vertebral fracture P1NP:1型原胶原氨基末端肽;CTX:1型胶原交联羧基末端肽 |
所有椎体骨折患者中,女性年龄(68.8±9.6)岁与男性年龄(73.3±9.8)岁比较,女性发生椎体压缩性骨折的平均年龄低于男性(P=0.031)。女性平均血钙(2.34±0.12)mmol/L与男性(2.27±0.10)mmol/L比较,差异有统计学意义(P=0.002);女性平均血磷(1.18±0.16)mmol/L与男性(1.07±0.22)mmol/L比较,差异有统计学意义(P=0.032)(表 1)。
相关分析结果显示,患者年龄越高,血钙、磷水平越低,血钙与年龄的相关系数r=-0.251,P=0.002;血磷与年龄的相关系数r=-0.329,P=0.000。且随着患者年龄增高,QCT-T值呈降低的趋势(r=-0.404,P=0.001)(图 4)。年龄与25OHD、BMI无相关性(P值分别为0.871和0.515);血25OHD与血钙水平呈正相关关系(r=0.182,P=0.029);血钙与血磷呈成正相关关系(r=0.217,P=0.008)。
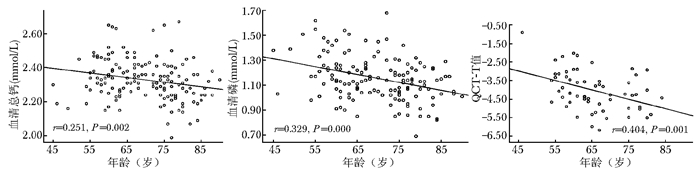
|
| 图 4 椎体骨折后年龄与血钙、磷、QCT-T变化趋势的相关性 Fig 4 Correlation of age and serum calcium, phosphorus, QCT-T during the healing process of vertebral fracture QCT:定量CT |
骨折愈合过程中,骨折断端的骨细胞、破损的骨膜和周围细胞发生坏死,破骨细胞清除残留死骨,成骨细胞形成新骨,二者紧密关联构成骨重建或称骨转换。骨代谢的生化指标可反映骨折愈合过程中的骨转换状态[1, 2, 3],其中P1NP为1型前胶原经酶切修饰后产生,P1NP的血清含量可反映成骨细胞合成骨胶原的能力;CTX为成熟1型胶原被破骨细胞降解所产生,CTX的血清含量可反映破骨细胞的骨吸收活性。既往有研究报道,对髋部骨折患者,骨吸收标志物在骨折2周内即可升高,骨折2~3个月后开始降低,并在6个月时接近于骨折前水平;骨形成标志物峰值时间晚于骨吸收标志物,但在骨折1年后仍保持升高。骨形成标志物的这些变化反应了骨折后的修复过程[4, 5],其变化与本研究所观察的的趋势相同,但由于骨转换标志物水平变化的程度可能还依赖于骨折骨的大小和数量;对于髋部骨折,破骨细胞清除残留死骨以及成骨细胞形成新骨的程度及持续时间均可能更长。亦有文献对前臂骨折后骨转换标志物的变化进行了观察,结果提示骨形成标志物有13%~52%在2~4周升高,并在52周时仍保持升高。骨吸收标志物有18%~35%的患者在2~6周升高,在52周时回落到基线水平[6]。综合看来,骨折后骨形成标志物及骨吸收标志物在2周左右会升高,且骨吸收标志物的下降要早于骨形成标志物。由于髋部骨及前臂骨相对于椎体来说,其骨皮质比例较多,不同骨组织比例的差异对于骨折后骨代谢标志物的水平及持续变化时间可能有一定影响[7],故本研究需要延长随访时间;但由于椎体骨折后目前多采取椎体成形术,以达到改善椎体强度和稳定性,防止塌陷,缓解疼痛,甚至部分恢复椎体高度的目的,故从伦理学的角度较长时间的自然病程变化结果不易得到。
曾有研究观察了骨科手术治疗对骨代谢标志物的影响,纳入的患者为老年股骨粗隆间骨折患者85例,选取的研究对象均为女性,平均年龄(77.4±6.9)岁(61~95岁);结果提示骨科术后较术前的P1NP增加了75.4%,CTX减少了23.7%[8]。就上述研究结果提示骨科手术可加快骨转换标志物的自然演变,从而促进骨折愈合。但椎体骨折的患者进行椎体成形术后骨转换标志物的变化趋势还需要进一步观察。
众所周知,健康人骨代谢标志物的水平是随着年龄阶段的不同而不同的,且不同的性别亦有不同的范围[9],骨折后不同性别的骨代谢标志物变化有可能有不同的规律。但鉴于椎体的骨质疏松性骨折女性多发,男性少见,本研究男性例数仅27例,故未能进行分组分析探索两者不同的变化规律。总体水平上,不同性别间的骨代谢标志物水平差异无统计学意义(P>0.05)。
本研究提示椎体骨折后P1NP和CTX的上升与血磷水平呈正相关关系。血清无机磷代谢在骨矿代谢中占重要位置,骨折愈合期及绝经后妇女骨质疏松症血磷均可上升,而老年性骨质疏松症血磷一般正常。调查研究提示中国城市女性自然绝经年龄为48.72岁[10]。而本研究女性年龄52~90岁,平均年龄为(68.8±9.6)岁,至少绝经5年以上;血磷水平均在正常范围,平均浓度(1.18±0.16)mmol/L,故考虑统计结果有一定参考意义。本研究女性血钙、磷水平高于男性,提示女性在血钙、磷偏高水平下可出现椎体压缩性骨折,也可能与绝经后女性血钙磷水平相对男性偏高有关。本组患者血清磷与P1NP和CTX呈正相关关系的原因考虑如下:(1)老年人血磷水平正常偏高在一定程度上提示患者健康状况良好,有充足的营养摄入,蛋白、胶原、能量代谢状况较好,骨折后骨代谢相对活跃,应激水平良好;(2)老年人血磷水平正常偏高在一定程度上可能提示其体内合成类激素水平相对偏高,亦是相对健康的标志;(3)老年人血磷水平正常偏高在一定程度上可能提示其体内25OHD水平相对偏高,充足的维生素D对骨代谢有益,在骨折等应激状态下P1NP和CTX水平可能相应升高。这亦符合本研究25OHD水平越高,P1NP上升越高的结果。
一些研究认为,骨代谢标志物短期变化是非骨特异,因为胶原的产生以及损伤并不局限于骨,患者本身代谢水平亦会影响到骨代谢标志物水平[11]。但对于椎体骨折患者,骨外损伤相对较小,骨代谢标志物应能反映骨折时骨代谢的变化。故而骨代谢标志物对评估椎体骨愈合进程,以及延迟愈合或不愈合风险,干预骨愈合措施方面的作用均值得期待。
| [1] | Sousa CP,Dias IR,Lopez-Peña M,et al. Bone turnover markers for early detection of fracture healing disturbances: A review of the scientific literature[J]. An Acad Bras Cienc,2015,87:1049-1061. |
| [2] | Wölfl C,Schweppenhäuser D,Gühring T,et al. Characteristics of bone turnover in the long bone metaphysis fractured patients with normal or low bone mineral density (BMD) [J]. PLoS One,2014,9:e96058. |
| [3] | Mukhopadhyay M,Sinha R,Pal M, et al. Role of common biochemical markers for the assessment of fracture union[J]. Indian J Clin Biochem,2011,26:274-278. |
| [4] | Ichimura S,Hasegawa M. Biochemical markers of bone turnover. New aspect. Changes in bone turnover markers during fracture healing[J]. Clin Calcium,2009,19:1102-1108. |
| [5] | Ikegami S,Kamimura M,Nakagawa H,et al. Comparison in bone turnover markers during early healing of femoral neck fracture and trochanteric fracture in elderly patients[J]. Orthop Rev:Pavia,2009,1:50-55. |
| [6] | Ingle BM,Hay SM,Bottjer HM,et al.Changes in bone mass and bone turnover following distal forearm fracture[J]. Osteoporos Int,1999,10:399-407. |
| [7] | Ivaska KK,Gerdhem P,Akesson K,et al. Effect of fracture on bone turnover markers: a longitudinal study comparing marker levels before and after injury in 113 elderly women[J]. J Bone Miner Res,2007,22:1155-1164. |
| [8] | 张旭,林伟龙,李慧林,等. 老年股骨粗隆间骨折患者围手术期的血骨代谢指标[J]. 复旦学报:医学版,2014,41:706-707. |
| [9] | Li M,Li Y,Deng W,et al. Chinese bone turnover marker study: reference ranges for C-terminal telopeptide of type I collagen and procollagen I N-terminal peptide by age and gender[J]. PLoS One,2014,9:e103841. |
| [10] | 聂广宁,王小云,杨洪艳. 中国城市女性绝经年龄影响因素调查[J]. 中国妇幼保健,2011,8:1191-1193. |
| [11] | Cox G,Einhorn TA,Tzioupis C,et al. Bone-turnover markers in fracture healing[J]. J Bone Joint Surg Br,2010,92:329-334. |
| (收稿日期:2015-03-23) |

