2. 510633 广州,广东省实验动物监测所/广东省实验动物重点实验室
2. Guangdong Laboratory Animal Monitoring Institute/Guangdong Key Laboratory of Laboratory Animal, Guangzhou 510633, China
糖皮质激素 (glucocorticoid,GC) 具有抗炎、抗休克、免疫抑制等多种药理作用,临床上应用广泛,患者往往需要短期大量或长期甚至终生使用GC,由此诱发骨质疏松及骨骼肌萎缩等严重不良反应。糖皮质激素性骨骼肌萎缩症 (glucocorticoid-induced muscular atrophy,GIMA)[1]。GIMA临床主要表现为骨骼肌萎缩和肌无力;肌组织活检为选择性Ⅱ型纤维萎缩,GIMA发病机制尚未明确。有研究指出,GIMA发生发展存在个体差异性,与遗传背景相关,但易感机制未明[2]。GIMA临床治疗以GC停用或减量并辅以肌营养性干预为主,但对于依赖GC的病患尚无疗效确切的防治药物[3]。因此,开展实验研究对于探讨GIMA发病机制,尤其是易感性机制,寻找预警标志物及药物研发具有重要意义。
封闭群大鼠,如SD大鼠和封闭群Wistar大鼠是GIMA实验研究的常用造模动物[4-5]。封闭群大鼠的基因背景杂合,药物反应性有个体差异,一般适用于模拟人群整体的药效学及毒理学效应。相比之下,近交系大鼠群体内个体基因型一致,遗传特性相同,是遗传相关疾病研究的首选模型动物。但目前尚未见近交系大鼠GIMA造模的文献报道。本研究在比较Wistar大鼠近交系和封闭群两品系骨骼肌萎缩效应及其肌萎缩相关基因--肌肉萎缩盒F蛋白 (muscle atrophy F-box, MAFbx) mRNA表达水平的基础上,提出近交系大鼠GIMA造模的优选方案。
材料与方法 实验动物3月龄Wistar近交系和封闭群两品系大鼠各32只,近交系Wistar大鼠为SPF级、体质量 (200±20) g,由上海斯莱克实验动物有限责任公司提供,实验动物许可证号:SCXK (沪)2012-0002;封闭群Wistar大鼠为SPF级、体质量 (200±20) g,由中山大学实验动物中心提供,实验动物许可证号:SCXK (粤)2011-0029,以标准饲料常规饲养于SPF级动物房至给药结束。
试药和仪器地塞米松磷酸钠注射液 (辰欣药业股份有限公司,规格1 mL:2 mg);RNA simple total RNA kit (天根生化科技有限公司);PrimescriptTMRT reagent kit with gDNA eraser (perfect real time)(宝生物工程大连有限公司) 和SYBR® Premix Ex TaqTMⅡ(宝生物工程大连有限公司);引物合成 (Generay Biotech公司)。
冰冻切片机 (德国Leica公司);石蜡切片机 (德国Leica公司);正置显微镜 (日本Olympus公司);实时定量PCR仪 (美国ABI公司Prism7500)。
方法动物分组及给药:适应性喂养1周后,两品系大鼠采用数字表法随机分为4组给药:对照组 (C组) 肌肉注射0.9%氯化钠注射液1.0 mL/kg、每周3次;各给药组分别为低频组 (L组)、中频组 (M组) 和高频组 (H组),相应地每周1、3、5次肌注地塞米松 (dexamethasone,Dex)1.0 mg/kg,连续给药90 d,停药次日按动物实验规范麻醉、处死及取材。
腓肠肌取材及形态学检测:取双侧腓肠肌称重,计算腓肠肌系数及其变化率。腓肠肌系数=腓肠肌湿重/体质量。腓肠肌系数变化率=(每组的腓肠肌系数-对照组的腓肠肌系数)/对照组的腓肠肌系数。
石蜡切片及HE染色观察肌纤维形态及检测肌纤维横截面积变化率:取右侧腓肠肌,常规石蜡包埋、切片及HE染色后,镜下观察骨骼肌纤维形态变化,并于200倍光镜下随机选取100个肌纤维,用IPP 6.0图像分析系统测量肌纤维横截面积并计算其变化率。肌纤维横截面积变化率=(每组的肌纤维横截面积-对照组的肌纤维横截面积)/对照组的肌纤维横截面积。
冰冻切片及肌纤维分型ATP酶染色检测Ⅰ型和Ⅱ型肌纤维横截面积变化率:取左侧腓肠肌,用OCT (opti-mum cutting temperature compound) 试剂包埋后,行7 μm冰冻切片,用酸性预孵育液对冰冻切片进行预孵育后,显深褐色为Ⅰ型纤维,其余视为Ⅱ型纤维[6]。200倍光镜下随机选取100个肌纤维,用IPP 6.0图像分析系统测量Ⅰ、Ⅱ型纤维横截面积并计算其增长率。
RT-qPCR检测肌组织糖皮质激素受体mRNA (glucocorticoid receptors,GR) 和MAFbx mRNA表达变化率:取腓肠肌样品,用RNA simple total RNA kit提取总RNA,反转录为cDNA,GR和MAFbx引物序列见表 1。
| Gene | 引物序列 (5′→3′) |
| GR | F: GCAGCATTACCACAGCTCAC |
| R: ACTTGACGCCCACCTAACAT | |
| MAFbx | F: AGCTTGTGCGATGTTACCCA |
| R: GGTGAAAGTGAGACGGAGCA | |
| GR:糖皮质激素受体;MAFbx:肌肉萎缩盒F蛋白 | |
RT-qPCR试验按SYBR® Premix Ex TaqTMⅡ试剂盒说明书进行,扩增条件为:95 ℃预变性30 s,95 ℃变性5 s,60 ℃退火34 s;共40个循环,60 ℃延伸1 min,检测并计算2-△△Ct值[5],视为mRNA表达量。mRNA表达变化率=(每组的mRNA表达量-对照组mRNA表达量)/对照组mRNA表达量。
统计学方法采用SPSS17.0进行统计学处理,计量数据以均数±标准差 (x±s) 表示,单因素方差分析及组间比较,相关性分析用Pearson双变量相关分析方法进行。相关系数的绝对值趋近1,表示两变量相关性越强,趋近0,表示两变量的相关性越弱;相关系数大于0,表示两变量正相关,相关系数小于0,表示两变量负相关,以P<0.05为差异有统计学意义。
结果 Dex对大鼠体质量的影响近交系大鼠C组和L组体质量随时间延长呈增长趋势,而M组和H组体质量变化与C组明显背驰。第90天,与C组体质量比较,M和H组显著下降,且H组较M组显著下降。封闭群大鼠体质量变化趋势与近交系相似 (图 1)。
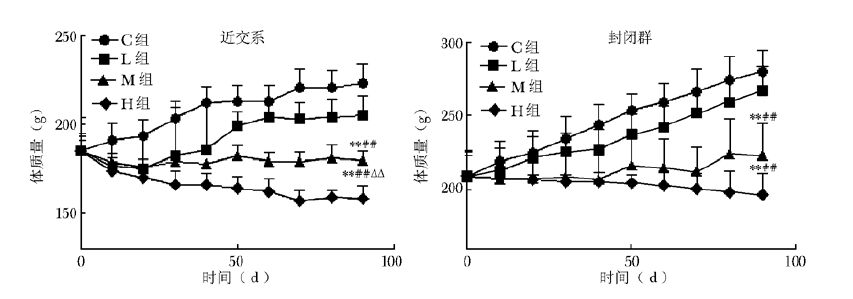
|
| 图 1 大鼠体质量曲线 (x±s,n=8) Figure 1 Rat body weight curve (x±s, n=8) 第90天体质量, 与C组比较,**P<0.01;与L组比较,##P<0.01;与M组比较,△△P<0.01 |
近交系H组腓肠肌系数较C组、L组和M组均显著性减小;封闭群H组腓肠肌系数较C和L组减小差异有统计学意义 (P<0.05),但较M组变化差异无统计学意义 (P>0.05)(表 2)。
| 组别 | 近交系 | 封闭群 |
| C组 |
0±0.05 |
0±0.01 |
| L组 |
3.60±0.05 |
0±0.03 |
| M组 |
0±0.05 | -8.50±0.06 |
| H组 | -10.90±0.07**#△△ | -13.60±0.12**## |
| 与C比较,**P<0.01;与L比较,#P<0.05,##P<0.01;与M比较,△△P<0.01 | ||
腓肠肌肌纤维形态变化:光镜下,两品系大鼠M组和H组肌纤维均见不同程度的萎缩征,部分纤维呈明显“小角化”改变,未见炎性反应细胞浸润 (图 2)。
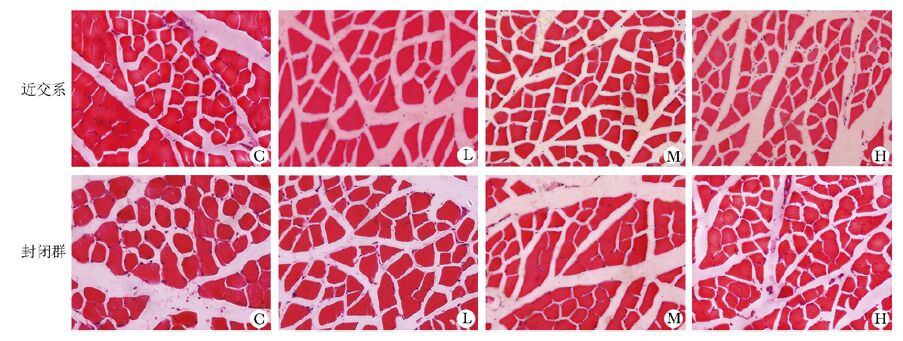
|
| 图 2 大鼠腓肠肌横截面肌纤维形态观察 Figure 2 Observation on the morphology of rat gastrocnemius muscle fiber cross section (HE, ×200) C:对照组;L:低频组;M:中频组;H:高频组 |
腓肠肌肌纤维横截面积变化:近交系中,与C组肌纤维横截面积变化率相比,L组变化无显著性;M和H组减小均有显著差异,且H组较M组显著减小。封闭群中,L、M和H组肌纤维横截面积变化率均较C组显著减小,且给药组间随给药频次增加而显著减少 (表 3)。
| 组别 | 近交系 | 封闭群 |
| C组 | 0±3.40 | 0±2.30 |
| L组 | 4.37±1.89 | -24.00±3.00** |
| M组 | -13.00±2.00**## | -31.00±2.00**## |
| H组 | -29.00±2.00**##△△ | -35.00±2.00**##△ |
| 与C组比较,**P<0.01;与L组比较,##P<0.01;与M组比较,△P<0.05,△△P<0.01 | ||
腓肠肌肌纤维分型 (ATP酶法):用酸性预孵育液下,显深褐色为Ⅰ型纤维,其余为Ⅱ型纤维。
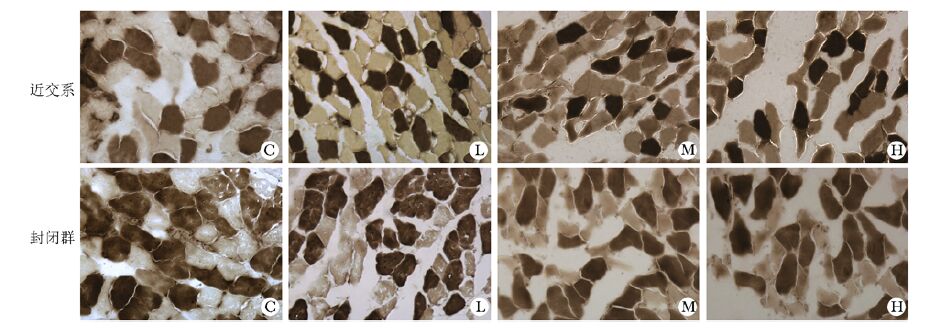
|
| 图 3 腓肠肌横截面肌纤维分型显色 (ATP酶法,× 200) Figure 3 The type color of the cross sectional gastrocnemius muscle fibers (myosin ATPase staining method, × 200) C:对照组;L:低频组;M:中频组;H:高频组 |
腓肠肌Ⅰ型纤维和Ⅱ型肌纤维的横截面积变化:近交系中,M组、H组Ⅰ型纤维横截面积变化率较C组、L组显著减小,但L组较C组无显著差异;各给药组Ⅱ型纤维横截面积变化率均较C组显著减小,且随给药频次增加,各给药组间依次减少均有显著差异。封闭群中各给药组组间Ⅰ型纤维横截面积变化率均无显著差异;各给药组的Ⅱ型纤维横截面积变化率均较C组显著减小,但其组间变化与给药频次增加无依赖性 (表 4)。
| 组别 | 近交系 | 封闭群 | ||
| Ⅰ型纤维 | Ⅱ型纤维 | Ⅰ型纤维 | Ⅱ型纤维 | |
| C组 |
0±1.00 |
0±3.00 |
0±7.00 |
0±3.00 |
| L组 |
-1.00±1.00 |
-18.00±2.00** |
-9.00±4.00 |
-45.00±1.00** |
| M组 |
-24.00±3.00**## |
-25.00±3.00**## |
-5.00±4.00 |
-53.00±1.00**## |
| H组 |
-20.00±4.00**## |
-38.00±2.00**##△△ |
-3.00±2.00 |
-44.00±2.00**△△ |
| 与C组比较,**P<0.01;与L组比较,##P<0.01;与M组比较,△P<0.05,△△P<0.01 | ||||
近交系中,与C组比较,H组GR及MAFbx mRNA表达变化率显著增加,其余组差异均无统计学意义 (P>0.05)。封闭群中,H组GR mRNA表达变化率比C组显著降低;而各给药组MAFbx mRNA表达变化率均比C组显著增加 (表 5)。
| 组别 | 近交系 | 封闭群 | ||
| GR | MAFbx | GR | MAFbx | |
| C组 |
0±37.00 |
0±31.00 |
0±2.00 |
0±2.00 |
| L组 |
150.00±12.00 |
175.00±10.00** |
30.00±4.00* |
15.00±2.00* |
| M组 |
400.00±25.00** |
675.00±25.00**## |
-26.00±5.00*## |
21.00±6.00* |
| H组 |
750.00±37.00**## |
2 125.00±25.00**##△△ |
-55.00±6.00**## |
33.00±3.00*# |
| GR:糖皮质激素受体;MAFbx:肌环指蛋白; 与C组比较,*P<0.05,**P<0.01;与L组比较,#P<0.05,##P<0.01;与M组比较,△P<0.05,△△P<0.01 | ||||
GC致骨骼肌萎缩症的动物模型尚无标准造模方法,研究报道中关于模型动物及给药途径、剂量和取材部位等均有所不同,其中以Dex或强的松龙诱导小鼠或封闭群大鼠造模为多;Dex有效建模剂量有0.5 mg/(kg·d)[7-9]、1.0 mg/(kg·d)、2.0 mg/(kg·d)[4]及5 mg/(kg·d)[10]等;给药途径包括皮下、腹腔和肌肉注射;给药时长在10 d[8-9]、12 d[10]或14 d[4-5];取材有长屈肌、胫骨前肌、比目鱼肌和腓肠肌,而对骨骼肌萎缩症的评价指标基本一致,主要考察动物体质量、骨骼肌湿重或肌系数及骨骼肌肌纤维形态,尤其是Ⅱ型肌纤维萎缩病变。
本研究选用Wistar大鼠的近交系和封闭群两品系进行造模比较,目的是探讨建立基于不同研究目的模型动物选择及造模条件优化。GC致骨骼肌萎缩有个体易感性差异。近交系动物群内个体遗传背景均一,是遗传易感性相关疾病研究的最佳选择[11]。此外,临床上,因GC用药导致骨骼肌萎缩的病患大多出于病情需要而长期用药。有研究指出,GC在小剂量多频次给药下,血药浓度较平稳且不良反应较少[12]。因此,本研究在参考临床用药及前期实验研究基础上,采用Dex 1.0 mg/ kg·d、每周1、3、5次肌肉注射90 d给药,从中优选出长期用药诱导骨骼肌萎缩造模的最佳方案。
GC对骨骼肌的损伤主要体现为Ⅱ型肌纤维受累。本研究结果也显示,两品系各给药组均出现Ⅱ型肌纤维横截面积显著减少,这与文献报道相符[13]。同时,本研究也发现,Ⅱ型肌纤维萎缩较之体质量、腓肠肌系数及肌纤维横截面积减少在低频给药下已具显著性,而随给药频次增加,近交系大鼠Ⅱ型肌纤维萎缩病变呈剂量依赖性。停药或肌营养干预可以改善Ⅱ型肌纤维萎缩,由此,从Ⅱ型肌纤维变化引起的机体代谢变化去切入,对骨骼肌萎缩易感性预警、病程进展及干预措施评价、药物靶标发现等方面均有指标性意义。
GR是介导GC发挥细胞效应的“门户”,同时也是核转录因子,转录调控多种基因表达,而MAFbx是一种骨骼肌特异性泛素蛋白连接酶[14],高表达的MAFbx降解肌蛋白是肌萎缩的机制之一,因此,本研究在明确模型成立的基础上,进一步探讨了GIMA中GR和MAFbx的mRNA表达量变化。结果显示,近交系大鼠在高频次90 d给药,GR和MAFbx的mRNA表达增加,两者呈正相关,那么,GR和MAFbx的信号通路在骨骼肌病变调控中有否可能存在“Cross-talk”?有研究指出,MAFbx启动子的活化,是FoxO3活性增强所引起,FoxO3活性受磷脂酰肌醇3-激酶 (phosphatidyl inositol 3-kinase, PI3K)/苏氨酸蛋白激酶B (protein kinase B, Akt) 信号通路的负调控,而PI3K/Akt信号通路受胰岛素样生长因子 (insulin-like growth factor-1, IGF-1) 的正调控,因此IGF-1对FoxO3活性起抑制作用,另一方面,GR又可以抑制IGF-1的表达,当GR高表达时,FoxO3活性增强,活化MAFbx启动子使MAFbx表达增高,引起骨骼肌萎缩[15-18]。综上推断:Dex诱导MAFbx基因高表达引发骨骼肌萎缩效应可能与GR/IGF-1/PI3K/Akt/FoxO3信号通路有关。然而,本实验结果也显示,封闭群大鼠GR与MAFbx mRNA表达呈负相关。已知封闭群大鼠群内基因杂合,而GC易感性与个体遗传背景相关,因此,在小样本实验中,如果个体间对Dex易感性有较大差异时,基因表达结果可能出现较大的随机性和不确定性。本实验结果是否因此而导致尚需作进一步验证,但同时也反映出,在动物模型上进行基因表达研究,对于存在明显遗传易感性倾向的疾病,以近交系动物造模应该更符合实验设计中重现性和单因素变量的原则。
致谢: 本研究相关实验主要在广东药科大学生命科学与生物制药学院骨骼与骨骼肌疾病研究室和广东省实验动物监测所完成,感谢以上实验室的老师对本研究给予的支持。| [1] | Bodine SC, Furlow JD. Glucocorticoids and skeletal muscle[J]. Adv Exp Med Biol, 2015, 872 : 145–176. DOI:10.1007/978-1-4939-2895-8 |
| [2] | Schakman O, Kalista S, Barbe C, et al. Glucocorticoid-induced skeletal muscle atrophy[J]. Int J Biochem Cell Biol, 2013, 45 : 2163–2272. DOI:10.1016/j.biocel.2013.05.036 |
| [3] | Gupta A, Gupta Y. Glucocorticoid-induced myopathy:pathophysiology, diagnosis, and treatment[J]. Indian J Endocrinol Metab, 2013, 17 : 913–916. DOI:10.4103/2230-8210.117215 |
| [4] | Konno S. Hydroxyl radical formation in skeletal muscle of rats with glucocorticoid-induced myopathy[J]. Neurochem Res, 2005, 30 : 669–675. DOI:10.1007/s11064-005-2755-4 |
| [5] | Morimoto Y, Kondo Y, Kataoka H, et al. Heat treatment inhibits skeletal muscle atrophy of glucocorticoid-induced myopathy in rats[J]. Physiol Res, 2015, 64 : 897–905. |
| [6] | 章涛, 张潜, 胡锡阶, 等. 改良骨骼肌肌纤维分型ATP酶染色方法[J]. 西安交通大学学报:医学版, 2009, 2 : 254–256. |
| [7] | 高祖新. 医药数理统计方法[M]. 北京: 人民卫生出版社, 2011 : 210-4. |
| [8] | Macedo AG, Krug AL, Souza LM, et al. Time-course changes of catabolic proteins following muscle atrophy induced by dexamethasone[J]. Steroids, 2016, 107 : 30–36. DOI:10.1016/j.steroids.2015.12.016 |
| [9] | Krug AL, Macedo AG, Zago AS, et al. High-intensity resistance training attenuates dexamethasone-induced muscle atrophy[J]. Muscle Nerve, 2016, 53 : 779–788. DOI:10.1002/mus.24906 |
| [10] | Liu J, Peng Y, Wang X, et al. Mitochondrial dysfunction launches dexamethasone-induced skeletal muscle atrophy via AMPK/FOXO3 signaling[J]. Mol Pharm, 2016, 13 : 73–84. DOI:10.1021/acs.molpharmaceut.5b00516 |
| [11] | 秦川. 医学实验动物学[M]. 北京: 人民卫生出版社, 2015 : 50-84. |
| [12] | Strehl C, Buttgereit F. Long-term glucocorticoid therapy:Is there a safe dosage?[J]. Der Internist, 2016, 57 : 934–939. DOI:10.1007/s00108-016-0098-7 |
| [13] | 刘媛, 韩艳庆. 类固醇肌病的研究现状[J]. 职业与健康, 2016, 11 : 1556–1558. |
| [14] | Rodriguez J, Vernus B, Chelh I, et al. Myostatin and the skeletal muscle atrophy and hypertrophy signaling pathways[J]. Cell Mol Life Sci, 2014, 71 : 4361–4371. DOI:10.1007/s00018-014-1689-x |
| [15] | Inder WJ, Jang C, Obeyesekere VR, et al. Dexamethasone administration inhibits skeletal muscle expression of the androgen receptor and TGF-1-implications for steroid-induced myopathy[J]. Clin Endocrinol, 2010, 73 : 126–132. |
| [16] | Bodine SC, Baehr LM. Skeletal muscle atrophy and the E3 ubiquitin ligases MuRF1 and MAFbx/atrogin-1[J]. Am J Physiol Endocrinol Metab, 2014, 307 : E469–E484. DOI:10.1152/ajpendo.00204.2014 |
| [17] | Sandri M, Sandri C, Gilbert A, et al. Foxo transcription factors induce the atrophy-related ubiquitin ligase atrogin-1 and cause skeletal muscle atrophy[J]. Cell, 2004, 117 : 399–412. DOI:10.1016/S0092-8674(04)00400-3 |
| [18] | Feng Y, Famuyide M, Bhatt AJ. Dexamethasone decreases insulin-like growth factor-Ⅰ and -Ⅱ via a glucocorticoid receptor dependent mechanism in developing rat brain[J]. Neuroendocrinol Lett, 2013, 34 : 624–34. |
| (收稿日期:2016-11-07) |

