原发性肥厚性骨关节病(primary hypertrophic osteoarthropathy,PHO),又称厚皮性骨病(pachy-dermoperiostosis),为罕见遗传性疾病,多数呈常染色体隐性遗传,主要累及皮肤、骨骼和软组织[1]。疾病的主要临床表现包括杵状指趾、皮肤增厚、骨膜增生、多汗、关节肿痛等,少见表现有动脉导管未闭、颅缝关闭延迟、骨髓纤维化、腹泻等[2]。
近期研究发现,PHO的致病基因主要有:编码15-羟前列腺素脱氢酶(15-hydroxyprostaglandin dehydrogenase,15-PGDH)的HPGD基因和编码前列腺素转运蛋白(prostaglandin transporter,PGT)的SLCO2A1基因[3-4]。目前国内外报道的患者多为男性,大多具有皮肤增厚、骨膜增生、关节肿胀等典型临床表现,然而,PHO女性患者少,临床表现相对不典型,容易漏诊,报道较少[1]。
据文献报道,杵状指趾是PHO最常见的临床表现之一。约95%~97%的杵状指趾存在复杂的继发性原因,主要与心、肺疾病,消化系统疾病和肿瘤等疾病相关[5]。明确杵状指趾的原因相对困难,疾病的治疗也面临挑战,积极寻找其病因对于进一步治疗,具有重要意义。
本研究对两例罕见的主要表现为原因不明杵状指趾的女童,进行临床表型的详细调查,并对其致病基因突变进行检测,旨在了解导致患者杵状指趾的可能机制。
对象与方法 对象先证者,女,年龄9岁3个月,主诉:发现杵状指趾8年余。先证者妹妹,年龄4岁8个月,主诉:发现杵状指趾4年余。2例患者于2017年8月就诊于北京协和医院内分泌科。患者母亲孕期平顺,2例患者均足月剖腹产,出生体质量3.0 kg左右,身长不详。患者均于6月龄出现杵状指趾,并逐渐出现掌跖多汗。否认关节肿痛、面容变丑、皮肤增厚、腹泻、胃部不适、贫血病史。既往:姐姐罹患先天性动脉导管未闭,手术治疗后好转。妹妹曾右侧锁骨骨折。家族史:父母亲非近亲婚配,体健,否认家族中类似病史。查体:先证者身高145 cm(位于同龄同性别儿童+1 SD~+2 SD),体质量45 kg(位于同龄同性别儿童+2 SD ~+3 SD)。可见典型杵状指趾,掌跖多汗,掌部皮肤粗糙。妹妹:身高115 cm(位于同龄同性别儿童+1 SD~+2 SD),体质量19.5 kg(位于同龄同性别儿童中位数~+1 SD),可见典型杵状指趾,掌跖多汗(图 1)。两患儿均无面部皮肤增厚,无关节肿痛,无骨骼畸形,无紫绀,囟门已闭。患者家系图如图 2所示。
|
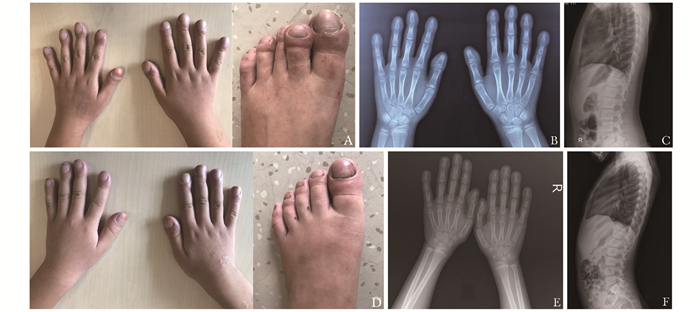
| 图 1 先天性肥厚性骨关节病患者的临床表现 Figure 1 Phenotypes of the two PHO patients A~C:先证者:A.杵状指趾;B.双手正位相;C.胸腰椎侧位相;D~F:先证者妹妹; D.杵状指趾;E:双手正位相;F.胸腰椎侧位相 |
|
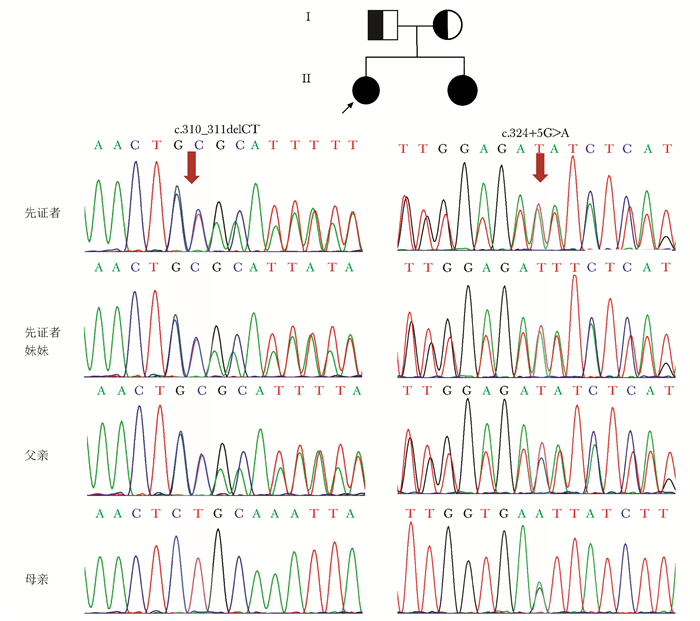
| 图 2 先天性肥厚性骨关节病患者家系图及HPGD基因测序结果 Figure 2 Pedigree of the PHO family and Sanger sequencing results of the HPGD gene 测序结果提示患者存在第3外显子c.310_311delCT和第3内含子c.324+5G>A复合杂合突变,其父母亲分别为上述突变携带者 |
先证者及妹妹血生化指标和骨密度(bone mineral density,BMD)检测结果见表 1。血气分析结果正常,无低氧血症。患者血清钙、磷、甲状旁腺素浓度在正常范围,骨形成指标碱性磷酸酶正常,骨吸收指标β-胶原降解产物符合儿童正常范围[6],血清25OHD水平正常。患者骨密度在同龄儿童的正常范围。X线片未见掌骨及尺桡骨骨膜增生及肢端骨溶解表现,胸腰椎无侧突、后突畸形及压缩性骨折(图 1)。
| 指标 | 先证者 | 先证者妹妹 | 参考范围 |
| 血气pH | 7.396 | 7.386 | 7.35~7.45 |
| 氧分压(mmHg) | 91.8 | 102 | 83~108 |
| Ca(mmol/L) | 2.45 | 2.49 | 2.13~2.70 |
| P(mmol/L) | 1.66 | 1.73 | 1.29~1.94 |
| ALP(U/L) | 280 | 197 | 42~390 |
| β-CTX(μg/L) | 1.96 | 1.87 | [6] |
| 25OHD(μg/L) | 21.9 | 29.9 | 20~50 |
| PTH(ng/L) | 50.1 | 52.8 | 12~68 |
| LS BMD(g/cm2) | 0.702 | 0.591 | |
| LS BMD Z评分 | 0.830 | 0.730 | |
| FN BMD(g/cm2) | 0.696 | 0.561 | |
| FN BMD Z评分 | 0.110 | -0.670 | |
| TR BMD(g/cm2) | 0.568 | 0.496 | |
| TH BMD(g/cm2) | 0.685 | 0.559 | |
| Ca:钙;P:磷;ALP:碱性磷酸酶;β-CTX:β-胶原降解产物;25OHD:25羟维生素D;PTH:甲状旁腺素;LS BMD:腰椎骨密度;FN BMD:股骨颈骨密度;TR BMD:大转子骨密度;TH BMD:全髋骨密度(因为无正常女性儿童大转子和全髋部位骨密度的正常值,因此未计算上述两个部位骨密度Z评分) | |||
本研究获北京协和医院科研伦理委员会批准,在研究开始前征得患者父母同意并签署知情同意书。
致病基因检测采集先证者、妹妹及其父母外周静脉血,提取基因组DNA(采用德国QIAampDNA Blood Mini试剂盒)。采用Primer 3软件设计引物,扩增HPGD的1~7外显子及其与内含子交界区。引物序列、扩增长度及PCR反应条件见表 2。PCR扩扩增产物纯化后用荧光自动测序仪(ABI3700,美国)直接测序,测序结果与参考序列NM_000860.5比对,以确定HPGD突变位点及类型,并进一步与NCBI SNP、人类基因突变数据库(http://www.hgmd.cf.ac.uk/ac/index.php)进行比对,排除变异位点为基因多态性位点,并确定其是否为未报道过的新突变位点。采用BioEdit(7.0.9.1)软件分析突变位点在不同物种中的保守性,采用NNSPLICE0.9(http://www.fruitfly.org/)和NetGene2 Server(http://www.cbs.dtu.dk/services/NetGene2/)软件对剪切位点突变进行致病性预测。
| 外显子 | 正向引物(5′→3′) | 反向引物(5′→3′) | 产物长度(bp) | 退火温度(℃) |
| 1 | gttacttctgctccccgtca | cagcctcagcttcagcaaat | 772 | 60 |
| 2 | gctgtgagcacacctcagaa | gcagtcttgcctttctttcg | 477 | 60 |
| 3 | gaaattcctctcatggcatagg | ccagctttctgtaacttcccttt | 327 | 60 |
| 4 | taggcaaacccaaagaatcc | ggagtctcaccacaacctttg | 572 | 59 |
| 5 | ctgagtttcacaaagctatctggt | tccacctttcatccaagtga | 341 | 59 |
| 6 | cattgttacatagctgggaggata | gccaaaccaaaagtttgaag | 425 | 58 |
| 7 | tgcctcattctttcgtttca | ccttgactgcccccaaaata | 720 | 60 |
2例患者均为婴儿期起病,主要表现为典型杵状指趾、掌跖多汗,先证者有先天性动脉导管未闭病史,两例患者均未发现心肺系统疾病、Graves病、炎症性肠病等继发性杵状指趾原因。2例患者无面部皮肤增厚、容貌变丑及关节肿痛等表现,影像学未见骨膜增生及肢端骨溶解的异常表现。
HPGD基因突变分析候选基因PCR产物Sanger测序结果提示患者存在HPGD基因第3外显子c.310_311delCT和第3内含子c.324+5G>A的复合杂合突变(图 2)。患者父亲与母亲分别为c.310_311delCT及c.324+5G>A携带者(图 2)。
讨论本研究采用分子诊断的方法确诊两例以杵状指趾、掌跖多汗为主要表现的PHO女性儿童患者。患者PHO表现不典型,无明显皮肤增厚、骨膜增生及关节肿痛等表现。基因检测提示患者存在HPGD基因第3外显子c.310_311delCT和第3内含子c.324+5G>A的复合杂合突变。
PHO为罕见遗传性疾病,最早于1868年由德国Friedreic报道,以常染色体隐性和不完全外显的常染色体显性两种方式遗传,男女比例约为4.9:1[1],2008年和2012年研究发现HPGD和SLCO2A1为该病致病基因[3-4]。上述基因突变分别影响前列腺素E2(prostaglandin E2,PGE2)的代谢和转运,导致常染色体隐性遗传1型PHO(PHOAR1,OMIM 259100)和常染色体隐性遗传2型PHO(PHOAR2,OMIM 614441)[7-9]。HPGD基因位于HPGD基因位于4q34.1,共有7个外显子,编码266个氨基酸的15-羟前列腺素脱氢酶,主要负责在细胞内将PGE2降解为PGE-M。SLCO2A1位于3q22.1-q22.2,编码643个氨基酸的前列腺素转运蛋白,主要介导PGE2从细胞外进入细胞内[10-11]。HPGD和SLCO2A1突变均导致体内PGE2增多,PGE2可以扩张血管,促进局部组织增生,刺激成骨细胞和破骨细胞,从而导致杵状指趾、多汗、骨膜增生、肢端骨溶解等临床表现[3-4, 12]。在胎儿期,动脉导管在胎盘产生的PGE2作用下保持开放,出生后血PGE2浓度明显降低,动脉导管关闭,但是,由于PHO患者血液PGE2浓度不能迅速下降,可能导致动脉导管无法关闭[13],本例先证者就存在动脉导管未闭而行手术治疗,这也是疾病表型的一部分。
PHOAR1和PHOAR2两种疾病亚型可以通过起病年龄、性别分布和并发症进行临床鉴别。HPGD突变患者通常起病年龄早,男女比例约为2:1[14]。SLCO2A1突变患者起病年龄较晚,多于青春期后起病,尚无关于女性患者的报道。有研究者提出性激素水平可能对PGT有影响,可以解释起病年龄和性别分布的差异[15],但在大样本PHO患者中,未发现尿PGE2和PGE-M与性激素水平有相关性[2, 16],因此,PHOAR1和PHOAR2患者起病年龄和性别分布存在差异的机制,有待深入研究。PHOAR1型和PHOAR2型临床表型和并发症也存在差异。PHOAR2型患者通常皮肤增厚较PHOAR1型明显,可能与PHOAR2型患者的PGE2水平更高相关[2]。PHOAR2型患者容易并发骨髓纤维化和胃肠道出血,提示PGT对造血干细胞的诱导和维持,以及黏膜稳态具有重要作用[2, 17-18]。尚未见PHOAR2型患者有动脉导管未闭的报道[14],可能是由于SLCO2A1突变患者出生后存在其他方式降解PGE2,使动脉导管关闭,但其机制尚需进一步探索。由于本研究两例患者均为女性,出生后6个月即起病,先证者又有动脉导管未闭病史,临床推测患者可能为PHOAR1型,经致病基因突变检测,证实患者存在HPGD基因的复合杂合突变,确认患者为PHOAR1型。
随着分子遗传学的研究进展,越来越多的PHO患者获得分子诊断。研究总结的41例PHO患者全部为男性[2],研究总结的27例PHO患者中,仅1例为女性,提示该病男性多见,但也可能女性患者临床表现较轻,容易漏诊[9]。但也有1例北京协和医院女性PHO患者出现杵状指、掌跖多汗、手掌皮肤增厚、骨膜增生和关节疼痛等典型PHO临床表现的报道[8]。本研究报道的两例患者均为女性,临床表现较轻,仅以杵状指趾及掌跖多汗为主要临床表现,1例患者有动脉导管未闭史,患者无面部皮肤增厚、骨膜增生和关节肿痛的表现,这与文献报道的女性患者的临床表现[1, 19]相似。本研究患者就诊年龄较小,也可能疾病表现较轻与病程短有关,未来尚需对患者进行长期随访。
在鉴别诊断方面,杵状指趾尚需考虑其他疾病所致的可能,包括心、肺疾病,血管性病变,炎症性肠病,Graves病等[5, 20]。本研究2例患者无上述疾病的临床表现,经过相应检查,也未见上述疾病的诊断证据。本研究先证者有动脉导管未闭病史,这可见于多种遗传性疾病,如Rubinstein-Taybi综合征、Char综合征等,上述综合征多有典型外貌畸形,通过致病基因突变检测,能够很好地进行鉴别诊断[21-22]。本研究提示,对于典型杵状指趾的患者,仍需考虑PHO的可能,进行致病基因突变检测,对于明确病因十分必要。
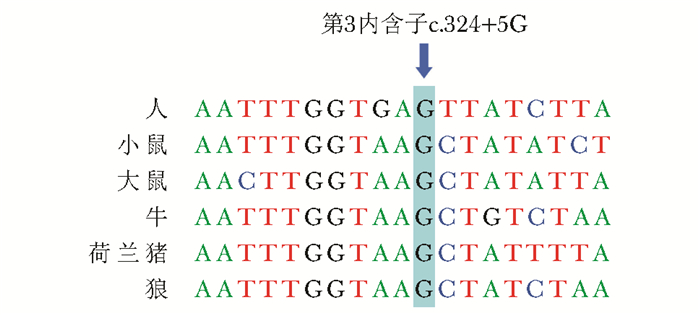
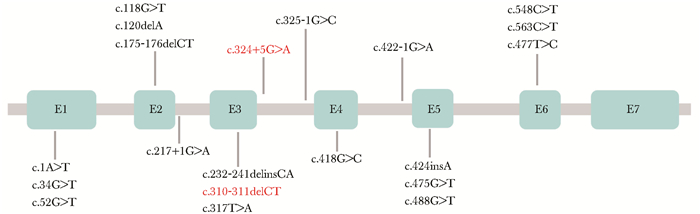
目前已报到的HPGD突变至少有20种(图 3,4)[3-4, 7-9, 14, 23-25],分布在第1~6外显子、第2~4内含子区域,其中c.175_176delCT突变(p.L59VfsX8)为欧洲患者的热点突变[3, 24]。本研究发现患者存在HPGD复合杂合突变,其中c.310_311delCT突变由Erken等[7]首次报道,此突变在中国人群中被多次报道,为中国人群HPGD突变患者的热点突变位点,其可致104位后氨基酸框移突变,并产生截短蛋白(p.L104AfsX3)[2, 8]。本研究检出的另一种突变c.324+5G在人、小鼠、大鼠、牛、荷兰猪、狼等多个物种中高度保守(图 3),在中国人群中也已被报道[9],软件预测该突变可导致剪切位点突变,引起外显子跳跃,使得蛋白质结构改变。
|
| 图 3 序列比对提示c.324+5G在多种哺乳动物中高度保守 Figure 3 Multiple alignments showed nucleotide conservation of the c.324+5G among mammals |
|
| 图 4 HPGD外显子结构示意图及已报道的HPGD突变 Figure 4 Schematic view of HPGD exons and previously reported mutation information of HPGD |
在治疗方面,由于杵状指趾通常无症状,往往不需要治疗[26-27]。有关节肿痛或皮肤增厚的患者,可给予非甾体抗炎药治疗,针对PEG2的选择性环氧化酶-2抑制剂为首选,该药可抑制花生四烯酸转化为前列腺素环内过氧化物,降低PEG2水平,改善患者症状。我国大样本研究前瞻性观察41例PHO患者,给予依托考昔60 mg/d治疗6个月,发现患者皮肤增厚、杵状指趾、关节肿痛明显改善,但骨皮质增厚变化不明显,该药能否改善骨骼异常尚需长期观察[2]。另外,有研究报道对非甾体类抗炎药抵抗的患者,试用双膦酸盐或英夫利西单抗治疗,对部分患者有效[28-29]。本项研究2例患者仅有杵状指趾表现,目前无临床症状,暂未予治疗,随访观察中。
PHO为罕见遗传性疾病,女性患者尤为罕见,且临床表现不典型。本文报道2例女性PHO患儿,仅以杵状指趾和掌跖多汗为临床表现,无面部皮肤增厚、骨膜增生、关节肿痛和肢端骨溶解等表现,基因检测证实HPGD复合杂合突变为患者的致病原因。提示对于起病较早的以杵状指趾为主要表现的患者,需重视HPGD等基因突变检测,以排查PHO的可能性。
| [1] | Castori M, Sinibaldi L, Mingarelli R, et al. Pachydermoperiostosis:an update[J]. Clin Genet, 2005, 68: 477–486. DOI:10.1111/(ISSN)1399-0004 |
| [2] | Li SS, He JW, Fu WZ, et al. Clinical, bioche-mical, and genetic features of 41 Han Chinese families with primary hypertrophic osteoarthropathy, and their therapeutic response to etoricoxib:results from a six-month prospective clinical intervention[J]. J Bone Miner Res, 2017, 32: 1659–1666. DOI:10.1002/jbmr.v32.8 |
| [3] | Uppal S, Diggle CP, Carr IM, et al. Mutations in 15-hydroxyprostaglandin dehydrogenase cause primary hypertrophic osteoarthropathy[J]. Nat Genet, 2008, 40: 789–793. DOI:10.1038/ng.153 |
| [4] | Zhang Z, Xia W, He J, et al. Exome sequencing identifies SLCO2A1 mutations as a cause of primary hypertrophic osteoarthropathy[J]. Am J Hum Genet, 2012, 90: 125–132. DOI:10.1016/j.ajhg.2011.11.019 |
| [5] | Yap FY, Skalski MR, Patel DB, et al. Hypertrophic osteoarthropathy:clinical and imaging features[J]. Radiographics, 2017, 37: 157–195. DOI:10.1148/rg.2017160052 |
| [6] | Rauchenzauner M, Schmid A, Heinz-Erian P, et al. Sex-and age-specific reference curves for serum markers of bone turnover in healthy children from 2 months to 18 years[J]. J Clin Endocrinol Metab, 2007, 92: 443–449. DOI:10.1210/jc.2006-1706 |
| [7] | Erken E, Körogǧlu Ç, Ylldlz F, et al. A novel recessive 15-hydroxyprostaglandin dehydrogenase mutation in a family with primary hypertrophic osteoarthropathy[J]. Mod Rheumatol, 2015, 25: 315–321. DOI:10.3109/14397595.2013.874757 |
| [8] | Yuan L, Chen L, Liao RX, et al. A common mutation and a novel mutation in the HPGD gene in nine patients with primary hypertrophic osteoarthropathy[J]. Calcif Tissue Int, 2015, 97: 336–342. DOI:10.1007/s00223-015-0024-3 |
| [9] | 林园园. 原发性肥厚性骨关节病骨吸收指标变化及骨微结构改变[D]. 太原: 山西医科大学, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10114-1016727080.htm |
| [10] | Nomura T, Lu R, Pucci ML, et al. The two-step model of prostaglandin signal termination:in vitro reconstitution with the prostaglandin transporter and prostaglandin 15 dehydrogenase[J]. Mol Pharmacol, 2004, 65: 973–978. DOI:10.1124/mol.65.4.973 |
| [11] | Schuster VL. Prostaglandin transport[J]. Prostaglandins Other Lipid Mediat, 2002, 68-69: 633–647. DOI:10.1016/S0090-6980(02)00061-8 |
| [12] | Blackwell KA, Raisz LG, Pilbeam CC. Prostaglan-dins in bone:bad cop, good cop?[J]. Trends Endocrinol Metab, 2010, 21: 294–301. DOI:10.1016/j.tem.2009.12.004 |
| [13] | Coggins KG, Latour A, Nguyen MS, et al. Metabolism of PGE2 by prostaglandin dehydrogenase is essential for remodeling the ductus arteriosus[J]. Nat Med, 2002, 8: 91–92. DOI:10.1038/nm0202-91 |
| [14] | Sinibaldi L, Harifi G, Bottillo I, et al. A novel homozygous splice site mutation in the HPGD gene causes mild primary hypertrophic osteoarthropathy[J]. Clin Exp Rheumatol, 2010, 28: 153–157. |
| [15] | Hatano R, Onoe K, Obara M, et al. Sex hormones induce a gender-related difference in renal expression of a novel prostaglandin transporter, OAT-PG, influencing basal PGE2 concentration[J]. Am J Physiol Renal Physiol, 2012, 302: F342–349. DOI:10.1152/ajprenal.00366.2011 |
| [16] | Zhang Z, He JW, Fu WZ, et al. Mutations in the SLCO2A1 gene and primary hypertrophic osteoarthropathy:a clinical and biochemical characterization[J]. J Clin Endocrinol Metab, 2013, 98: E923–933. DOI:10.1210/jc.2012-3568 |
| [17] | Diggle CP, Parry DA, Logan CV, et al. Prostaglandin transporter mutations cause pachydermoperiostosis with myelofibrosis[J]. Hum Mutat, 2012, 33: 1175–1181. DOI:10.1002/humu.v33.8 |
| [18] | Umeno J, Hisamatsu T, Esaki M, et al. A hereditary enteropathy caused by mutations in the SLCO2A1 gene, encoding a prostaglandin transporter[J]. PLoS Genet, 2015, 11: e1005581. DOI:10.1371/journal.pgen.1005581 |
| [19] | Martínez-Lavín M, Pineda C, Navarro C, et al. Primary hypertrophic osteoarthropathy:another heritable disorder associated with patent ductus arteriosus[J]. Pediatr Cardiol, 1993, 14: 181–182. DOI:10.1007/BF00795652 |
| [20] | Spicknall KE, Zirwas MJ, English JC 3rd. Clubbing:an update on diagnosis, differential diagnosis, pathophysiology, and clinical relevance[J]. J Am Acad Dermatol, 2005, 52: 1020–1028. DOI:10.1016/j.jaad.2005.01.006 |
| [21] | Aghaei-Moghadam E, Zanjani KS, Ghandi Y. Patent ductus arteriousus device closure in an infant with rubinstein-taybi syndrome[J]. Iran J Pediatr, 2013, 23: 708–709. |
| [22] | Satoda M, Zhao F, Diaz GA, et al. Mutations in TFAP2B cause Char syndrome, a familial form of patent ductus arteriosus[J]. Nat Genet, 2000, 25: 42–46. DOI:10.1038/75578 |
| [23] | Tariq M, Azeem Z, Ali G, et al. Mutation in the HPGD gene encoding NAD+ dependent 15-hydroxy-prostaglandin dehydrogenase underlies isolated con-genital nail clubbing (ICNC)[J]. J Med Genet, 2009, 46: 14–20. |
| [24] | Diggle CP, Carr IM, Zitt E, et al. Common and recurrent HPGD mutations in Caucasian individuals with primary hypertrophic osteoarthropathy[J]. Rheumatology (Oxford), 2010, 49: 1056–1062. DOI:10.1093/rheumatology/keq048 |
| [25] | Seifert W, Beninde J, Hoffmann K, et al. HPGD mutations cause cranioosteoarthropathy but not autosomal dominant digital clubbing[J]. Eur J Hum Genet, 2009, 17: 1570–1576. DOI:10.1038/ejhg.2009.104 |
| [26] | Bergmann C, Wobser M, Morbach H, et al. Primary hypertrophic osteoarthropathy with digital clubbing and palmoplantar hyperhidrosis caused by 15-PGHD/HPGD loss-of-function mutations[J]. Exp Dermatol, 2011, 20: 531–533. DOI:10.1111/j.1600-0625.2011.01248.x |
| [27] | Martinez-Lavin M. Miscellaneous non-inflammatory musculoskeletal conditions. Pachydermoperiostosis[J]. Best Pract Res Clin Rheumatol, 2011, 25: 727–734. DOI:10.1016/j.berh.2011.10.019 |
| [28] | da Costa FV, de Magalhães Souza Fialho SC, Zimmermann AF, et al. Infliximab treatment in pachydermoperiostosis:a rare disease without an effective therapeutic option[J]. J Clin Rheumatol, 2010, 16: 183–184. DOI:10.1097/RHU.0b013e3181df91c6 |
| [29] | Martinez-Lavin M, Vargas A, Rivera-Viñas M. Hypertrophic osteoarthropathy:a palindrome with a pathogenic connotation[J]. Curr Opin Rheumatol, 2008, 20: 88–91. DOI:10.1097/BOR.0b013e3282f14a5a |
| (收稿日期:2017-08-17) |

