糖尿病性骨质疏松症(diabetic osteoporosis, DOP)是由糖尿病(diabetes mellitus, DM)引起的继发性骨质疏松症,伴有骨量减少、骨组织微结构破坏、骨强度降低和骨脆性增加等病理特征[1]。伴随经济的发展和人类生活水平的提高,由糖尿病并骨质疏松症引起的骨折病例呈逐年上升趋势,严重影响患者生活质量,给个人和家庭带来沉重负担。因此糖尿病引起的骨质疏松和骨折越来越受到人们的关注,针对该病症的治疗药物研究具有重要临床意义。
利拉鲁肽(liraglutide, LRG)是一种人工合成的胰高血糖素样肽1受体(glucagon-like peptide 1 receptor, GLP-1R)激动剂,用于治疗糖尿病。现有研究证实,LRG能够显著降低糖尿病患者骨折的发生率[2];在卵巢切除小鼠模型中,LRG可以明显改善骨小梁体积、厚度和数量[3],促进成骨标志物Runx2、ALP、collagen α1的表达[4]。此外,Sun等[5]的研究发现,给予自发性Ⅱ型糖尿病大鼠皮下注射LRG 4周后,小梁骨密度(bone mass density, BMD)以及骨生成标志物Runx2、ALP、collagen 1、osteocalcin、OPG的表达显著增加。提示利拉鲁肽很可能具有促进骨生成,改善糖尿病骨质疏松作用,但具体机制仍需深入探索。
本研究通过建立糖尿病并发卵巢去势大鼠模型,采用利拉鲁肽进行干预,分析氧化应激、炎性反应和成骨标志物的变化,探讨利拉鲁肽对糖尿病并骨质疏松症的影响,初步明确相关分子机制。
材料与方法 动物及分组8周龄健康雌性SD大鼠,共计36只,适应性喂养1周后采用数字表法随机平均分为6组:Sham组、STZ组、STZ+LRG组、OVX组、STZ+OVX组STZ+OVX+LRG组。
主要试剂柠檬酸、柠檬酸钠、二甲苯、无水乙醇、曙红Y(国药集团);利拉鲁肽(诺和诺德制药有限公司);链脲佐菌素(streptozotocin, STZ)、苏木精(Solarbio公司)、BCA蛋白浓度测定试剂盒、丙二醛(malonaldehyde, MDA)测定试剂盒、活性氧(reactive oxygen species, ROS)测定试剂盒、超氧化物歧化酶(superoxide dismutase, SOD)测定试剂盒(万类生物公司);大鼠TNF-α ELSA试剂盒、大鼠IL-1β ELISA试剂盒、大鼠IL-6 ELISA试剂盒(Boster公司);Super M-MLV反转录酶、高纯总RNA快速提取试剂盒、Taq PCR MasterMix(BioTeke公司)、RNase固相清除剂(北京天恩泽)、Powder琼脂糖(Biowest公司)、50×TAE(Amresco公司)。
模型制备及药物干预糖尿病诱导组大鼠造模前12 h禁食不禁水,腹腔单次注射60 mg/kg STZ(溶于柠檬酸缓冲液中),对照组注射等体积溶剂。72 h后检测大鼠空腹血糖,高于16.7 mmol/L认为模型建立成功。OVX、STZ+OVX、STZ+OVX+LRG组大鼠腹腔注射10 %水合氯醛(3.5 mL/kg)麻醉,俯卧位固定于手术台。常规剃毛、碘伏消毒,于大鼠背部正中线做长约3 cm的纵向切口。牵拉皮肤切口使之偏向一侧,于正中线旁2 cm,髂棘上1.5 cm处钝性分离肌肉,用眼科弯镊深入切口,找到一侧卵巢,用线结扎输卵管,切除卵巢并止血,采用相同方法切除对侧卵巢。间断缝合肌肉和皮肤,切口部位滴青霉素抗炎。假手术组大鼠找到卵巢后不予结扎摘除,只切除卵巢附近小块脂肪,其他步骤同卵巢切除术。
手术1周后开始给药,给药组大鼠皮下注射0.6 mg/kg利拉鲁肽,每天给药1次,连续给药8周。给药期间喂养条件不变。
样本采集给药结束后,腹腔注射10%水合氯醛(3.5 mL/kg)麻醉大鼠,下腔静脉取血,收集股骨,部分液氮速冻转至-80 ℃保存备用,剩余组织固定于10%中性甲醛溶液中。
HE染色观察病理学变化将股骨组织固定于中性甲醛溶液中并放入10%乙二胺四乙酸二钠(EDTA-2Na)溶液中脱钙处理30 d;常规脱水、透蜡和包埋,切成5 μm厚切片;烘干、脱蜡至水、苏木素染色,1 %盐酸乙醇分化处理3 s,自来水清洗、伊红染色;将切片置于梯度乙醇中浸泡2 min,无水乙醇中浸泡5 min,二甲苯中浸泡10 min,擦干残留液体,滴加中性树胶封片,室温晾干,显微镜下观察染色效果,200倍目镜下拍照。
ELISA法检测炎性因子下腔静脉取血,室温静置4 h,4 ℃、3 000 r/min离心10 min,收集血清,分装。采用ELISA试剂盒检测炎性因子TNF-α、IL-1β、IL-6的表达。具体操作步骤严格按照说明书进行,最后采用酶标仪(需确保酶标板底无水滴及孔内无气泡产生)测定各个样本在450 nm波长处的吸光度(A)值。所有标准品和样品的A减去TMB空白显色孔的A值后,以标准品浓度为横坐标,调零后的A值为纵坐标,绘制标准曲线,计算各样本的实际浓度。
试剂盒检测氧化应激指标ROS含量检测:将股骨组织放入液氮中砸成接近粉末状态,分析天平称取0.05 g,加入450 μL PBS,转移至匀浆器中继续打碎,液氮反复冻融3次,10 005×g离心10 min收集上清,得到样本蛋白。BCA法测定蛋白浓度,根据BSA蛋白标准液的浓度和570 nm波长下对应的A值绘制标准曲线,计算各样本蛋白浓度,PBS稀释统一样本蛋白浓度。按照说明书分别向标准管和对照管内加入190 μL样本、LDCFH-DA工作液和PBS,吹打混匀,37 ℃孵育30 min,酶标仪测定其荧光强度(激发波长=485 nm,发射波长=525 nm)。
MDA含量测定:按照说明书操作表分别向反应管内加入待测样品和反应试剂,吹打混匀,95 ℃水浴40 min,冷却后10 005×g离心5 min,重复离心1次,波长532 nm、1 cm光径比色杯测各管A值,根据公式换算MDA含量。
SOD活性测定:按照说明书分别向反应管内加入待测样品和反应试剂,吹打混匀、室温放置10 min,波长550 nm、1 cm光径比色杯测各管A值,根据公式换算SOD活力。
RT-PCR检测成骨标志物mRNA表达实验末收集各组大鼠股骨组织,放入液氮中砸成接近粉末状态,分析天平称取约0.3~0.5 g,加入1 mL Trizol裂解液,提取总RNA,核酸分析仪测定RNA浓度和纯度,反转录合成cDNA,根据GenBank提供的基因序列设计特异性引物,由上海吉玛制药有限公司合成。各基因的引物序列如表 1所示。将上下游引物、2×Taq PCR Master-mix和cDNA混合,用ddH2O将总体积补足至20 μL,PCR扩增。完成后取PCR产物行1.5 %琼脂糖凝胶电泳,凝胶成像系统成像,行灰度扫描分析。
| 引物名称 | 正向引物(5'→3') | 反向引物(5'→3') | 产物长度(bp) |
| Nrf2 | CCCATTGAGGGCTGTGATCT | GTTGGCTGTGCTTTAGGTCC | 248 |
| HO-1 | CTGGAATGGAAGGAGATGCC | TCAGAACAGCCGCCTCTACCG | 132 |
| RUNX2 | TACTCTGCCGAGCTACGAAAT | GAGGATTTGTGAAGACCGTTAT | 133 |
| COL1A1 | GTCCCAGCGGTGAAGAAGG | GCCAGTTGAACCACGATTGC | 164 |
| β-actin | GGAGATTACTGCCCTGGCTCCTAGC | GGCCGGACTCATCGTACTCCTGCTT | 155 |
| RT-PCR:反转录-聚合酶链反应 | |||
采用SPSS17.0软件进行统计学处理,所有实验数据以均值±标准差(x±s)表示,组间比较采用t检验,以P<0.05为差异有统计学意义。
结果 利拉鲁肽对炎性反应的影响与Sham组比较,STZ、OVX和STZ+OVX组中3项指标的表达均显著增加,且OVX, STZ+OVX组变化更明显,差异有统计学意义(P=0.000);采用利拉鲁肽干预后,同STZ组比较,3项指标在STZ+LRG组中的表达明显下降,同STZ+OVX组比较,3项指标在STZ+OVX+LRG组中的表达亦显著降低,差异均有统计学意义(P<0.05)(表 2)。
| 组别 | TNF-α | IL-1β | IL-6 |
| Sham | 31.337±5.549 | 97.241±15.014 | 66.444±12.098 |
| STZ | 118.316±13.819* | 466.315±61.051* | 291.333±39.401** |
| STZ+LRG | 63.142±6.616## | 282.611±47.778# | 105.778±14.912## |
| OVX | 155.469±20.181** | 577.426±85.419** | 305.333±45.023** |
| STZ+OVX | 170.226±20.838** | 898.907±120.744** | 585.111±102.453** |
| STZ+OVX+LRG | 97.344±13.622△ | 498.537±61.024△△ | 309.778±34.912△ |
| Sham:假手术;STZ:键脲佐菌素;LRG:利拉鲁肽;OVX:卵巢切除;TNF-α:肿瘤坏死因子α;IL-1β:白细胞介素1β;与Sham组比较,*P<0.05, **P<0.000;与STZ组比较,#P<0.05,##P<0.01;与STZ+OVX组比较,△P<0.05,△△P<0.01 | |||
与Sham组比较,STZ、OVX和STZ+OVX组中抗氧化酶SOD的活力显著下降,氧化应激产物MDA和ROS的含量显著增加,且OVX组、STZ+OVX组各指标变化更明显,差异有统计学意义(P<0.05);采用利拉鲁肽干预后,同STZ组比较,STZ+LRG组中SOD的活力显著上升,MDA和ROS的含量明显下降;同STZ+OVX组比较,STZ+OVX+LRG组中SOD的活力明显上升,MDA和ROS的含量亦显著下降,差异均有统计学意义(P<0.05)(表 3)。
| 组别 | SOD(U/mg) | MDA(nmol/mg) | ROS(荧光强度) |
| Sham | 14.248±2.293 | 3.419±0.907 | 22 486.333±3 430.400 |
| STZ | 7.430±1.490* | 6.818±1.234* | 41 523.000±7 068.545* |
| STZ+LRG | 12.014±1.499# | 4.149±0.963# | 28 747.000±3 233.060# |
| OVX | 4.998±0.883** | 7.337±0.835** | 45 976.667±5 836.439** |
| STZ+OVX | 2.466±0.633** | 8.738±1.494** | 55 642.667±6 935.062** |
| STZ+OVX+LRG | 7.430±1.567△△ | 5.385±1.164△ | 35 803.667±4 729.210△ |
| Sham:假手术;STZ:键脲佐菌素;LRG:利拉鲁肽;OVX:卵巢切除;SOD:超氧化物歧化酶;MDA:丙二醛;ROS:活性氧;与Sham组比较,*P<0.05,**P<0.01;与STZ组比较,#P<0.05;与STZ+OVX组比较,△P<0.05,△△P<0.01 | |||
RT-PCR检测股骨组织中抗氧化指标Nrf2、HO-1 mRNA的表达,同Sham组比较,两指标在STZ组、OVX组和STZ+OVX组中的表达显著增加,很可能是大鼠对外界不良环境的应激反应;采用利拉鲁肽干预后,同STZ组比较,STZ+LRG组中两指标的表达明显上升,同STZ+OVX组比较,两指标在STZ+OVX+LRG组中的表达亦显著升高,差异均有统计学意义(P<0.001)(图 1)。
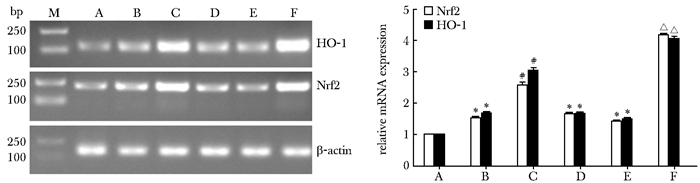
|
| 图 1 RT-PCR检测Nrf2、HO-1 mRNA的表达 Figure 1 Nrf2, HO-1 mRNA expression detected by RT-PCR A:Sham组;B:STZ组:C:STZ+LRG组:D:OVX组;E:STZ+OVX组;F:STZ+OVX+LRG组;STZ:键脲佐菌素;LRG:利拉鲁肽;OVX:卵巢切除;与Sham组比较,*P=0.000;与STZ组比较,#P=0.000;与STZ+OVX组比较,△P=0.000 |
采用HE染色观察股骨组织病理学变化,同Sham组比较,STZ和OVX组中骨小梁排列紊乱,数量减少,变细,发生断裂,空洞增多,STZ+OVX组中这种病理变化更加严重;给予利拉鲁肽干预8周后,STZ+LRG组和STZ+OVX+LRG组中均有不同程度的新生骨小梁形成,数量增多,变宽,厚度增加。此外,STZ、OVX、STZ+OVX组中成骨细胞数量显著减少,STZ+OVX组相对于STZ、OVX组更加严重,而利拉鲁肽可以显著促进成骨细胞增生(图 2)。
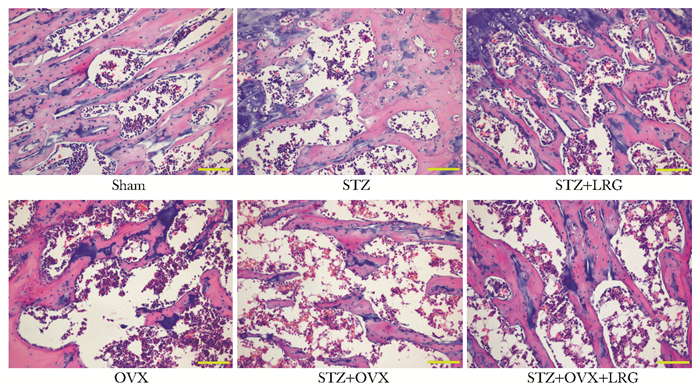
|
| 图 2 HE染色观察股骨组织病理学变化(×200) Figure 2 Pathological changes of femoral tissue by HE staining(×200) Sham:假手术;STZ:键脲佐菌素;LRG:利拉鲁肽;OVX:卵巢切除 |
RT-PCR检测股骨组织中成骨标志物RUNX2、COL1A1 mRNA的表达。同Sham组比较,两项指标在STZ、OVX和STZ+OVX组中表达显著下降,且STZ+OVX组变化更明显,差异有统计学意义(P=0.000);采用利拉鲁肽干预后,同STZ组比较,两项指标在STZ+LRG组中的表达明显增加,同STZ+OVX组比较,两项指标在STZ+OVX+LRG组中的表达亦显著升高,差异均有统计学意义(P<0.01)(图 3)。
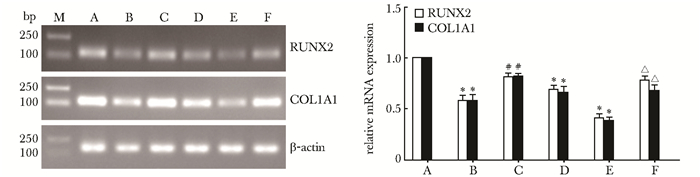
|
| 图 3 RT-PCR检测RUNX2、COL1A1 mRNA的表达 Figure 3 RUNX2, COL1A1 mRNA expression detected by RT-PCR A:Sham组;B:STZ组;C:STZ+LRG组;D:OVX组;E:STZ+OVX组;F:STZ+OVX+LRG组;与Sham组比较,*P=0.000;与STZ组比较,#P<0.01;与STZ+OVX组比较,△P<0.01 |
近年越来越多的研究报道,糖尿病患者经常伴有骨代谢异常,出现不同程度的骨密度下降。糖尿病患者中约50 %后并骨质疏松症[6];1型糖尿病患者骨折的发生概率比非糖尿病人群高6.3~6.9倍,比2型糖尿病患者高1.4~1.7倍[7],老年女性相对于男性骨质丢失更快,更易发生骨折[8]。而患者一旦发生骨折,致残率和病死率极高,严重影响生活质量。故深入探索糖尿病并骨质疏松症的发病机制,研发有效临床药物具有重要意义。
LRG是人工合成的GLP-1长效类似物,现有研究证实,接受LRG治疗的个体发生骨折的风险明显降低[2];减肥女性持续接受LRG治疗52周后骨生成增加16 %,并有效避免了低热量饮食引起的骨流失[9];糖尿病小鼠腹腔注射LRG可以预防骨丢失,对抗骨质退化[10];此外,在卵巢切除诱导的非糖尿病骨质疏松小鼠模型中,LRG可以有效增加骨密度和改善骨结构,促进骨形成[3]。提示利拉鲁肽参与骨代谢的调控,然而其对糖尿病并发骨质疏松症的影响目前国内外尚未见报道。本研究通过建立糖尿病、卵巢切除及糖尿病并发卵巢切除大鼠模型,探索其对糖尿病骨质疏松大鼠骨代谢的影响,并初步明确其分子机制。
本研究结果显示,利拉鲁肽可以显著增加成骨细胞数量,促进新生骨小梁形成,增加骨小梁厚度,改善骨小梁结构,同时诱导股骨组织中成骨标志物RUNX2、COL1A1 mRNA的表达。说明利拉鲁肽对糖尿病并发骨质疏松具有一定的预防作用,且该作用至少部分同骨代谢相关指标RUNX2、COL1A1的表达紧密相关。
研究显示,糖尿病骨质疏松大鼠模型中,DNA氧化损伤产物8-羟化脱氧鸟苷(8-hydroxy-2'-deoxyguanosine,8-OHdG)的表达和炎性反应标志物C反应蛋白(C-reactive protein, CRP)的释放显著增加[11];高糖诱导小鼠的成骨细胞MC3T3-E1内,活性氧(reactive oxygen specie,ROS)大量堆积,促进成骨标志蛋白Runx2、osterix、osteocalcin的表达显著下降[12],提示氧化应激促进糖尿病并发骨质疏松的进展。本研究结果显示,利拉鲁肽能够显著减少脂质过氧化代谢产物MDA和ROS的表达,增加抗氧化酶SOD的活性,同时促进抗氧化信号通路相关指标Nrf2和HO-1的表达,最终减轻氧化应激诱导的损伤。初步证明利拉鲁肽对糖尿病性骨质疏松的改善作用,且该作用至少部分伴随氧化应激水平变化。
此外,研究发现在绝经后骨质疏松患者中,血清IL-1β、IL-6被大量释放,osteocalcin表达显著下降[13]。炎性因子IL-6、TNF-α、INF-γ在卵巢切除大鼠模型中的表达显著增加,且同骨密度呈负相关[14]。说明炎性反应在糖尿病并发骨质疏松症的发生进展中扮演重要角色。本研究结果显示,利拉鲁肽能够降低TNF-α、IL-1β、IL-6的表达,有效抑制大鼠体内炎性反应;初步证明利拉鲁肽对糖尿病并发骨质疏松症的改善作用,且该作用至少部分伴随炎性反应改变。
综上所述,利拉鲁肽对糖尿病并发卵巢切除诱导的骨质恶化具有一定的预防作用,能够调节骨代谢,促进骨生成,改变骨结构,且该作用伴随炎症反应、氧化应激和Nrf2/HO-1信号通路活性改变。
| [1] | Zhang Y, Liu M, Li H, et al. Traditional Chinese medicine Bushen-Jianpi-Huoxue decoction prevents diabetic osteoporosis in rats via Wnt and nuclear factor-kappa B signaling pathways[J]. Int J Rheum Dis, 2017, 20: 941–948. DOI:10.1111/apl.2017.20.issue-8 |
| [2] | Su B, Sheng H, Zhang M, et al. Risk of bone fractures associated with glucagon-like peptide-1 receptor agonists' treatment:a meta-analysis of randomized controlled trials[J]. Endocrine, 2015, 48: 107–115. DOI:10.1007/s12020-014-0361-4 |
| [3] | Pereira M, Jeyabalan J, Jorgensen CS, et al. Chronic administration of Glucagon-like peptide-1 receptor agonists improves trabecular bone mass and architecture in ovariectomised mice[J]. Bone, 2015, 81: 459–467. DOI:10.1016/j.bone.2015.08.006 |
| [4] | Lu N, Sun H, Yu J, et al. Glucagon-like peptide-1 receptor agonist Liraglutide has anabolic bone effects in ovariectomized rats without diabetes[J]. PLoS One, 2015, 10: e0132744. DOI:10.1371/journal.pone.0132744 |
| [5] | Sun HX, Lu N, Luo X, et al. Liraglutide, the glucagon-like peptide-1 receptor agonist, has anabolic bone effects in diabetic Goto-Kakizaki rats[J]. J Diabetes, 2015, 7: 584–588. DOI:10.1111/1753-0407.12282 |
| [6] | Levin ME, Boisseau VC, Avioli LV. Effects of diabetes mellitus on bone mass in juvenile and adult-onset diabetes[J]. New Engl J Med, 1976, 294: 241–245. DOI:10.1056/NEJM197601292940502 |
| [7] | Janghorbani M, Van Dam RM, Willett WC, et al. Systematic review of type 1 and type 2 diabetes mellitus and risk of fracture[J]. Am J Epidemiol, 2007, 166: 495–505. DOI:10.1093/aje/kwm106 |
| [8] | Zhang YX, Min SX. Analysis of clinical factors correlating with osteoporosis in patients with type 2 diabetes mellitus[J]. Nanfang Yike Daxue Xuebao, 2016, 36: 1546–1549. |
| [9] | Iepsen EW, Lundgren JR, Hartmann B, et al. GLP-1 receptor agonist treatment increases bone formation and prevents bone loss in weight-reduced obese women[J]. J Clin Endocrinol Metab, 2015, 100: 2909–2917. DOI:10.1210/jc.2015-1176 |
| [10] | Mansur SA, Mieczkowska A, Bouvard B, et al. Stable incretin mimetics counter rapid deterioration of bone quality in type 1 diabetes mellitus[J]. J Cell Physiol, 2015, 230: 3009–3018. DOI:10.1002/jcp.25033 |
| [11] | Wang T, Cai L, Wang Y, et al. The protective effects of silibinin in the treatment of streptozotocin-induced diabetic osteoporosis in rats[J]. Biomed Pharmacother, 2017, 89: 681–688. DOI:10.1016/j.biopha.2017.02.018 |
| [12] | Liu J, Yang J. Uncarboxylated osteocalcin inhibits high glucose-induced ROS production and stimulates osteoblastic differentiation by preventing the activation of PI3K/Akt in MC3T3-E1 cells[J]. Int J Mol Med, 2016, 37: 173–181. DOI:10.3892/ijmm.2015.2412 |
| [13] | Al-Daghri NM, Aziz I, Yakout S, et al. Inflammation as a contributing factor among postmenopausal Saudi women with osteoporosis[J]. Medicine (Baltimore), 2017, 96: e5780. DOI:10.1097/MD.0000000000005780 |
| [14] | Wang QL, Huo XC, Wang JH, et al. Rutin prevents the ovariectomy-induced osteoporosis in rats[J]. Eur Rev Med Pharmacol Sci, 2017, 21: 1911–1917. |
| (收稿日期:2017-05-02) |

