2. 362000 泉州,解放军第180医院医学影像科;
3. 362000 泉州,解放军第180医院骨二科
2. Department of Medical Imaging, The 180 th Hospital of PLA, Quanzhou 362000, Fujian, China;
3. Department of the Second Orthopaedic, The 180 th Hospital of PLA, Quanzhou 362000, Fujian, China
进行性骨化性纤维组织结构不良症(fibrodysplasia ossificans progressiva,FOP)是一种遗传性、进行性发展的结缔组织病,治疗效果不佳,预后差。该病虽然具有典型的临床表现:先天性第一趾畸形和进行性的异位骨化,但由于其十分罕见,极易错漏诊,应引起临床医生重视。
病历摘要患者男性,1979年出生,出生后即发现双足第一趾短小、外翻畸形。1984年无明显诱因腰背部出现梭形肿块,质韧,轻压痛,不活动,伴全身低热,发病2周后腰背部软组织肿胀有所消退,肿块变细,变硬,并延长轴向两端发展,随后双肩、双膝、双侧肋骨、右髋、左股骨中下段、颈后部等处逐渐出现同样类型的肿块,进展方式与腰背部相同,数月后逐渐形成长条形皮下硬节,以腰背部、左肩、右髋最明显,进行性活动受限,数年后完全受限,2001年以后病灶活动趋向稳定。在患病的20余年里,曾就诊于多家医院,先后诊断为“遗传性多发性骨软骨瘤病”、“强直性脊柱炎”等,并予消炎、激素、针灸、中药等多种治疗,无明显效果,病情逐渐加重。2006年就诊于解放军第180医院骨科门诊,诊断为“进行性骨化性纤维组织结构不良症”,未予特殊处理,离院时特别嘱咐患者及家属应避免软组织创伤和一切医源性有创性诊疗操作,并定期电话随访,病情长期稳定无进展。但因右肩关节内收严重影响生活质量,2012年在外院行“右肩松解术”,术后一段时间右肩活动受限有所改善,但数月后再次僵化且更加严重。2016年再次就诊于解放军第180医院骨科门诊,病情稳定,父母、一兄一弟、一子均无类似症状。
体格检查:体形消瘦、跛行步态;脊柱“S”状侧弯畸形,前曲后伸完全受限;颈胸腰背部、双肩、双髋、双膝周围表面可见索条状异位骨化,以胸腰背部明显,边界清楚,质地坚硬、无压痛;双足第一趾短小、外翻畸形(图 1),右锁骨下可见手术瘢痕;双肩活动受限,左肩前屈≤15°,外展≤10°,外旋≤15°,内旋≤15°,后伸0°;右肩术前前屈≤10°,外展≤15°,外旋≤10°,内旋≤15°,后伸0°;术后于解放军第180医院复查,右肩活动完全受限。双肘伸曲受限,屈曲≤20°旋转稍受限;双髋强直,活动受限,前屈、后伸、内收、外展、旋转均≤10°;双膝强直,活动受限,屈曲≤15°。
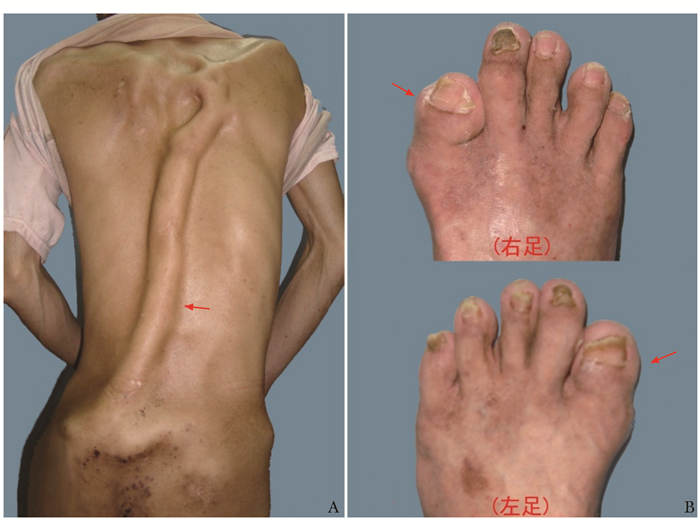
|
| 图 1 患者体格检查视诊图 Figure 1 Physical examination of this patient with FOP A:胸腰背部脊柱后方长条状异位骨化(箭头示)自胸背部延伸至臀部;B:双足第一趾短小、外翻畸形(箭头示);FOP:进行性骨化性纤维组织结构不良症 |
影像学检查X线摄片+CT骨三维重建:脊柱后、双肩、双髋、双膝周围软组织内大量异位化骨,以腰背部最明显(图 2)。薄层CT图像示异位化骨多发生于筋膜、韧带、肌膜、肌腱、肌鞘、腱膜、肌肉间纤维隔等结缔组织,而不是肌纤维本身(图 3)。
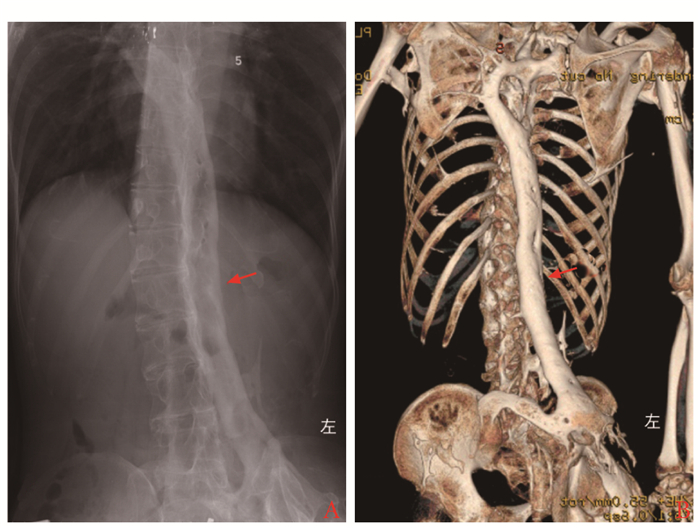
|
| 图 2 异位骨化影像学检查 Figure 2 Imageology examination of heterotopic ossifications A:胸腰背部X线平片示异位骨化呈长条状致密影;B:骨重建示异位骨化呈不规则的“工”形 |
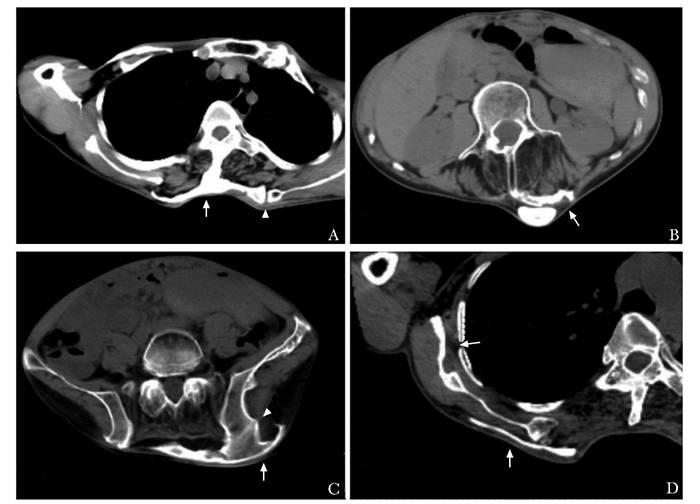
|
| 图 3 几个典型部位异位钙化的CT图像 Figure 3 CT images of ectopic calcification at several typical parts in this patient A:肩胛部位于斜方肌肌膜、棘上韧带(箭头),左侧与左肩胛上角形成假关节(三角箭头);B:腰背部位于皮下筋膜、竖脊肌肌膜、棘上韧带(箭头);C:臀部位于皮下筋膜(箭头),与髂骨形成骨性联合(三角箭头);D:右肩部位于皮下筋膜、大圆肌及肩胛下肌肌膜(箭头) |
实验室检查:免疫球蛋白、肌酶、血钙、磷均正常。血红细胞沉降率8 mm/h(0~20 mm/h),球蛋白29.4 g/L(25~40 g/L),C反应蛋白4.19 mg/L(0~10 mg/L),白蛋白40.3 g/L(35~50 g/L),骨钙素N端中分子片段(N-mid fragment of osteocalcin, N-MID OC)36.4 μg/L(11~43 μg/L),钙2.32 mmol/L(2.15~2.65 mmol/L),磷1.39 mmol/L(0.86~1.86 mmol/L),碱性磷酸酶90 U/L(40.0~150.0 U/L),甲状旁腺素41.8 ng/L(15~65 ng/L),降钙素3.78 ng/L(0~6.4 ng/L), 尿素氮4.32 mmol/L 9(2.9~7.2 mmol/L),肌酐56.9 mmol/L(44~136 mmol/L)。
诊断:根据病史、临床表现及影像学检查,该患者诊断为FOP,未予特殊治疗。
讨论FOP是一种遗传性、进行性发展的结缔组织病。在我国,习惯将FOP称为进行性骨化性肌炎(myositis ossificans progressiva,MOP),这是早期的不恰当命名。FOP发病率极低,约为1/200万,无种族、性别和地域差别[1]。2006年Shore等[2]对5个FOP家系进行全基因组连锁分析, 最早发现常染色体2q23-q24上的ACVR1(activin A receptor type Ⅰ,ACVR1) 基因是该病的致病基因。异位骨化的形成,组织学上可分为3期:(1) 急性炎性反应期;(2) 纤维增生期;(3) 异位骨形成期,三期均有肥大细胞浸润,尤以第一期为甚[3]。FOP发生在含有纤维组织的筋膜、韧带、肌膜、肌腱、肌鞘、腱膜、肌肉间纤维隔等结缔组织,而不是肌纤维本身[4]。本例患者CT平扫横断面示异位骨化位于筋膜、肌膜、韧带等结缔组织组织而不是肌肉本身,符合该病特点。
FOP典型的临床表现就是先天性第一趾畸形和进行性的异位骨化;患者在出生时即有双侧第一趾缩短、外翻;异位骨化常呈自发性,按从上到下、背部到腹侧、从中轴到四周发展,并进行性加重[2, 5]。包和婧等[6]统计我国1979~2012年报道的104例患者,64.4%在0~8岁发病,第一趾畸形占60%,异位骨化累及颈部占63%,累积脊柱占56%;患者多表现为反复出现的软组织肿块,消退变硬后形成异位骨化,接着在新的部位又出现类似肿块,转归同前,病情反复发作,进行性加重,直至累及各个大小关节,最终丧失活动能力。本例患者幼年起病,异位骨化进行性加重,以腰背为首发且最重,伴第一趾畸形,符合本病特征。张浩等[7]统计我国1979~2002年报道的51例FOP患者,发病年龄与诊断年龄差中位值为7.88年,其中15例采用手术方法治疗,55.56%患者术后在3、4个月内出现异位骨化复发。漫长的确诊过程和错漏诊后许多患者接受了有创性治疗,充分说明了我国医生对本病的认识是十分不足的。本例患者发病至确诊间隔长达23年,由于认识不足,确诊后5年仍进行手术治疗使得病情加重,与张浩等[7]报道吻合。
FOP目前治疗现状不乐观,主要采取的预防措施是早期诊断和避免外伤、医源性创伤性诊疗操作等导致异常骨化加重的刺激因素。国际FOP临床协会根据FOP的三期病理特征以及药物作用机制提出FOP三级药物治疗指南[8]:第一级药物主要包括非甾体类消炎止痛药和糖皮质激素;第二级药物有白三烯抑制剂、肥大细胞稳定剂和氨基二磷酸盐等;第三级药物是指尚在研究中的新药,如针对ACVR1信号传导通路的抑制剂和单克隆抗体等。但是这些方案的作者强调目前没有药品能够改变FOP的自然进程[9]。有报道FOP患者死亡年龄的中位数约为41岁,通常死于胸部肌肉受到广泛侵犯至胸廓机能不全所导致的感染或呼吸衰竭[10]。
综上所述,FOP是一种罕见的、进行性发展的结缔组织疾病,治疗效果不佳、预后差、致畸致残率很高。改善治疗方法、延缓病程发展、提高生活质量等是FOP未来的研究目标。
| [1] | Hebela N, Shore EM, Kaplan FS. Three pairs of monozygotic twins with fibrodysplasia ossificans progressive:the role of environment in the progression of heterotopic ossification[J]. Clin Rev Bone Miner Metab, 2005, 3: 205–208. DOI:10.1385/BMM:3:3-4 |
| [2] | Shore EM, Xu M, Feldman GJ, et al. A recurrent mutation in the BMP type Ⅰ receptor ACVR1 causes inherited and sporadic fibrodysplasia ossificans progressive[J]. NaGenet, 2006, 38: 525–527. |
| [3] | Pignolo RJ, Suda RK, Kaplan FS. The fibrodysplasia ossificans progressiva lesion[J]. Clin Rev Bone Miner Metab, 2005, 3: 195–200. DOI:10.1385/BMM:3:3-4 |
| [4] | Royce PM, Steinmann B.Connective tissue and its heritable disorders[M]. New York: Wiley-Liss, Inc, 2002: 827-840. |
| [5] | Kaplan FS, Xu M, Glaser DL, et al. Early diagnosis of fibrodysplasia ossificans progressiva[J]. Pediatrics, 2008, 121: 295–300. |
| [6] | 包和婧, 朱立新, 杨联军, 等. 我国进行性骨化性肌炎104例文献分析[J]. 分子影像学杂志, 2015, 38: 365–386. |
| [7] | 张浩, 金大地, 景宗森, 等. 进行性骨化性肌炎51例中国文献报道的综合分析[J]. 中国临床康复, 2002, 6: 3384–3385. DOI:10.3321/j.issn:1673-8225.2002.22.049 |
| [8] | Kaplan FS, Shore EM, Glaser DL, et al. The medical management of fibrodysplasia ossificans progressive current treatment considerations[J]. Clin Proc Intl Consort FOP, 2005, 1: 1–71. |
| [9] | Glaser DL, Kaplan FS. Treatment considerations for the management of fibrodysplasia ossificans progressive[J]. Clin Rev Bone Miner Metabol, 2005, 3: 243–250. DOI:10.1385/BMM:3:3-4 |
| [10] | Kaplan FS, Glaser DL, Shore EM. The phenotypeof fibrodysplasia ossificansprogressiva[J]. Clin Rev Bone Miner Metab, 2005, 3: 183–188. DOI:10.1385/BMM:3:3-4 |
| (收稿日期:2016-09-20) |

