2. 100043 北京,首都医科大学北京朝阳医院内分泌科
2. Department of Endocrinology, Beijing Chaoyang Hospital, Capital Medical University, Beijing 100043, China
据调查估计,全球已有超过10亿人存在维生素D缺乏或不足[1],研究显示,维生素D缺乏的检出率在青年人群中也达40%~90%[2-5]。不少成人观察性研究发现,维生素D缺乏与2型糖尿病(type 2 diabetes mellitus,T2DM)及代谢综合征的发病风险相关[6],然而有关维生素D缺乏与中国青年人群糖代谢的关系仍缺乏研究[7]。本研究基于北京儿童和青少年代谢综合征研究(BCAMS)队列,探讨北京地区青年人群血清25-羟维生素D(25-hydroxy vitamin D,25OHD)水平及其与糖代谢相关指标的关系。
对象和方法对象
本研究人群来自北京儿童和青少年代谢综合征研究队列,该研究于2004年4-10月进行,按照分层随机整群抽样方法,依据北京市行政区划,按城乡、分层,随机抽取4个城区(西城、东城、朝阳、海淀)和3个郊区/县(大兴、平谷、延庆)开展调查。在上述抽取的7个区/县内,分别以街道社区、幼儿园、小学、中学为抽样单位进行随机整群抽样,凡抽样单位内的适龄儿童青少年均为调查对象,包含了19 593名4~18岁的儿童青少年人群。在此研究的基础上,2014年在北京朝阳医院对该人群进行10年后为期18个月的随访,共随访517名青年人群,年龄14~28岁,平均年龄20.1岁;其中男性271名(52%),女性246名(48%),均除外肝肾功能不全、恶性肿瘤和正在服用影响骨代谢的药物(糖皮质激素、降钙素、维生素D类似物和双膦酸盐等)者。本研究经北京朝阳医院伦理委员会批准。所有受试者均签署知情同意书。
测量方法
临床指标:研究对象均禁食10 h后,于清晨空腹、单衣、免冠、脱鞋后测量身高、体质量和腰围。体质量及体脂百分比(percent body fat,Fat%)采用生物阻抗法由TANITA体成分分析仪测得(Model TBF-300A)。
采集空腹静脉血测定血糖、糖化血红蛋白(glycosylated hemoglobin,HbA1c)、胰岛素和血清25OHD浓度。行2 h 75 g口服葡萄糖耐量试验(oral glucose tolerance test,OGTT),从服糖第一口开始计时,于服糖后0.5和2 h再次静脉采血,测定血糖和胰岛素水平。血糖使用Hitachi7060全自动生化分析仪测定。HbA1c采用TOSOH G7自动分析系统测定。胰岛素由北京协和医院内分泌科重点实验室建立的单克隆抗体酶联免疫吸附试验测定[8],批间变异系数<9.0%。血清25OHD由北京朝阳医院采用测定范围为3.0~70.0 ng/mL的全自动电化学发光免疫分析仪(electro-chemiluminescene immunoassay, ECLIA)检测,批内和批间变异系数分别<6.8%和<7.5%。通过问卷调查获得研究对象的光照时间。
计算指标:体质量指数[body mass index,BMI,BMI=体质量(kg)/身高(m)2];胰岛素抵抗的评价指标:胰岛素抵抗指数[homeostasis model assessment of insulin resistance,HOMA-IR,HOMA-IR=空腹胰岛素(mU/L)×空腹血糖(mmol/L)/22.5]和胰岛素敏感指数〔insulin sensitivity index,ISI,ISI=10 000/[空腹血糖(mmol/L)×空腹胰岛素(mU/L)×平均血糖(mmol/L)×平均胰岛素(mU/L)]〕;胰岛β细胞分泌功能的评价指标:胰岛β细胞功能指数[HOMA-β,HOMA-β=20×空腹胰岛素(mU/L)/(空腹血糖(mmol/L)-3.5[9]、胰岛素生成指数(insulinogenic index,IGI,IGI=糖负荷后0.5 h胰岛素增量/糖负荷后0.5 h葡萄糖增量)和葡萄糖处置指数(oral disposition index,DIO,DIO=IGI × ISI[10]);根据近似梯形法计算的2 h糖负荷后葡萄糖曲线下面积(area under the curve glucose, AUC)和胰岛素曲线下面积。
诊断标准
超重:24 kg/m2 ≤ BMI<28 kg/m2;肥胖:BMI ≥ 28 kg/m2[11]。
空腹血糖受损(impaired fasting glucose, IFG):5.6 mmol/L<空腹血糖<6.9 mmol/L;糖耐量减低(impaired glucose tolerance, IGT):7.8 mmol/L<2 h血糖<11.0 mmol/L;糖尿病前期:IFG/IGT;T2DM:空腹血糖≥7.0 mmol/L或者2 h血糖≥11.1 mmol/L[12]。
维生素D营养状态评估:(1) 维生素D充足:25OHD≥75 nmol/L;(2) 维生素D不足:50 nmol/L≤25OHD<75 nmol/L;(3) 维生素D缺乏:25OHD<50 nmol/L[13]。
统计学方法
采用SPSS 19.0进行数据分析。非正态分布数据均行自然对数转换,计数资料比较采用χ2检验;计量资料的成组比较采用协方差分析;采用偏相关分析维生素D与各代谢指标的相关性。以P<0.05为差异有统计学意义。
结果人群特征及维生素D状态
本研究共纳入517例青年人群超重、肥胖、IFG/IGT和T2DM的检出率分别为24.6%、32.3%、10.3%和1.5%;血清25OHD平均水平为(37.8±14.9) nmol/L[男性(42.0±15.8) nmol/L,女性(33.0±12.2) nmol/L]。维生素D缺乏、不足和充足的检出比例存在明显性别差异,其中男性分别为69.0%、26.9%和4.1%,女性分别为89.4%、10.6%和0%。总人群维生素D缺乏的检出率高达78.7%,且检出率随糖耐量异常程度的加重呈升高趋势,糖耐量正常78.3%、糖尿病前期81.1%、T2DM 87.5%(表 1)。
| 对象 | n | 年龄(岁) | 性别 | 体质量 | 糖代谢 | |||||
| 男 | 女 | 正常 | 超重 | 肥胖 | 糖耐量正常 | 糖尿病前期 | T2DM | |||
| 全人群 | 517 | 20.1±2.9 | 271 | 246 | 223 | 127 | 167 | 456 | 53 | 8 |
| 维生素D缺乏组 | 407 | 20.2±2.9 | 187 (69.0) | 220 (89.4) | 184 (82.5) | 93 (73.2) | 130 (77.8) | 357 (78.3) | 43 (81.1) | 7 (87.5) |
| 维生素D不足组 | 99 | 9.5±3.0 | 73 (26.9) | 26 (10.6) | 37 (16.6) | 30 (23.6) | 32 (19.2) | 90 (19.7) | 8 (15.1) | 1 (12.5) |
| 维生素D充足组 | 11 | 120.3±2.8 | 11 (4.1) | 0 (0) | 2 (0.9) | 4 (3.1) | 5 (3.0) | 9 (2.0) | 2 (3.8) | 0 (0) |
| P值 | 0.124 | 0.215 | 0.782 | |||||||
| T2DM:2型糖尿病 | ||||||||||
25OHD与肥胖及糖代谢指标的偏相关分析
校正性别、年龄和日照时间的偏相关分析显示,血清25OHD水平与BMI、腰围及Fat%的相关性差异无统计学意义(P>0.05),但与空腹血血糖(r=-0.088,P=0.046)、2 h血糖(r=-0.128,P=0.004) 及HbA1c(r=-0.088,P=0.047) 呈负相关。进一步调整Fat%后,血清25OHD除仍与2 h血糖(r=-0.120,P=0.007) 呈负相关外,还与胰岛素分泌水平0.5 h胰岛素(r=0.091,P=0.042) 呈正相关,但与胰岛素抵抗相关指标未见明显相关趋势(P>0.05)(表 2)。
| 变量 | r1 | P1 | r2 | P2 |
| 肥胖指标 | ||||
| Fat% | -0.083 | 0.061 | - | - |
| BMI(kg/m2) | -0.064 | 0.145 | 0.027 | 0.550 |
| 腰围(cm) | -0.050 | 0.255 | 0.038 | 0.391 |
| 糖代谢指标 | ||||
| 空腹血糖(mmol/L) | -0.088 | 0.046 | -0.083 | 0.061 |
| 0.5 h血糖(mmol/L) | -0.039 | 0.379 | -0.032 | 0.477 |
| 2 h血糖(mmol/L) | -0.128 | 0.004 | -0.120 | 0.007 |
| HbA1c(%) | -0.088 | 0.047 | -0.082 | 0.064 |
| 空腹胰岛素(mU/L)* | -0.053 | 0.232 | -0.002 | 0.972 |
| 0.5 h胰岛素(mU/L)* | 0.057 | 0.205 | 0.091 | 0.042 |
| 2 h胰岛素(mU/L)* | -0.042 | 0.340 | -0.010 | 0.814 |
| HOMA-IR* | -0.061 | 0.169 | -0.013 | 0.767 |
| ISI* | 0.024 | 0.597 | -0.031 | 0.490 |
| HOMA-β* | -0.030 | 0.493 | 0.021 | 0.633 |
| IGI* | 0.057 | 0.207 | 0.081 | 0.073 |
| DIO* | 0.070 | 0.119 | 0.053 | 0.241 |
| AUCglucose* | -0.073 | 0.099 | -0.062 | 0.165 |
| AUCinsulin* | 0.030 | 0.499 | 0.073 | 0.103 |
| 25OHD:25羟维生素D; P1:校正性别、年龄和日照时间;P2:校正性别、年龄、日照时间和Fat%;Fat%:体脂百分比;BMI:体质量指数;HbA1c:糖化血红蛋白;HOMA-IR:胰岛素抵抗指数;ISI:胰岛素敏感指数;HOMA-β:胰岛β细胞功能指数;IGI:胰岛素生成指数;DIO:葡萄糖处置指数;AUCglucose:2 h糖负荷后葡萄糖曲线下面积;AUCinsulin:2 h糖负荷后胰岛素曲线下面积; *自然对数转换 | ||||
25OHD与糖代谢状态的协方差分析
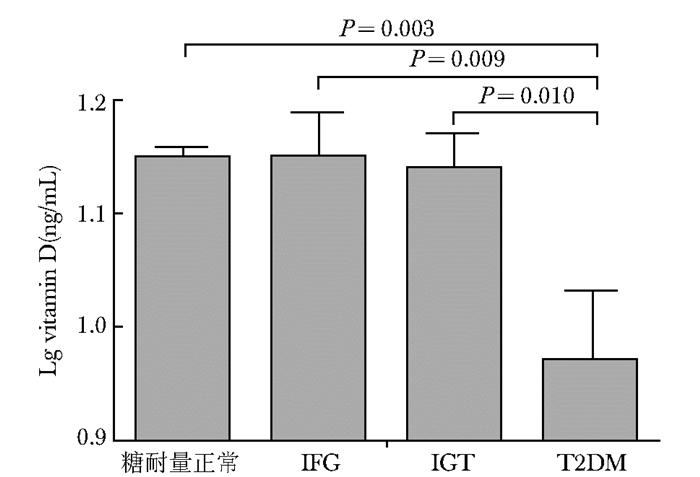
调整性别、年龄和日照时间后,T2DM患者25OHD水平明显低于糖耐量正常(P=0.004)、IFG(P=0.014) 及IGT(P=0.013) 人群。进一步调整Fat%后,T2DM患者血清25OHD水平仍明显低于糖耐量正常(P=0.003)、IFG(P=0.009) 和IGT(P=0.010) 人群(图 1)。本研究糖尿病前期与糖耐量正常人群血清25OHD水平比较,差异无统计学意义(P>0.05)。
|
| 图 1 校正性别、年龄、日照时间和Fat%后不同糖代谢状态下的维生素D水平 Figure 1 Levels of vitamin D in different blood glucose metabolic status after adjusting for age, gender, sun exposure, and Fat% Fat%:体脂百分比;IFG:空腹血糖受损;IGT:糖耐量减低;T2DM:2型糖尿病 |
目前调查结果显示维生素D缺乏在世界范围内普遍存在[1]。我国青年人群维生素D缺乏的检出率也较高,且呈明显南、北地域差异[2-5]。一项来自杭州183名12~16岁青年人群的调查发现,维生素D缺乏的检出率为46%,且女孩25OHD平均水平(48.0 nmol/L)较男孩(53.5 nmol/L)低[3];另一项对上海市538名9~15岁儿童青少年的调查也同样发现,维生素D缺乏的检出率为42.4%,且女孩25OHD平均水平(47.5 nmol/L)也较男孩(56.0 nmol/L)低[4];而一项来自2009年北京地区对323名平均年龄15岁女孩的调查发现[5],维生素D缺乏率高达89.2%,25OHD平均水平33.0 nmol/L,明显低于前述南方地区人群的水平。这与本研究对北京地区平均年龄20.1岁的青年人群调查结果显示女性维生素D缺乏率89.4%(25OHD平均水平33.0 nmol/L)惊人一致。本研究还发现男性青年人群维生素D缺乏率也高达69.0%。可见我国北方地区青年人群血清25OHD水平缺乏的状况更为普遍,尤其是女性,其原因可能与北方地区日照较少有关。
国外不少成人[6]以及为数不多的青年人群[14]调查结果均显示,低水平的维生素D与T2DM的发病相关,国内成人研究也有类似结果[15],本研究在青年人群中也发现,血清25OHD水平与OGTT血糖及HbA1c水平呈负相关,与胰岛素分泌水平存在正相关趋势;在校正肥胖因素后,血清25OHD水平在T2DM患者明显降低,提示血清25OHD水平缺乏与青年T2DM相关。本人群T2DM样本量少,还需要大样本人群研究进行验证。
维生素D影响糖代谢的机制目前仍不明了。胰岛素抵抗和胰岛β细胞的功能受损是T2DM发病的两个重要因素。目前的机制研究发现,维生素D可通过其在肌肉、肝脏及胰岛细胞上的维生素D受体调节细胞内外钙离子水平以及影响炎性反应等途径直接或间接影响胰岛素敏感性以及胰岛β细胞的分泌功能,维生素D缺乏则可能通过加重胰岛素抵抗以及使得胰岛β细胞的功能受损最终导致糖代谢紊乱,增加T2DM的发病风险[16]。在横断面人群研究中,Chiu等[17]和Kayaniyil等[18]分别使用高糖钳夹技术和OGTT发现血清25OHD水平与胰岛素敏感性及胰岛β细胞功能指标相关。近来,基于维生素D缺乏与T2DM可能存在的因果关联,国外陆续有报道针对糖尿病高危人群进行维生素D干预的临床研究,试图探究补充维生素D对改善胰岛素抵抗和胰岛β细胞功能的直接作用,然而结果不尽相同[19-20]。一项对22例糖尿病前期人群(平均年龄57岁)进行每天2 000 IU共16周维生素D3干预后的结果发现,其胰岛素分泌增加,胰岛β细胞功能改善,但胰岛素敏感性未见明显变化[19];而另一项针对21例年龄更大的糖尿病前期人群(平均年龄67岁)进行每周30 000 IU共8周维生素D3干预后的研究发现,其胰岛素敏感性及胰岛β细胞功能均无明显改善[20]。本研究虽未发现血清25OHD水平与胰岛素抵抗指标之间的相关性,但其与OGTT中0.5 h胰岛素及胰岛素分泌指数IGI存在一定的相关性,提示维生素D缺乏可能影响胰岛细胞的分泌功能。
综上,本研究证实北京地区青年人群维生素D缺乏普遍存在,且女性较男性更为严重。本研究显示T2DM患者血清25OHD水平降低,与胰岛β细胞分泌功能受损可能存在一定的相关性,但本研究为横断面研究,维生素D缺乏在青年人群T2DM的发生、发展机制中的作用尚需大样本的纵向研究予以明确。
| [1] | James WP. 22nd Marabou Symposium:the changing faces of vitamin D[J]. Nutr Rev, 2008, 66: 286–290. DOI:10.1111/j.1753-4887.2008.00034.x |
| [2] | Zhang W, Stoecklin E, Eggersdorfer M. A glimpse of vitamin D status in Mainland China[J]. Nutrition, 2013, 29: 953–957. DOI:10.1016/j.nut.2013.01.010 |
| [3] | Zhu Z, Zhan J, Shao J, et al. High prevalence of vitamin D deficiency among children aged 1 month to 16 years in Hangzhou, China[J]. BMC Public Health, 2012, 12: 126. DOI:10.1186/1471-2458-12-126 |
| [4] | 龚春丹. 糖脂代谢与维生素D营养状况相关性的儿童青少年人群研究及动物研究[D]. 上海: 复旦大学, 2014. http://cdmd.cnki.com.cn/Article/CDMD-10246-1015410844.htm |
| [5] | Foo LH, Zhang Q, Zhu K, et al. Relationship between vitamin D status, body composition and physical exercise of adolescent girls in Beijing[J]. Osteoporos Int, 2009, 20: 417–425. DOI:10.1007/s00198-008-0667-2 |
| [6] | Pittas AG, Lau J, Hu FB, et al. The role of vitamin D and calcium in type 2 diabetes. A systematic review and meta-analysis[J]. J Clin Endocrinol Metab, 2007, 92: 2017–2029. DOI:10.1210/jc.2007-0298 |
| [7] | Choi DP, Oh SM, Lee J M, et al. Serum 25-hydroxyvitamin D and insulin resistance in apparently healthy adolescents[J]. PLoS One, 2014, 9: e103108. DOI:10.1371/journal.pone.0103108 |
| [8] | Li M, Fisette A, Zhao XY, et al. Serum resistin correlates with central obesity but weakly with insulin resistance in Chinese children and adolescents[J]. Int J Obes (Lond), 2009, 33: 424–439. DOI:10.1038/ijo.2009.44 |
| [9] | Matthews DR, Hosker JP, Rudenski AS, et al. Homeostasis model assessment:insulin resistance and beta-cell function from fasting plasma glucose and insulin concentrations in man[J]. Diabetologia, 1985, 28: 412–419. DOI:10.1007/BF00280883 |
| [10] | Billings LK, Jablonski KA, Ackerman RJ, et al. The influence of rare genetic variation in SLC30A8 on diabetes incidence and β-cell function[J]. J Clin Endocrinol Metab, 2014, 99: E926–930. DOI:10.1210/jc.2013-2378 |
| [11] | 《中国成人超重和肥胖症预防与控制指南》编写组. 中国成人超重和肥胖预防控制指南(试行)[M]. 中华人民共和国卫生部疾病控制司, 2003. http://guide.medlive.cn/guideline/4056 |
| [12] | AD Association ${referAuthorVo.mingEn}. Standards of medical care in diabetes-2013[J]. Diabetes Care, 2013, 36: S11–66. DOI:10.2337/dc13-S011 |
| [13] | Holick MF, Binkley NC, Bischoff-Ferrari HA, et al. Evaluation, treatment, and prevention of vitamin D deficiency:an Endocrine Society clinical practice guideline[J]. J Clin Endocrinol Metab, 2011, 96: 1911–1930. DOI:10.1210/jc.2011-0385 |
| [14] | Peterson CA, Tosh AK, Belenchia AM. Vitamin D insufficiency and insulin resistance in obese adolescents[J]. Ther Adv Endocrinol Metab, 2014, 5: 166–189. DOI:10.1177/2042018814547205 |
| [15] | Zhang J, Ye J, Guo G, et al. Vitamin D status is negatively correlated with insulin resistance in chinese type 2 diabetes[J]. Int J Endocrinol, 2016, 2016: 1794894. |
| [16] | Mathieu C. Vitamin D and diabetes:where do we stand?[J]. Diabetes Res Clin Pract, 2015, 108: 201–209. DOI:10.1016/j.diabres.2015.01.036 |
| [17] | Chiu KC, Chu A, Go VL, et al. Hypovitaminosis D is associated with insulin resistance and beta cell dysfunction[J]. Am J Clin Nutr, 2004, 79: 820–825. |
| [18] | Kayaniyil S, Vieth R, Retnakaran R, et al. Association of vitamin D with insulin resistance and beta-cell dysfunction in subjects at risk for type 2 diabetes[J]. Diabetes Care, 2010, 33: 1379–1381. DOI:10.2337/dc09-2321 |
| [19] | Mitri J, Dawson-Hughes B, Hu FB, et al. Effects of vitamin D and calcium supplementation on pancreatic beta cell function, insulin sensitivity, and glycemia in adults at high risk of diabetes:the calcium and vitamin D for diabetes mellitus (CaDDM) randomized controlled trial[J]. Am J Clin Nutr, 2011, 94: 486–494. DOI:10.3945/ajcn.111.011684 |
| [20] | Wagner H, Alvarsson M, Mannheimer B, et al. No effect of high-dose vitamin D treatment on beta-cell function, insulin sensitivity, or glucose homeostasis in subjects with abnormal glucose tolerance:a randomized clinical trial[J]. Diabetes Care, 2016, 39: 345–352. DOI:10.2337/dc15-1057 |
| (收稿日期:2016-08-26) |

