2. 315000 宁波,宁波市第二医院肾内科;
3. 213003 常州,苏州大学附属第三医院内分泌科
Werner综合征,又称“成人早老症”,是一种罕见的由WRN基因失活性突变导致的遗传综合征。该综合征在各个种族均有报道,而在国内甚为少见。Werner综合征临床谱广,在疾病发生发展的过程中可能就诊不同的科室,认识不足则容易导致误诊。本文报告一例以“身材矮小28年,双下肢关节疼痛伴行走困难2年”为主诉就诊的病例,以探讨遗传性疾病的诊断思路,为今后罕见病的基因诊断提供参考。
病例摘要患者,男,41岁,浙江籍,因“身材矮小28年,双下肢关节疼痛伴行走困难2年”于2014年11月25日就诊上海交通大学附属第六人民医院骨质疏松和骨病专科。患者上初中后身高明显矮于同龄人,一直坐在教室前排,当时未予重视未就诊。患者17岁时常感腹胀、恶心,经外院检查疑为“脂肪肝”。20岁余患者头发开始发白并脱落,且逐渐出现视物模糊,当地医院住院检查,诊断“男性性腺发育不全症,白内障,2型糖尿病,脂肪肝伴肝损害”。近10余年来,患者不规则服用降糖药物(具体不详),未监测血糖,偶见尿中泡沫增多。6年前,患者因有生育要求,在当地医生指导下,曾口服甲睾酮片2~3年(5~10 mg/d),生殖器能勃起,后因经济原因自行停药。近2年,患者劳累后出现双下肢关节疼痛,伴全身乏力,双膝关节正侧位X线片(外院)提示:双膝关节退行性改变,骨质疏松,予骨化三醇胶丸、碳酸钙片治疗,骨痛无缓解,来上海交通大学附属第六人民医院骨质疏松和骨病专科就诊。
既往史5年前,因车祸致左腕部骨折,未手术,愈合可;3年前,行“双侧隐睾切除术”,术后恢复可。生长发育史:出生身长与体质量不详,出生时外生殖器情况不详,未出现身高突长。婚育史:未婚未育。
家族史父母为旁系3代近亲婚配,有1个姐姐1个弟弟,父母及弟弟体健,其中父亲身高165 cm,母亲身高159 cm,弟弟身高170 cm。姐姐49岁,身高150 cm,体质量约40 kg,30岁因“双眼白内障”行晶体置换术,35岁怀孕,孕24周分娩,目前育有1子(14岁),体健(图 1)。
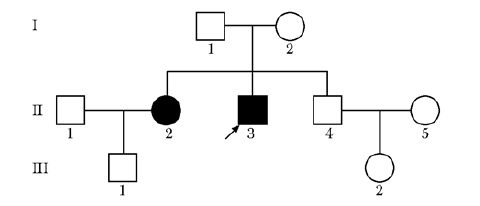
|
| 图 1 Werner综合征病例家系图 Figure 1 Pedigree of the patients with Werner syndrome 先证者(箭头)父母为近亲婚配,Ⅱ-2和Ⅱ-3为患者,余家族成员无类似疾病表现 |
身高150 cm,体质量42 kg,臂展160 cm,神志清,言语流利,反应欠灵敏,自主体位(图 2);四肢皮肤粗糙,皮下脂肪减少,弹性减退,头发稀疏,发根发白,无腋毛;双眼视力0.4,双侧眼球突出,粗测听力、嗅觉正常,牙列整齐,胡须稀疏,发音嘶哑;喉结不明显,双侧甲状腺未及肿大;胸廓及脊柱未见畸形,腹部膨隆,肝脾肋下未及;阴茎及阴囊未发育,阴茎长度和周径分别为2.1 cm和3.0 cm,双侧睾丸未触及,无阴毛;四肢骨骼无畸形,双膝关节屈曲受限,四肢肌力5级。
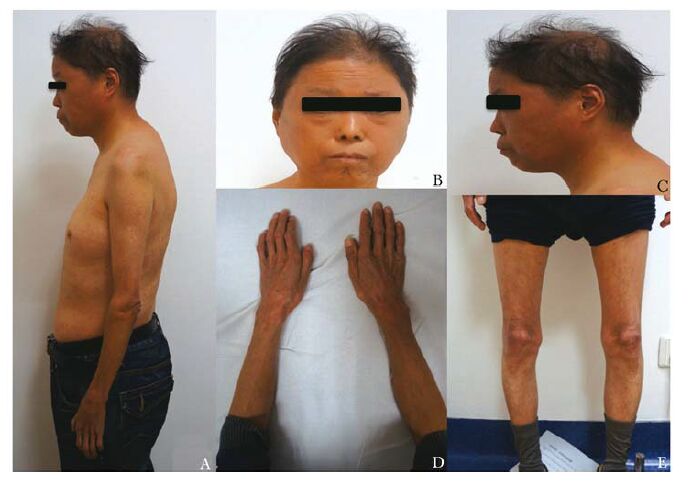
|
| 图 2 先证者照片 Figure 2 Pictures of the proband A:身材矮小,头发稀疏发白,躯干部皮下脂肪堆积;B,C: 早衰面容,鸟嘴征,胡须稀疏,喉结不明显;D,E: 四肢细长,皮下脂肪萎缩 |
白细胞8.6×109/L,中性粒细胞58.0%,红细胞4.48×1012/L,血红蛋白145 g/L,血小板292×109/L;血谷氨酸-丙酮酸氨酸基转移酶为95 U/L(正常参考范围0~65 U/L),天门冬氨酸基转移酶为63 U/L(正常参考范围8~37 U/L),总胆固醇为6.31 mmol/L(正常参考范围2.8~5.17 mmol/L),血白蛋白、肌酐和尿素均在正常参考范围内;尿葡萄糖(+++),尿蛋白(-);凝血酶原时间10.3 s(正常参考范围9.4~13.5 s),纤维蛋白原为378 mg/dL(正常参考范围184~480 mg/dL),凝血酶时间为20.5 s(正常参考范围17.2~26.7 s),活化部分凝血活酶时间为29.5 s(正常参考范围24.6~35.2 s),国际标准化比值为0.96(正常参考范围0.88~1.25),D二聚体180.0 ng/mL(0~278.0 ng/mL);甲胎蛋白为3.60 μg/L(正常参考范围0~20.0 μg/L),癌胚抗原为0.44 μg/L(正常参考范围<10.00 μg/L),癌抗原125为3.60 U/mL(正常参考范围0~35.0 U/mL),癌抗原199为3.55 U/mL (正常参考范围<37.0 U/mL);血游离T3为5.64 pmol/L (正常参考范围3.10~6.80 pmol/L),游离T4为10.04 pmol/L(正常参考范围12.0~22.0 pmol/L),促甲状腺激素为4.96 mU/L(正常参考范围0.27~4.20 mU/L)。空腹血糖为6.73 mmol/L(正常参考范围3.90~5.80 mmol/L),糖化血红蛋白为6.70%(正常参考范围4.30%~6.50%)。葡萄糖耐量试验(外院)结果:血糖0 h为5.9 mmol/L,0.5 h为6.99 mmol/L,2 h为11.86 mmol/L;胰岛素释放试验(外院)结果为胰岛素0 h为25.22 μU/mL,0.5 h为48.74 μU/mL,1 h为124.01 μU/mL,2 h>300 μU/mL,3 h为244.65 μU/mL。血总睾酮为1.91 nmol/L(正常参考范围8.4~28.7 nmol/L),游离睾酮指数为7.83 %(正常参考范围20.4%~81.2 %),孕酮为0.54 nmol/L(正常参考范围0.89~3.88 nmol/L),卵泡刺激素为32.13 U/L(正常参考范围1.4~18.1 U/L),黄体生成素为16.6 U/L(正常参考范围1.5~9.3 U/L),雌二醇、催乳素均在正常参考范围内;血25羟维生素D为48.8 nmol/L(正常参考范围<50 nmol/L为不足,>50 nmol/L为充足),血甲状旁腺素67.7 ng/L(正常参考范围15~65 ng/L),血β-Ⅰ型胶原交联C末端肽、骨钙素N端中分子片段、碱性磷酸酶、血钙和血磷均在正常参考范围内。胸部X线正位片(外院)提示两肺野内未见明确实质性病灶;胸腰椎、骨盆和双手X线摄片提示髋部、胸腰椎和双手退行性改变,骨质疏松(图 3)。心脏B超(外院)提示静息状态下,左室舒张功能减退;腹部B超(外院)提示肝不均性脂肪浸润考虑,胆囊附壁胆固醇结晶,脾脏多发钙化灶,前列腺增生伴结石。骨密度(双能X线吸收仪,GE Lunar Prodigy,美国)提示腰椎1-4 0.845 g/cm2 (Z值=-1.5),股骨颈0.550 g/cm2(Z值=-2.2),总髋部0.603 g/cm2(Z值=-1.8)。
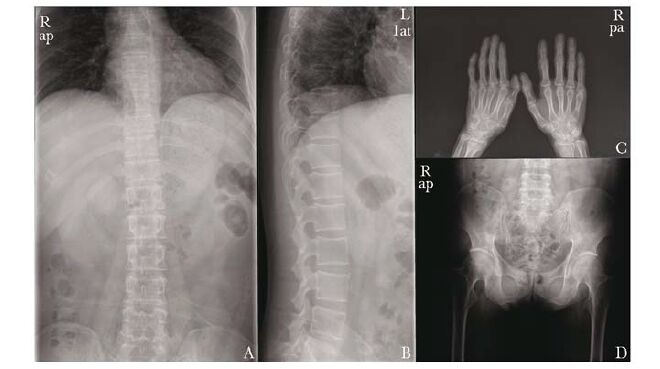
|
| 图 3 先证者影像学检查 Figure 3 Radiography examination of the proband A,B:胸腰椎骨质疏松;C,D:双手和骨盆骨质疏松,退行性变 |
患者及其姐姐、父母基因检测见图 4。
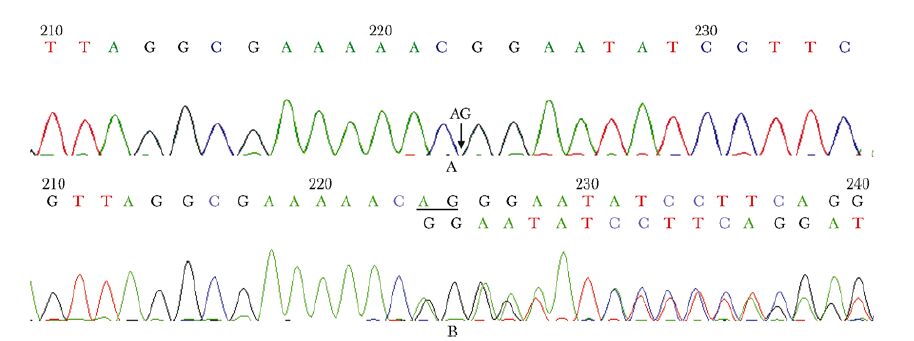
|
| 图 4 先证者,姐姐及其父母WRN基因突变测序图 Figure 4 DNA sequencing of WRN gene of the proband,his sister and parents A:先证者及其姐姐在WRN基因外显子19发生纯合缺失突变(c.2229_2230delAG);B:父母双方均为该位点杂合缺失突变 |
本病例临床特点:患者为中年男性,父母为旁系3代近亲婚配,家族史(+);青春期起病,首发症状为身高明显矮于同龄人,17岁发现“脂肪肝”,20余岁出现头发发白伴脱落,双眼白内障,2型糖尿病;既往有双侧隐睾切除史;查体发现身材矮小,反应欠灵敏,四肢皮肤粗糙,皮下脂肪减少,头发稀疏发白,双眼视力下降,眼球突出,发音嘶哑,第二性征发育不全,双膝关节屈曲受限;辅助检查提示高脂血症伴肝功能损害,甲状腺功能减退,2型糖尿病,性腺功能减退和低于正常同龄人骨密度范围等。该病例较为复杂,患者虽以身材矮小和双下肢关节疼痛就诊,但经本科常规检查后提示疾病尚累及结缔组织(白内障,头发发白、稀疏)与内分泌和代谢系统(高脂血症,甲状腺和性腺功能异常,糖尿病)。另外患者姐姐主要表现为身材矮小,双眼白内障和妊娠中早期早产史,且通过复习文献提示后者可为女性性腺功能低下的表现[1]。由于患者父母系近亲婚配,姐姐有类似疾病表现,考虑该病例为一种常染色体隐性遗传的临床综合征可能性大,且以双眼白内障和性腺功能减退为主要特征。根据在线人类孟德尔遗传数据库(http://www.ncbi.nlm.nih.gov/omim/),共检索到30个遗传综合征同时有上述主要表现,随后我们对各个综合征的遗传模式、起病时间、临床表型等进行文献复习。其中,Hypogonadism-Cataract综合征(OMIM 240950)为常染色体隐性遗传,该综合征迄今仅有1个家系病例报道,病例中父母为旁系2代近亲结婚,3个兄弟发病,均表现为青少年白内障和不育,实验室检查提示睾丸衰竭[2]。该综合征的临床诊断标准仅包括白内障和不育两个表型,排除诊断标准为并发其他临床表型,因此本病例显然不符合。Rothmund-Thomson综合征(OMIM 268400)为一种婴幼儿期(6个月~3岁)起病的临床综合征,常隐遗传,以典型的皮肤色素沉着性皮疹为主要临床特点,可同时有身材矮小、青少年白内障、毛发稀疏、过早老化、性腺功能减退、隐睾和先天性骨骼畸形等表现[3]。由于本例患者系青春期起病,且无皮肤色素沉着性皮疹的临床表现,因此Rothmund-Thomson综合征暂不考虑。Werner综合征(OMIM 277700)又称“成人早老症”,临床上以过早出现的衰老特性和肿瘤易感性增加为特点[4]。该综合征一般10岁后发病,首发症状为青春期缺乏加速生长;早期症状在20岁左右出现,主要表现为头发发白脱落、声音嘶哑和硬皮病样皮肤改变;30岁之后患者可出现双眼白内障、2型糖尿病、性腺功能减退、皮肤溃疡、动脉粥样硬化、骨质疏松和恶性肿瘤等。Werner综合征国际注册网站提供的诊断标准(http://www.pathology.washington.edu/research/werner/registry/gene.html)如下:(1)主要症状和体征:双眼白内障,特征性皮肤病理改变、身材矮小、父母旁系3代内近亲或有同胞受累、头发过早发白或稀疏和24 h尿玻璃酸试验阳性;(2)次要症状和体征:糖尿病、性腺功能低下、骨质疏松、四肢远端骨质硬化、软组织钙化、过早的动脉粥样硬化、肿瘤、声音改变(高音调、嘶哑)和平足。确诊:符合所有主征+2个次征。拟诊:前3个主征+2个次征。疑诊:白内障或特征性皮肤病理改变+4个次征。排除诊断:青春期前发病(除身材矮小外)。根据上述诊断标准,本例病例仅为疑诊。Takemoto等[5]于2013年通过汇总396例日本Werner综合征患者临床资料对上述诊断标准进行了修订,主要症状包括:头发稀疏发白、双眼白内障、皮肤难治性溃疡、软组织钙化、声音改变(高音、嘶哑)和鸟嘴征。确诊需符合所有6项主要症状或3项以上主要症状+基因诊断。根据此诊断标准,本病例确诊尚缺乏基因水平的证据。随后对患者和姐姐及父母亲外周血DNA进行抽提并测序,患者与其姐姐检测到Werner综合征致病基因WRN基因外显子19纯合缺失AG,即c.2229_2230delAG(NM_000553.4),导致p.Gly744GlufsX20(NP_000544.2),且该位点为新发突变位点。经验证,父母双方各自均携带有一个突变位点,为杂合缺失突变(图 4)。至此,根据临床表型和基因水平证据,该病例可确诊为Werner综合征。
Werner综合征首例报道在1904年,为一个德国近亲家系,受累者为2个兄弟和2个姐妹,均表现为身材矮小,面容早衰,白内障和皮肤硬化等[6]。迄今,全世界已有1 300余例,各人群均有报道,其中日本有1 000余例,占75%以上,男女比例约为1∶1。该综合征患病率约1/100万到1/1 000万,在日本较高,约为1/10万[7-8]。 我国首例报道1983年[9],通过万方数据知识服务平台检索至2015年11月共有文献报道13例,其中临床诊断11例,分子诊断2例。Werner综合征的致病基因WRN首先在1992年由Goto等[6]定位于8p12,并在1996年成功完成定位克隆和测序[10]。WRN基因编码的WRN蛋白属于人类RecQ解旋酶家族,同时具有DNA解螺旋活性和核酸外切酶活性[11-12]。然而WRN基因突变导致Werner综合征临床表型的具体机制尚不完全清楚[4, 13]。Werner综合征的临床谱很广,一般可以将其表型分为两部分[4-5],一是加速老化的特征性表现:白内障、糖尿病、骨质疏松、动脉粥样硬化、大脑皮质萎缩等;二是非正常老化的临床症状:性腺功能减退、喉部萎缩、特殊类型恶性肿瘤易感性增加等。目前认为大部分WRN基因突变通过降低WRN蛋白活性引起基因组不稳定和端粒功能障碍,引起疾病的发生[13-14]。该综合征具有遗传异质性,一部分非典型Werner综合征患者可检测到LMNA基因突变[15],然而仍有近20%临床诊断的Werner综合征患者未检测到WRN或LMNA基因突变[16]。
该综合征在临床诊断时主要与肢端老化症、Hutchinson-Gilford早衰综合征和Mandibulo-acral dysplasia(MAD)进行鉴别。肢端老化症患者多为女性,出生即有临床表型,这类患者小颌畸形,眼球突出,皮肤异色改变,肢体明显萎缩,但不并发内分泌代谢系统疾病,毛发和身材正常[17];Hutchinson-Gilford早衰综合征有类似的皮肤萎缩和硬皮病样改变,毛发稀疏,心血管粥样硬化等,但患者一般为侏儒,出生后1年内即有明显的生长迟缓,2岁左右出现脱发等症状,平均寿命更短,仅为13.5岁[18];MAD亦是一种早老症,类似表现有躯干皮下脂肪堆积而四肢皮下脂肪萎缩,毛发脱落稀疏,早衰面容等,但该类患者出生后即有生长缓慢,身材矮小,存在骨骼畸形[19]。
综上,Werner综合征为一种罕见的遗传综合征,临床谱广,可累及结缔组织、内分秘和代谢性系统、心血管系统与免疫系统等,而在疾病发生发展过程中可能就诊不同的科室,认识不足则容易导致误诊,完善相关基因检测有助于补充临床诊断。该综合征由于是一种遗传性疾病,目前尚无特效治疗方法,临床上主要是对症处理,完善相关检查,特别是心血管及恶性肿瘤相关的辅助检查有利于对疾病进行及时和针对性处理,从而延长患者寿命。
| [1] | Dufour P, Berard J, Vinatier D, et al. Myotonic dystrophy and pregnancy.A report of two cases and a review of the literature[J]. Eur J Obstet Gynecol Reprod Biol, 1997, 72 : 159–164. DOI:10.1016/S0301-2115(96)02690-5 |
| [2] | Lubinsky MS. Cataracts and testicular failure in three brothers[J]. Am J Med Genet, 1983, 16 : 149–152. DOI:10.1002/(ISSN)1096-8628 |
| [3] | Larizza L, Roversi G, Volpi L. Rothmund-Thomson syndrome[J]. Orphanet J Rare Dis, 2010, 5 : 2–17. DOI:10.1186/1750-1172-5-2 |
| [4] | Muftuoglu M, Oshima J, von Kobbe C, et al. The clinical characteristics of Werner syndrome: molecular and biochemical diagnosis[J]. Hum Genet, 2008, 124 : 369–377. DOI:10.1007/s00439-008-0562-0 |
| [5] | Takemoto M, Mori S, Kuzuya M, et al. Diagnostic criteria for Werner syndrome based on Japanese nationwide epidemiological survey[J]. Geriatr Gerontol Int, 2013, 13 : 475–481. DOI:10.1111/ggi.2013.13.issue-2 |
| [6] | Goto M, Rubenstein M, Weker J, et al. Genetic linkage of Werner's syndrome to five markers on chromosome 8[J]. Nature, 1992, 355 : 735–738. DOI:10.1038/355735a0 |
| [7] | Goto M, Ishikawa Y, Sugimoto M, et al. Werner syndrome: a changing pattern of clinical manifestations in Japan (1917~2008)[J]. Biosci Trends, 2013, 7 : 13–22. |
| [8] | Massla MV, Scapaticci S, Olivieri C, et al. Epidemiology and clinical aspects of Werner's syndrome in Noah Sardinia: description of cluster[J]. Eur J Dermatol, 2007, 17 : 213–216. |
| [9] | 梁敦, 庄恩信. Wemer综合征一例报告[J]. 眼科新进展, 1983, 3 : 278–280. |
| [10] | Yu CE, Oshima J, Fu YH, et al. Positional cloning of the Werner's syndrome gene[J]. Science, 1996, 272 : 258–262. DOI:10.1126/science.272.5259.258 |
| [11] | Gray MD, Shen JC, Kamath-Loeb AS, et al. The Werner syndrome protein is a DNA helicase[J]. Nat Genet, 1997, 17 : 100–103. DOI:10.1038/ng0997-100 |
| [12] | Ahn B, Harrigan JA, Indig FE, et al. Regulation of WRN helicase activity in human base excision repair[J]. J Biol Chem, 2004, 279 : 53465–53474. DOI:10.1074/jbc.M409624200 |
| [13] | Martin GM, Oshima J. Lessons from human progeroid syndromes[J]. Nature, 2000, 408 : 263–266. DOI:10.1038/35041705 |
| [14] | Chang S, Multani AS, Cabrera NG, et al. Essential role of limiting telomeres in the pathogenesis of Werner syndrome[J]. Nat Genet, 2004, 36 : 877–882. DOI:10.1038/ng1389 |
| [15] | Oshima J, Hisama FM. Search and insights into novel genetic alterations leading to classical and atypical Werner syndrome[J]. Gerontology, 2014, 60 : 239–246. DOI:10.1159/000356030 |
| [16] | Oshima J, Hisama FM. Search and insights into novel genetic alterations leading to classical and atypical Werner syndrome[J]. Gerontology, 2014, 60 : 239–246. DOI:10.1159/000356030 |
| [17] | Hadj-Rabia S, Mashiah J, Roll P, et al. A new lamin a mutation associated with acrogeria syndrome[J]. J Invest Dermatol, 2014, 134 : 2274–2277. DOI:10.1038/jid.2014.158 |
| [18] | Sinha JK, Ghosh S, Raghunath M. Progeria: a rare genetic premature ageing disorder[J]. Indian J Med Res, 2014, 139 : 667–674. |
| [19] | Tanyeri H, Kurklu E, Ak G, et al. Maxillofacial and dental manifestations in a patient with mandibulo-acral dysplasia[J]. Cranio, 2005, 23 : 74–78. DOI:10.1179/crn.2005.011 |
| (收稿日期:2016-03-17) |

