维生素D中毒可导致肾结石或肾脏钙质沉着、肾功能不全和高钙血症等相关临床表现,需积极扩容、利尿、降钙治疗,应引起临床医师重视。
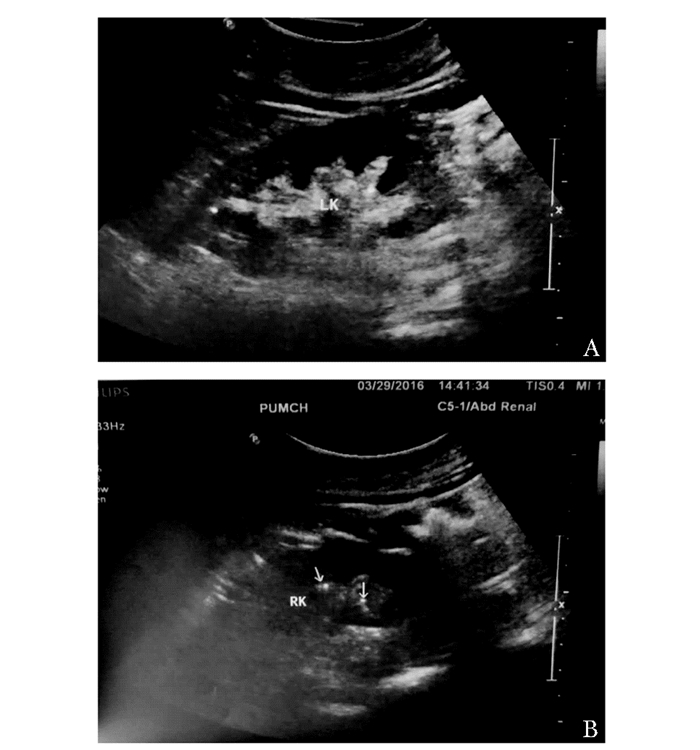
病历摘要患者,女性,57岁,因“手足抽搐10年,恶心、呕吐2月,发现血压高2天”于2016年3月就诊于北京协和医院。患者10年前行甲状腺全切术,术后病理为“甲状腺乳头状癌”。术后出现手足麻木、抽搐,查“血钙低”, 给予钙剂治疗。2006年于北京协和医院门诊查血钙1.97 mmol/L,甲状旁腺素 (parathyroid hormone, PTH) < 3.00 ng/L,诊断为“甲状旁腺功能减退症”,予钙尔奇D (每片含元素钙600 mg,普通维生素D 125 U),每日1片或1.5片;骨化三醇0.25 μg,隔日1次;胆维丁乳每5 d 30万单位,患者手足麻木、抽搐缓解,每3个月监测血钙浓度,血钙维持在2.0~2.1 mmol/L,肾功能正常。患者还服用左甲状腺素钠 (优甲乐),周一至周五150 μg/d,周六至周日125 μg/d。患者近两年未来就诊,未监测血、尿钙浓度及肾功能。2016年1月前患者出现纳差、恶心、呕吐,伴腹胀。2016年3月10日开始症状加重,出现多饮多尿。2016年3月14日前出现头晕,测血压170/110 mmHg (1 mmHg=0.133 kPa),2016年3月16日来诊。患者否认骨痛、骨折、尿中排石史。既往史:无特殊记载。个人史、家族史:无特殊记载。入院查体:血压150/100 mmHg,心率80次/min,窦性心律,甲状腺未及肿大,颈部未及肿大淋巴结,束臂加压实验 (-),面神经叩击征 (-),肾区叩痛 (-)。实验室检查:血常规,正细胞正色素性贫血;血钙 (calcium,Ca) 4.01 mmol/L,白蛋白 (albumin,ALB) 40 g/L,血磷 (phosphorus,P) 0.73 mmol/L,碱性磷酸酶 (alkaline phosphatase,ALP) 62 U/L,肌酐 (creatinine,Cr) 353 μmol/L,尿素氮 (blood urea nitrogen,BUN) 11.96 mmol/L;血气:代谢性碱中毒;PTH < 3.00 ng/L,25羟维生素D (25-hydroxyvitamin D,25OHD) 367.9 mg/L,1, 25双羟维生素D[1, 25-dihydroxy vitamin D,1, 25(OH)2D]79.53 ng/L;甲状腺功能:游离三碘甲状腺原氨酸 (free triiodothyronine,FT3) 4.19 pmol/L,游离甲状腺素 (free thyroxine,FT4) 28.19 pmol/L,促甲状腺激素 (thyroid-stimulating hormone,TSH) 0.013 mU/L。肿瘤标志物均 (-)。抗核抗体、抗ENA抗体谱均 (-)(表 1)。超声显示双肾皮质回声增强,皮髓质分界尚清,双肾实质及集合管内数个点状强回声 (图 1)。肾血流图:肌酐清除率31.45 mL/min,右肾为17.83 mL/min,左肾为13.62 mL/min。胸腹盆CT未见占位性病变。
| 指标 | 结果 | 参考范围 |
| Ca (mmol/L) | 4.01 | 2.13~2.70 |
| ALB (g/L) | 40 | 35~52 |
| P (mmol/L) | 0.73 | 0.81~1.45 |
| ALP (U/L) | 62 | 50~135 |
| Cr (μmol/L) | 353 | 45~84 |
| PTH (ng/L) | < 3.00 | 12.0~65.0 |
| 25OHD (mg/L) | 367.9 | 8~50 |
| 1, 25(OH)2D (ng/L) | 79.53 | 19.6~54.3 |
| RBC (×1012/L) | 3.18 | 3.50~5.00 |
| Hb (g/L) | 93 | 110~150 |
| FT3(pmol/L) | 4.19 | 2.77~6.31 |
| FT4(pmol/L) | 28.19 | 10.42~24.32 |
| TSH (mU/L) | 0.013 | 0.38~4.34 |
| Ca:血钙;ALB:白蛋白;P:血磷;ALP:碱性磷酸酶;Cr:肌酐;PTH:甲状旁腺素;25OHD:25羟维生素D;1, 25(OH)2D:1, 25双羟维生素D;RBC:红细胞;Hb:血红蛋白;FT3:游离三碘甲状腺原氨酸;FT4:游离甲状腺素;TSH:促甲状腺激素 | ||
|
| 图 1 肾脏超声提示双肾钙质沉着 Figure 1 Renal ultrasound scan showed bilateral nephrocalcinosis A:左肾;B:右肾;箭头:钙质沉着 |
诊断:高钙危象,维生素D中毒,肾功能不全;甲状旁腺功能减退症,甲状腺乳头状癌术后。
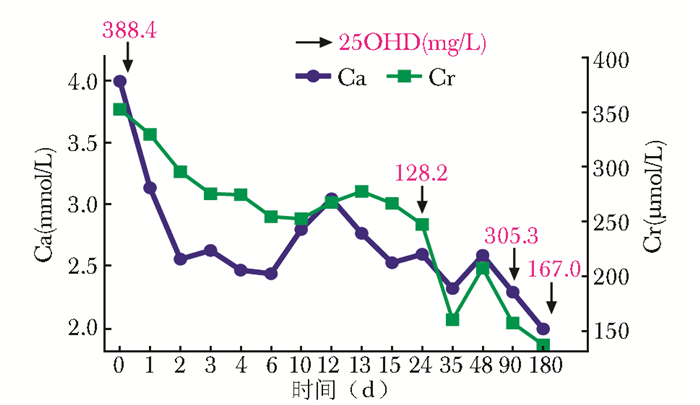
治疗:立即停用钙剂及维生素D制剂;低钙饮食;给予水化、利尿 (呋塞米, 20 mg bid)、降钙素 (密盖息, 100 U q8h) 治疗。2016年3月18日后患者恶心、呕吐缓解,复查血钙2.56 mmol/L,Cr 296 μmol/L。2016年3月22日后停用降钙素,2016年3月28日血钙又升至3.05 mmol/L,再次开始降钙素治疗。此后间断使用降钙素,患者血钙波动于2.01~2.77 mmol/L,Cr 161~278 mmol/L。2016年9月22日后检查提示Ca 1.99 mmol/L,Cr 138 μmol/L,25OHD 167.0 mg/L。治疗过程中,血液生化指标监测情况详见图 2。左甲状腺素钠调整为100 μg qd,3个月后复查,FT3、FT4正常,TSH < 0.10 mU/L。
|
| 图 2 治疗过程中血钙、血肌酐、血总25OHD变化 Figure 2 Change of serum levels of calcium, creatinine and 25OHD during treatment Ca:钙;Cr:血肌酐;25OHD:25羟维生素D |
本例特点:中年女性,慢性病程,急性加重。患者甲状腺全切术后出现低钙血症及低PTH血症,提示甲状腺旁腺功能减退诊断明确。长期服用钙剂、维生素D制剂,血钙控制于正常低限,临床症状缓解。近2年未就诊,未监测生化指标,也未调药。近期出现高钙血症、肾脏钙化、肾功能损害等维生素D中毒临床表现。予以停用钙剂、维生素D制剂,并予水化、利尿及降钙素治疗,高钙血症逐渐缓解、肾功能好转。
本例患者长期服用钙剂及维生素D制剂治疗,但较长时间未评估病情,也未调整药物剂量,结果出现恶心、呕吐、多饮、多尿等消化道及泌尿系统症状,生化检查示血钙浓度大于3.5 mmol/L, 提示高钙危象,患者血总25OHD及1, 25(OH)2D浓度明显升高,血肌酐水平高于正常,进一步检查排除肿瘤、结节病、甲状旁腺疾病等所致高钙血症的可能,因此提示维生素D中毒诊断明确。
维生素D中毒是罕见的内分泌急症,见于甲状腺功能减退、佝偻病、骨质疏松症和某些癌症等疾病,且长期服用维生素D制剂的患者[1]。一方面,1, 25(OH)2D可以直接与维生素D受体结合,促进肠钙吸收,导致高钙血症[2]。25OHD可竞争结合维生素D结合蛋白,致血中游离1, 25(OH)2D增多,肠道钙吸收增加[3];另一方面,高浓度的25OHD还可直接与维生素D受体结合,导致肠道钙吸收增多,同时25OHD也加快骨吸收,骨钙释放增加[4-5]。可见,血清1, 25(OH)2D与25OHD浓度增加,均与高钙血症密切相关。
维生素D中毒的急性表现主要由高钙血症引起,包括心血管系统 (血压升高、心律不齐等)、消化系统 (恶心、呕吐、便秘等)、泌尿系统 (多饮、多尿、急性肾功能损害等)、精神神经症状等。慢性表现包括肾结石或钙质沉着、血管和软组织钙化和慢性肾功能不全等。血液生化指标显示:高钙血症、血磷正常或升高、碱性磷酸酶正常或降低、25OHD升高、尿钙排泄增多,部分患者可出现肾功能不全等[6]。健康人群中,血清总25OHD > 100 mg/L,提示高维生素D血症;血清总25OHD > 150 mg/L,应考虑维生素D中毒的可能[6-8]。甲状腺功能减退患者出现维生素D中毒非常少见,老龄、存在基础肾脏疾病、有效血容量不足、服用导致eGFR降低的药物 (如ACEI、NSAIDs等)、妊娠等均为维生素D中毒的高危因素[9-11]。甲状腺功能减退患者病情差异较大,导致维生素D中毒的药物剂量尚不清楚,提示药物中毒的血清25OHD浓度阈值也有待探索。因此,对于长期服用钙剂和维生素D制剂的甲状腺功能减退患者,应每3~6个月监测血尿钙浓度及肾功能,根据结果及时调整药量十分重要。
甲状腺功能减退患者出现高钙血症时,仍需进行高钙血症原因的鉴别诊断。Donovan等[12]总结了138例甲状旁腺素相关蛋白导致的高钙血症,绝大部分由实体肿瘤所引起,肿瘤细胞分泌甲状旁腺素相关蛋白,导致骨吸收增加和肾脏钙重吸收增加,肿瘤骨转移导致骨质溶解,也诱发高钙血症。Donvan等[13]还总结了101例维生素D介导的高钙血症,结节病是最常见病因,其次是血液系统恶性肿瘤和感染,机制是巨噬细胞和免疫细胞可表达1α羟化酶,导致25OHD向1, 25(OH)2D转化增多,肠钙吸收增多,出现高钙血症。本例患者经过详细检查,未发现肿瘤、结节病、感染等引起高钙血症的相关证据,因此,外源性维生素D中毒是高钙血症的原因。
维生素D中毒的治疗目标是降低血钙,保护肾功能。具体措施包括:立即停用钙剂和维生素D制剂;低钙饮食;利尿 (袢利尿剂);静脉输注0.9%氯化钠注射液增加尿钙排泄;降钙素及双膦酸盐降低骨吸收;必要时血液透析等[6, 14]。本例患者停用钙剂与维生素D,并予充分水化、速尿治疗。由于降钙素可快速降低血钙,肾毒性小,本例患者接受了降钙素治疗,并根据血钙水平,调整降钙素剂量及使用间隔时间。经过综合治疗,患者血钙和血肌酐水平逐渐下降,肾功能逐渐好转 (图 2)。双膦酸盐可显著降低血钙水平,且作用时间长,然而,由于本患者肌酐清除率 < 35 mL/min,因此未给予双膦酸盐治疗[15]。近年来,有报道对于难治性高钙血症患者 (包括恶性肿瘤或甲状旁腺癌相关的高钙血症),可采用地诺单抗 (狄诺塞麦) 治疗,它通过RANKL/RANK/OPG通路抑制骨吸收,降低血钙,且在肾功能不全患者中也可使用[16-17],该药物能否用于治疗维生素D中毒所致高钙血症,尚未见报道。
另外,值得注意的是,活性维生素D与普通维生素D中毒不同,活性维生素D半衰期较短,作用消失快,停药后高钙血症很快得以纠正。普通维生素D为脂溶性,它在脂肪组织中的半衰期为2个月,在外周血半衰期约2周,普通维生素D中毒,停药后需要数月至半年时间,血钙才可能逐渐恢复正常,因此普通维生素D中毒患者,停药后需严密观察血钙、25OHD及肌酐水平长达数月,直至维生素D中毒彻底好转[18]。
本文分析1例甲状腺功能减退并发普通维生素D中毒,引发高钙危象的患者,旨在了解普通维生素D中毒的临床表现、生化特点,分析维生素D中毒引起高钙血症的机制及鉴别诊断,关注维生素D中毒的治疗措施。提醒临床医生加强对长期服用维生素D制剂患者的教育,建议患者定期进行生化指标监测,调整药量,以避免维生素D中毒的发生。
| [1] | Pérez-Barrios C, Hernández-Álvarez E, Blanco-Navarro I, et al. Prevalence of hypercalcemia related to hypervitaminosis D in clinical practice[J]. Clin Nutr, 2016, 35 : 1354–1358. DOI:10.1016/j.clnu.2016.02.017 |
| [2] | Deluca HF, Prahl JM, Plum LA. 1, 25-Dihydroxyvitamin D is not responsible for toxicity caused by vitamin D or 25-hydroxyvitamin D[J]. Arch Biochem Biophys, 2011, 505 : 226–230. DOI:10.1016/j.abb.2010.10.012 |
| [3] | Jones G. Pharmacokinetics of vitamin D toxicity[J]. Am J Clin Nutr, 2008, 88 : 582S–586S. |
| [4] | Vogiatzi MG, Jacobson-Dickman E, DeBoer MD, et al. Vitamin D supplementation and risk of toxicity in pediatrics:a review of current literature[J]. J Clin Endocrinol Metab, 2014, 99 : 1132–1141. |
| [5] | Deluca HF, Prahl JM, Plum LA. 1, 25-Dihydroxyvitamin D is not responsible for toxicity caused by vitamin D or 25-hydroxyvitamin D[J]. Arch Biochem Biophys, 2011, 505 : 226–230. |
| [6] | Ozkan B, Hatun S, Bereket A. Vitamin D intoxication[J]. Turk J Pediatr, 2012, 54 : 93–98. |
| [7] | Vieth R. Vitamin D supplementation, 25-hydroxyvitamin D concentrations, and safety[J]. Am J Clin Nutr, 1999, 69 : 842–856. |
| [8] | Holick MF. Vitamin D deficiency[J]. N Engl J Med, 2007, 357 : 266–281. |
| [9] | Altun E, Kaya B, Paydaş S, et al. Milk alkali syndrome induced by calcitriol and calcium bicarbonate in a patient with hypoparathyroidism[J]. Indian J Endocrinol Metab, 2013, 17 : S191–S193. DOI:10.4103/2230-8210.119568 |
| [10] | Henry RK, Gafni RI. Hypercalcemia due to milk-alkali syndrome and fracture-induced immobilization in an adolescent boy with hypoparathyroidism[J]. Horm Res Paediatr, 2016, 86 : 201–205. DOI:10.1159/000446316 |
| [11] | Mitrogianni Z, Tsimihodimos V, Tzavella E, et al. Hypercalcemia and acute renal failure associated with calcium carbonate consumption in a patient with hypoparathyroidism[J]. Arch Med Sci, 2014, 10 : 1255–1257. |
| [12] | Donovan PJ, Achong N, Griffin K, et al. PTHrP-mediated hypercalcemia:causes and survival in 138 patients[J]. J Clin Endocrinol Metab, 2015, 100 : 2024–2029. DOI:10.1210/jc.2014-4250 |
| [13] | Donovan PJ, Sundac L, Pretorius CJ, et al. Calcitriol-mediated hypercalcemia:causes and course in 101 patients[J]. J Clin Endocrinol Metab, 2013, 98 : 4023–4029. |
| [14] | Bell DA, Crooke MJ, Hay N, et al. Prolonged vitamin D intoxication:presentation, pathogenesis and progress[J]. Intern Med J, 2013, 43 : 1148–1150. |
| [15] | Auron A, Tal L, Srivastava T, et al. Reversal of hypercalcemic acute kidney injury by treatment with intravenous bisphosphonates[J]. Pediatr Nephrol, 2009, 24 : 613–617. |
| [16] | Vellanki P, Lange K, Elaraj D, et al. Denosumab for management of parathyroid carcinoma-mediated hypercalcemia[J]. J Clin Endocrinol Metab, 2014, 99 : 387–390. DOI:10.1210/jc.2013-3031 |
| [17] | Cicci JD, Buie L, Bates J, et al. Denosumab for the management of hypercalcemia of malignancy in patients with multiple myeloma and renal dysfunction[J]. Clin Lymphoma Myeloma Leuk, 2014, 14 : e207–211. DOI:10.1016/j.clml.2014.07.005 |
| [18] | Bell DA, Crooke MJ, Hay N, et al. Prolonged vitamin D intoxication:presentation, pathogenesis and progress[J]. Intern Med J, 2013, 43 : 1148–1150. |
| (收稿日期:2016-09-30) |

