先天性无痛无汗症(congenital insensitivity to pain with anhidrosis,CIPA,OMIM 256800),又称遗传性感觉和自主神经病变Ⅳ型(hereditary sensory and autonomic neuropathy type 4,HSAN4),是极其罕见的常染色体隐性遗传性疾病,该病在日本人的患病率为1:600 000~950 000[1],由Swanson[2]于1963年首次报道。CIPA主要临床表现为痛觉减退、无汗、反复发热、自我伤害行为、反复无痛性骨折、Charcot关节,伴或不伴有心理障碍[3]。
近年来,研究发现CIPA的致病基因主要是神经营养性酪氨酸激酶受体1基因(neurotrophic tyrosine kinase receptor type 1,NTRK1),其编码神经生长因子(nerve growth factor,NGF)的高亲和力受体[4]。迄今已经报道了79种 NTRK1致病突变(http://www.hgmd.cf.ac.uk/ac/index.php),其中多数报道来自日本和以色列等国家[5]。2010年NTRK1突变导致的CIPA病例在我国首次被报道[6],此后又有约20例患者临床诊断为CIPA,但仅有7例通过分子诊断得以确诊[7, 8, 9, 10, 11]。此外,CIPA患者的骨骼病变特点、骨转换生化指标、骨密度及骨骼影像学表现,并未被充分研究及认识。本研究详细分析1例以早发、反复无痛性骨折为主要临床表现的CIPA患者的表现型特点,检测患者及其父母的NTRK1基因突变,以了解疾病致病机制。
对象与方法 对象患儿,男,年龄5岁8个月,因“反复骨折4年”,于2015年10月就诊北京协和医院内分泌科。患者为第一胎第一产,母亲孕期平顺,足月顺产,出生体质量3.4 kg,身长不详。患者7月龄起反复高热,多种临床检查未发现发热原因,抗生素治疗无效,物理降温体温可下降。高热时患者无汗,皮肤干燥,输液或抽血检查发现患者疼痛缺失。患儿1岁8个月开始走路,2岁时发生第一次轻微外力下骨折,由于骨折为无痛性,患者骨折后仍然能够行走。此后轻微外力下反复骨折4次,主要发生在左侧跟骨、胫骨、股骨。患儿5岁时,家长发现其左侧踝部肿胀,影像学检查未见骨折,提示跟骨骨髓炎表现。家族史:父母非近亲婚配,否认类似疾病病史。查体:身高105 cm(-3SD~-2SD),体质量18.5 kg(-1SD~中位数),未见舌及黏膜咬伤、溃疡,无牙齿缺失,巩膜不蓝,关节韧带无松弛,未见鸡胸、串珠肋,无脊柱、四肢等弯曲畸形。
血生化检测显示,血红细胞沉降率 12 mm/h(参考值0~20 mm/h),肝肾功能正常。血钙 2.38 mmol/L(参考值2.13~2.70 mmol/L),血磷 1.68 mmol/L(参考值1.29~1.94 mmol/L),骨形成指标血清总碱性磷酸酶(total alkaline phosphatase,TALP)372 U/L(参考值58~390 U/L),25羟维生素D(25-hydroxyvitamin D,25OHD) 22.9 ng/mL(参考值20~50 ng/mL),全段甲状旁腺素(intact parathyroid hormone,PTH)21.8 pg/mL(参考值12~65 pg/mL),均在正常范围内。骨吸收指标血清β-胶原降解产物(C-terminal telopeptide of type Ⅰ collagen,β-CTX)1.72 ng/mL(参考值0.260~0.512 ng/mL),轻度高于正常儿童参考范围。骨骼X线片可见四肢骨折部位肥厚性骨痂。双能X线吸收检测法(GE Lunar DXA,USA)测定骨密度提示L2-4骨密度为0.555 g/cm2(Z值= -1.8),股骨颈骨密度0.576 g/cm2(Z值=0.9)。本研究方案符合北京协和医院科研伦理委员会要求,在研究开始前,患者父母同意参加本研究并签署知情同意书。
致病基因检测采集患者及其父母外周静脉血,提取基因组DNA(采用QIAampDNA Blood Mini试剂盒,德国)。采用Primer 3设计引物,扩增NTRK1种的1~17外显子及其与内含子交界区。引物序列、产物长度及反应条件见表 1。PCR反应体系共30 μL:Taq mix 15 μL、上下游引物各1 μL、基因组DNA 2 μL和ddH2O 11 μL。PCR反应条件为:预变性95 ℃×5 min;变性95 ℃×30 s;退火30 s;延伸72 ℃×20~60 s,循环35次;总延伸72 ℃×10 min。PCR扩增产物纯化后用荧光自动测序仪(ABI3700,美国)测序,测序结果与参考序列NM_002529.3 比对,以确定NTRK1突变位点及类型(表 1)。并进一步与NCBI SNP、人类基因突变数据库(http://www.hgmd.cf.ac.uk/ac/index.php)和遗传性周围神经病变突变数据库(http://www.molgen.ua.ac.be/CMTMutations/Mutations/Mutations.cfm)进行比对,排除变异位点为基因多态性位点,并确定其是否为未报道过的新突变位点。采用BioEdit(7.0.9.1)软件分析突变位点在不同物种中的保守性,另外采用Polyphen 2(http://genetics.bwh.harvard.edu/pph2/)和SIFT(http://sift.jcvi.org/)软件对发生错义突变的蛋白进行致病性预测。
| 外显子 | 正向引物(5′→3′) | 反向引物(5′→3′) | 产物长度(bp) | 退火温度(℃) |
| 1 | GCGGCTGGGTCTTTAACA | CAGCAAACAAGCAGCGAGT | 511 | 57 |
| 2 | AACTCAAGTGTGGGCCTGAG | CCCCTCATTGTTTCCTCAAC | 360 | 61 |
| 3 | TAGCTGAGACCTGGGGACTG | TGAGGTGACTTCCCTGACCA | 300 | 63 |
| 4 | GGTCACTCAAGGGGTCTGTC | CACTGGCATGCACATAGTCC | 386 | 63 |
| 5 | TGTCCTCCCTTTCACCTGTAG | ATGTCACCCCAGGCAGTTT | 420 | 59 |
| 6 | GGCCACTCCCAGCTCTAAC | CCTCAGTGTGCTCCTTATTCG | 360 | 61 |
| 7 | AGGGGCTCTCCAAAGACTTC | CACACATCCCACCCTTTCTT | 370 | 61 |
| 8 | TTCGGGTTCTACTCGCTTTG | ACCAGGCACTCCAATTTCTG | 550 | 60 |
| 9,10 | AGGGGACTCACTGCTTTCCT | GAGCTCAGGCCAGATGGTAG | 500 | 63 |
| 11 | CTCCCATGCAGGATGAAAAA | ACTCACACGCCCTGGAACT | 320 | 59 |
| 12 | TCAGTCTCTCCCCTGCAAGT | AGGCCTAGGGGCTTCTACAC | 540 | 63 |
| 13 | AAGACAGTCCCCGCTACAAC | ATGTCAGCCCTCTGCATCTC | 340 | 62 |
| 14 | CTGACATGGCTGGATACCG | GTGTCTCCCCTTGGTTTGAA | 439 | 60 |
| 15 | GGCTCCTGGGAGTTCTATCC | CTTGGGATCCAGGGTGTCTA | 500 | 63 |
| 16 | GGGTAGGCTGTGCCTTGAC | GAACCGAGTTCCCTGAAAAA | 370 | 60 |
| 17 | GACTGGCCTCACTCTCTTGC | AGCTGTCCCCCTACCTGAAT | 630 | 63 |
患者幼年起病,主要表现为早发、反复轻微外力下无痛性骨折,主要骨折部位是四肢,伴有无汗、反复高热及痛觉减退。患者血清骨吸收指标轻度升高,腰椎骨密度略低于性别、年龄匹配的儿童正常参考值,X线片可见骨折部位肥厚性骨痂(图 1)。

|
| 图 1 先天性无痛无汗症患者的影像学表现 Fig 1 Radiological findings in patient with CIPA A:头颅侧位相;B:胸腰椎侧位相;C:骨折部位可见肥厚性骨痂;D:跟骨骨髓炎;E:无特殊面部表现; CIPA:先天性无痛无汗症 |
Sanger测序提示患者NTRK1基因存在复合杂合突变:第7内含子c.IVS7-33T>A和第17外显子c.2281C>T突变(图 2)。患者父亲与母亲分别为c.IVS7-33T>A及c.2281C>T携带者。
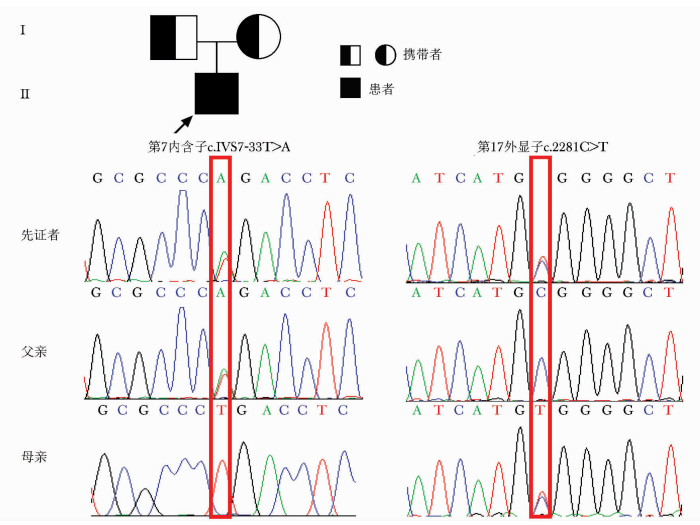
|
| 图 2 先天性无痛无汗症患者家系图及NTRK1基因测序结果 Fig 2 Pedigree of the CIPA family and Sanger sequencing results of the NTRK1 gene 测序结果提示NTRK1复合杂合突变:第7内含子c.IVS7-33T>A和第17外显子c.2281C>T;父母亲为突变基因携带者;CIPA:先天性无痛无汗症 |
CIPA为极其罕见的常染色体隐性遗传性疾病,本研究确诊1例以早发反复轻微外力下无痛性骨折,伴有痛觉减退、无汗、反复发热为表现的CIPA儿童患者。患者骨吸收指标轻度增高、腰椎骨密度稍降低,骨折部位有肥厚性骨痂形成。分子遗传学分析提示NTRK1基因复合杂合突变(c.IVS7-33T>A和c.2281C>T)为本例患者的致病原因,c.IVS7-33T>A为分支位点突变,可导致第7内含子剪切异常。c.2281C>T为错义突变,导致761位精氨酸变为色氨酸(p.Arg761Trp),该位点精氨酸在人、金丝猴、恒河猴、狗、牛、马、荷兰猪、大鼠、小鼠中高度保守(图 3)。Polyphen 2(分值=0.994) 和SIFT(分值=0.01)预测p.Arg761Trp有致病性。上述两种突变不是多态性位点,在国外CIPA患者中均已有其致病性报道[12, 13, 14, 15]。CIPA属于遗传性感觉和自主神经病变4型,NTRK1为其主要致病基因,但近年报道神经生长因子(nerve growth factor,NGF)、白血病抑制因子受体α编码基因突变也可导致CIPA[16, 17]。NTRK1基因位于1q21-22,编码NGF的高亲和力受体。NTRK1共有17个外显子和16个内含子,第1外显子编码信号肽和第1个半胱氨酸富集区,第2~4外显子分别编码3个亮氨酸丰富的模体区,第5外显子编码第2个半胱氨酸富集区,第6~7外显子及第8外显子分别编码第1和第2个免疫球蛋白样的模体区,第10和11外显子编码跨膜区,第12~17外显子编码细胞内区域(图 3A)。NGF与NTRK1的免疫球蛋白样模体区结合后,NTRK1发生自体磷酸化,通过MAPK通路促进交感神经和部分自主神经的生长和分化。NTRK1基因在直径较小的无髓纤维(C类纤维)及有髓纤维(A类纤维)、支配汗腺的交感后胆碱能神经元上均有表达[18]。神经组织活检提示,CIPA患者出现A类纤维部分缺失、C类纤维完全缺失、交感后胆碱能神经元缺失,这解释了患者痛觉减退和无汗症状。

|
| 图 3 NTRK1突变位点在物种中的保守性 Fig 3 Sequence conservation of mutation in NTRK1 (Arg761) in species A:NTRK1外显子及蛋白质结构示意图,带下划线部分字体提示本患者的突变情况;B:761位精氨酸在多个物种中高度保守;SP:信号肽;CC-1和CC-2:第1个和第2个半胱氨酸富集区;LRMs:亮氨酸丰富的模体区;Ig-1和Ig-2:第1个和第2个免疫球蛋白样的模体区;TM:跨膜区;TK:酪氨酸激酶 |
反复骨折为CIPA患者常见临床表现之一,但是骨折特点、骨骼影像学表现、骨转换指标、骨密度的评估尚未得到充分重视。日本分析的91例CIPA患者,共发生骨折116次,其中105次骨折(91%)发生于下肢,骨折常发生于1~7岁,尤其是4~6岁,提出深感觉减退、触压觉阈值升高、心理障碍可能是骨折的主要原因[5]。骨折部位出现肥厚性骨痂的原因尚不明了,有研究者认为骨组织受自主神经和感觉神经支配,其神经元有NTRK1表达,如果NTRK1突变,骨折部位神经支配减少,可能影响骨折愈合过程,导致肥厚性骨痂的形成[19, 20]。部分研究报道CIPA患者血清骨转换生化指标升高,但骨活检未发现明显异常[21]。CIPA患者反复骨折的具体机制及骨骼病变情况,还有待深入研究。
在鉴别诊断方面,儿童反复骨折还需要考虑以下疾病的可能:成骨不全症、致密性成骨不全症、Hajdu-Cheney综合征、低磷佝偻病、青少年特发性骨质疏松症、骨硬化症等[22]。肥厚性骨痂形成需要考虑成骨不全症Ⅴ型的可能,后者为常染色体显性遗传,除了反复骨折、肥厚性骨痂外,还有桡骨小头半脱位、前臂骨筋膜钙化等表现,其致病基因为IFITM5[23],通过致病基因突变检测,能够很好地进行鉴别诊断。
目前已报道的NTRK1突变有79种,分布于NTRK1整个区域,多数突变位于12~17外显子区。本研究发现的NTRK1基因第7内含子IVS7-33T>A突变在日本人群中已有报道[12],为日本CIPA患者第二常见突变,在其他种族、中国人群中也有报道[9, 13, 14]。NTRK1第7内含子IVS7-33T>A突变使分支位点第4个核苷酸由T突变为A,体外实验证实c.IVS7-33T>A导致第7内含子异常的剪切[24]。第6~8外显子编码免疫球蛋白样结构域,第7内含子的异常剪切,影响NGF与NTRK1结合。本患者第17外显子c.2281C>T突变在国外多种族中也有报道[14, 15],但该突变在中国人群是首次被识别,其导致Arg761Trp,761位精氨酸在多个物种中高度保守,软件预测Arg761Trp为致病性突变,将明显影响细胞内信号传导。包括本例患者,我国目前经分子诊断确诊的CIPA患者共有8例 [6, 7, 8, 9, 10, 11],检出11种NTRK1突变,其中9种突变位于12~17外显子,该部位编码NTRK1细胞内区域,对于细胞内信号传导发挥重要作用。
CIPA的表现型和基因型的相关性仅有少数研究,结果提示CIPA表现型无明显异质性,部分研究显示携带c.2303C>T(p.Pro768Leu)突变的患者表型较轻,患者存在部分痛觉,无明显心理及智力障碍[12, 25]。目前我国8例基因诊断的CIPA患者的表型及基因型详见表 2。所有患者均表现为无汗、反复高热、痛觉减退,6例患者有自伤、自残行为,4例患者反复骨折,由于样本量较小,难以分析疾病表型与基因型间的关系。
| 编号 | 性别 | 父母近亲婚配 | 痛觉减退 | 无汗 | 反复高热 | 自伤行为 | 反复骨折 | 初次骨折时间 | 骨折次数 | 智力减退 | 发育延迟 | 其他异常 | 突变类型 | NTRK1突变 | 文献 |
| CIPA:先天性无痛无汗症;NA:文章中未描述 | |||||||||||||||
| 1 | 男 | - | + | + | + | + | NA | NA | NA | NA | NA | - | 纯合突变 | 第16外显子c.2086_2087 ins C | [6] |
| 2 | 男 | - | + | + | + | + | NA | NA | NA | NA | - | - | 复合杂合突变 | 第15外显子c.1945C>T;第1外显子c.44G>A | [7] |
| 3 | 女 | - | + | + | + | + | NA | NA | NA | NA | - | 骨髓炎 | 复合杂合突变 | 第12外显子c.1415delG;第7内含子c.IVS7-33T>A | [7] |
| 4 | 男 | - | + | + | + | + | + | NA | NA | + | + | 牙齿脱落 | 复合杂合突变 | 第13外显子c.1561T>C;第15外显子c.2057G>A | [8] |
| 5 | 男 | - | + | + | + | + | NA | NA | NA | + | + | 牙齿脱落 | 纯合突变 | 第16外显子c.2086_2087 ins C | [9] |
| 6 | 男 | - | + | + | + | + | + | 1岁 | NA | + | + | 头发稀疏 | 纯合突变 | 第13外显子c.1635G>C;第16外显子c.2197G>A | [10] |
| 7 | 女 | - | + | + | + | NA | + | NA | 7次 | + | + | 牙齿缺失 | 纯合突变 | 第7外显子c.727insT | [11] |
| 8 | 男 | - | + | + | + | - | + | 2岁 | 5次 | - | + | 骨髓炎 | 复合杂合突变 | 第7内含子c.IVS7-33T>A;第17外显子c.2281C>T | 本例患者 |
CIPA尚无有效的治疗方法。夏天需注意降温,减少反复高热的发生。需加强防护,减少患者自伤、自残行为。反复骨折是疾病严重而危险的并发症,CIPA患者应注意避免跌倒,减少骨折发生[5]。有报道1例31岁CIPA患者接受氯膦酸盐(400~800 mg/d)治疗7年,患者骨密度增加[21],但是骨折风险是否下降尚不明确。
综上,CIPA是极其罕见的常染色体隐性遗传性疾病,患者以早发反复无痛性骨折、无汗、痛觉减退为主要临床表现。骨吸收生化指标轻度升高,骨密度轻度降低,骨折部位肥厚性骨痂是其骨骼病变的主要特点。NTRK1突变是导致CIPA的主要分子机制。对于幼年起病、反复骨折,无痛无汗的患者,应重视CIPA的可能。
| [1] | Haga N,Kubota M,Miwa Z. Epidemiology of hereditary sensory and autonomic neuropathy type IV and V in Japan [J]. Am J Med Genet A,2013,161A:871-874. |
| [2] | Swanson AG. Congenital insensitivity to pain with anhydrosis. A unique syndrome in two male siblings [J]. Arch Neurol,1963,8:299-306. |
| [3] | Tuysuz B,Bayrakli F,DiLuna ML,et al. Novel NTRK1 mutations cause hereditary sensory and autonomic neuropathy type IV:demonstration of a founder mutation in the Turkish population [J]. Neurogenetics,2008,9:119-125. |
| [4] | Indo Y,Tsuruta M,Hayashida Y,et al. Mutations in the TRKA/NGF receptor gene in patients with congenital insensitivity to pain with anhidrosis [J]. Nat Genet,1996,13:485-488. |
| [5] | Zhang Y,Haga N. Skeletal complications in congenital insensitivity to pain with anhidrosis: a case series of 14 patients and review of articles published in Japanese [J]. J Orthop Sci, 2014,19:827-831. |
| [6] | Lin YP,Su YN,Weng WC,et al. Novel neurotrophic tyrosine kinase receptor type 1 gene mutation associated with congenital insensitivity to pain with anhidrosis [J]. J Child Neurol,2010,25:1548-1551. |
| [7] | Li M,Liang JY,Sun ZH,et al. Novel nonsense and frameshift NTRK1 gene mutations in Chinese patients with congenital insensitivity to pain with anhidrosis [J]. Genet Mol Res, 2012,11:2156-2162. |
| [8] | Gao L,Guo H,Ye N,et al. Oral and craniofacial manifestations and two novel missense mutations of the NTRK1 gene identified in the patient with congenital insensitivity to pain with anhidrosis [J]. PLoS One, 2013,8:e66863. |
| [9] | 汤莹,郑德柱,李清琴,等,中国人先天性无痛无汗症家系一个新的NTRK1基因突变[J].中华医学遗传学杂志,2014, 31:574-580. |
| [10] | Wang Q,Guo S,Duan G,et al. Novel and novel de novo mutations in NTRK1 associated with congenital insensitivity to pain with anhidrosis:a case report [J]. Medicine,2015,94:e871. |
| [11] | Liu S,Wu N,Liu J,et al. Novel NTRK1 frameshift mutation in congenital insensitivity to pain with anhidrosis[J]. J Child Neurol, 2015,30:1357-1361. |
| [12] | Jung CL,Ki CS,Kim BJ,et al. Atypical hereditary sensory and autonomic neuropathy type IV with neither mental retardation nor pain insensitivity[J]. J Child Neurol, 2013,28:1668-1672. |
| [13] | Lee ST,Lee J,Lee M,et al. Clinical and genetic analysis of Korean patients with congenital insensitivity to pain with anhidrosis [J]. Muscle Nerve, 2009,40:855-859. |
| [14] | Indo Y,Mardy S,Miura Y,et al. Congenital insensitivity to pain with anhidrosis (CIPA): novel mutations of the TRKA (NTRK1) gene,a putative uniparental disomy,and a linkage of the mutant TRKA and PKLR genes in a family with CIPA and pyruvate kinase deficiency [J]. Hum Mutat,2001,18:308-318. |
| [15] | Verpoorten N,Claeys KG,Deprez L,et al. Novel frameshift and splice site mutations in the neurotrophic tyrosine kinase receptor type 1 gene (NTRK1) associated with hereditary sensory neuropathy type IV[J]. Neuromuscular Disord,2006,16:19-25. |
| [16] | Haga N,Kubota M,Miwa Z,et al. Hereditary sensory and autonomic neuropathy types IV and V in Japan [J]. Pediatr Int, 2015,57:30-36. |
| [17] | Elsaid MF,Chalhoub N,Kamel H,et al. Non-truncating LIFR mutation: causal for prominent congenital pain insensitivity phenotype with progressive vertebral destruction? [J]. Clin Genet, 2015,89:210-216. |
| [18] | Itoh Y,Yagishita S,Nakajima S,et al. Congenital insensitivity to pain with anhidrosis: morphological and morphometrical studies on the skin and peripheral nerves [J]. Neuropediatrics, 1986,17:103-110. |
| [19] | Majuta LA,Longo G,Fealk MN,et al. Orthopedic surgery and bone fracture pain are both significantly attenuated by sustained blockade of nerve growth factor [J]. Pain, 2015,156:157-165. |
| [20] | Yasui M,Shiraishi Y,Ozaki N,et al. Nerve growth factor and associated nerve sprouting contribute to local mechanical hyperalgesia in a rat model of bone injury [J]. Euro J Pain, 2012,16:953-965. |
| [21] | Wieczorek S,Bergstrom J,Saaf M,et al. Expanded HSAN4 phenotype associated with two novel mutations in NTRK1 [J]. Neuromuscular Disord, 2008,18:681-684. |
| [22] | Bronicki LM,Stevenson RE,Spranger JW. Beyond osteogenesis imperfecta: Causes of fractures during infancy and childhood[J]. Am J Med Genet C Semin Med Genet, 2015, 109:314-327. |
| [23] | Kim OH,Jin DK,Kosaki K,et al. Osteogenesis imperfecta type V: clinical and radiographic manifestations in mutation confirmed patients [J]. Am J Med Genet A,2013,161A:1972-1979. |
| [24] | Miura Y,Mardy S,Awaya Y,et al. Mutation and polymorphism analysis of the TRKA (NTRK1) gene encoding a high-affinity receptor for nerve growth factor in congenital insensitivity to pain with anhidrosis (CIPA) families [J]. Hum Genet, 2000,106:116-124. |
| [25] | Indo Y. Molecular basis of congenital insensitivity to pain with anhidrosis (CIPA):mutations and polymorphisms in TRKA (NTRK1) gene encoding the receptor tyrosine kinase for nerve growth factor [J]. Hum Mutat,2001,18:462-471. |
| (收稿日期:2016-01-05) |

