进行性骨干发育不良症(progressive diaph-yseal dysplasia,PDD,OMIM 131300)是一种罕见的常染色体显性遗传性骨病,迄今仅报道300余例[1]。该病最早于1922年由Camurati明确为遗传性骨病,1929年由Engelmann首次报道,亦被称为Camurati-Engelmann病[2]。PDD患者以四肢疼痛、乏力、肌肉无力、跨阈步态为主要表现,骨骼X线片以长骨骨皮质局部增厚、硬化, 骨小梁粗乱为特点,亦可见颅骨和骨盆受累[3-4]。
近年来,研究发现TGFB1是PDD的致病基因[5]。TGFB1位于19q13,编码转化生长因子β1(transforming growth factor β1,TGF-β1),TGF-β1在骨基质中高度表达,具有调节细胞增生、迁移、分化、凋亡作用[6]。TGF-β1对骨骼具有复杂调节作用:一方面促进间充质干细胞增生、分化为骨母细胞,但抑制成骨细胞成熟、矿化;另一方面促进破骨细胞生成,但抑制破骨细胞分化,具有促进骨吸收作用[7]。
PDD临床表现具有高度异质性,诊断困难,明确致病基因突变有利于患者获得正确诊断和及时治疗。然而,目前国内尚缺乏关于PDD表现型和致病基因突变的大样本研究。本研究总结1例PDD患者临床特点,分析其致病基因突变,旨在提高对罕见遗传性骨病PDD的认识。
对象与方法 对象患儿,男,2岁11月,主诉:走路摇摆1年,于2017年8月就诊于北京协和医院内分泌科。患儿系第四胎第二产,母孕期平顺,足月剖腹产,出生体质量3.75 kg,身长51 cm,1岁会走路。患儿1岁开始出现步态摇摆、四肢乏力,否认骨痛、骨折史。个人史无特殊。家族史:父母非近亲婚配,否认类似患者。查体:身高105 cm,体质量15 kg(分别位于同年龄、同性别儿童+2 SD~+3 SD,+1 SD ~+2 SD),中等体型,四肢纤细,跨域步态,未见明显骨畸形。
本研究经北京协和医院伦理委员会批准,研究前征得患者及家属同意,并签署知情同意书。
临床特点评估采集患者清晨空腹静脉血。由北京协和医院检验科采用自动检测仪检测血常规、红细胞沉降率、丙氨酸氨基转移酶(alanine aminotransferase,ALT)、肌酐(creatinine,Cr)、肌酸激酶(crea-tine kinase,CK)、超敏C反应蛋白(high-sen-sitivity C-reactive protein,hsCRP)、血钙(cal-cium,Ca)、磷(phosphate,P),骨形成指标碱性磷酸酶(alkaline phosphatase,ALP)浓度。采用电化学发光免疫分析仪(E170; Roche Diagnostics, 瑞士)检测骨吸收指标Ⅰ型胶原C端肽β降解产物(β-cross-linked carboxy-terminal telopeptide of type Ⅰ collagen,β-CTX)、全段甲状旁腺素(parathyroid hormone,PTH)、25羟维生素D(25-hydroxyvitamin D,25OHD)浓度。采用双能X线吸收仪(Lunar Prodigy Advance, GE Healthcare, 美国)测量腰椎及髋部骨密度,根据中国正常儿童同年龄、同性别骨密度参考值[8],计算Z值。完成头颅、胸腰椎、双侧尺桡骨和股骨X线片。
TGFB1基因突变检测采集先证者及父母外周静脉血,提取基因组DNA(QIAampDNA Blood Mini试剂盒,德国)。采用Primer 3软件设计引物(表 1),扩增TGFB1的1~7所有编码外显子、外显子和内含子交界区及5'和3'侧翼序列。PCR扩增产物纯化后行Sanger测序(荧光自动测序仪,ABI3700,美国),并与参考序列NM_000660.5比对,确定TGFB1突变位点及类型。采用Polyphen2(http://genetics.bwh.harvard.edu/pph2/)进行保守性分析。
| 外显子 | 引物名称 | 引物序列(5′→3′) | 长度(bp) | 退火温度(℃) | 产物长度(bp) |
| Exon 1 | TGFB1-1F | FCCCACGCGAGATGAGGAC | 18 | 63 | 1 464 |
| TGFB1-1R | GCCAGTTTCTTCTGCCAGTC | 20 | |||
| Exon 2 | TGFB1-2F | GAGACTGACTCCACCCCAGA | 20 | 61 | 334 |
| TGFB1-2R | TTGGTCACAGCTCACCCTCT | 20 | |||
| Exon 3 | TGFB1-3F | GGTGGCTGTCTGAGAGGGTA | 20 | 60 | 349 |
| TGFB1-3R | GAGAGGGGTCCTAGGCAAAG | 20 | |||
| Exon 4 | TGFB1-4F | GGTTTGCTCCTTCCTTCCTC | 20 | 60 | 306 |
| TGFB1-4R | AGTGAACCCTGCTTTGGTGT | 20 | |||
| Exon 5 | TGFB1-5F | CGCCCCACTTATCTATCCCTC | 21 | 60 | 379 |
| TGFB1-5R | TCTTACACCCAGACCTCATCCC | 22 | |||
| Exon 6 | TGFB1-6F | GGGCATGTGGCTTCTATGGTGG | 22 | 58 | 276 |
| TGFB1-6R | CCTCTTCCTCCGTCCTGGCTC | 21 | |||
| Exon 7 | TGFB1-7F | GACAGGTGGGGAGAGACAGA | 20 | 60 | 957 |
| TGFB1-7R | CTGGTCTCAAATGCCTGGAT | 20 |
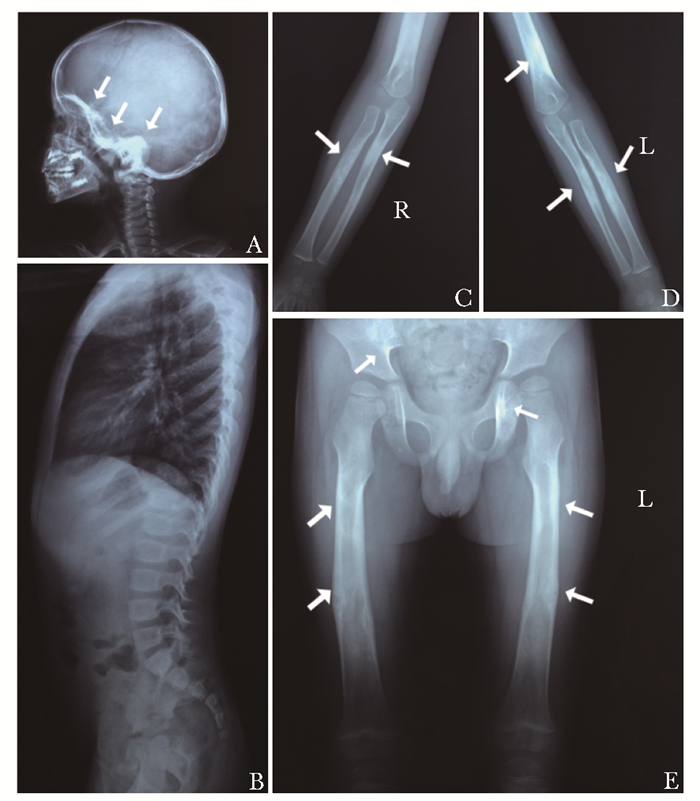
患者血常规、红细胞沉降率、hsCRP、CK、ALT、Cr、Ca、P、ALP、PTH均处于儿童正常参考范围内。患者血清25OHD浓度为22.0 μg/L,提示维生素D不足。血清β-CTX浓度为2.33 μg/L,高于儿童正常上限。患者骨密度显著降低:股骨颈骨密度0.406 g/cm2(Z值-3.9),腰椎2-4骨密度0.490 g/cm2(Z值-0.4)(表 2)。头颅侧位相可见颅底增厚、硬化;胸腰椎侧位相未见明显异常;双尺桡骨、股骨正位相见骨皮质局部增厚、硬化,骨小梁粗乱,相应髓腔狭窄,亦可见髂骨和坐骨支局部硬化(图 1)。
| 患者结果 | 正常参考范围 | |
| 身高(cm) | 105(+2 SD~+3 SD) | - |
| 体质量(kg) | 15(+1 SD~+2 SD) | - |
| WBC(×109) | 8.06 | 3.5~9.5 |
| RBC(×1012) | 5.01 | 4.0~5.5 |
| HGB(g/L) | 135 | 120~160 |
| PLT(×109) | 317 | 100~350 |
| ESR(mm/h) | 7 | 0~15 |
| hsCRP(mg/L) | 0.44 | 0~3.00 |
| CK(U/L) | 67 | 24~195 |
| ALT(U/L) | 8 | 9~50 |
| Cr(umol/L) | 18 | 18~88 |
| Ca(mmol/L) | 2.52 | 2.13~2.70 |
| P(mmol/L) | 1.85 | 1.29~1.94 |
| ALP(U/L) | 244 | 42~390 |
| β-CTX(μg/L) | 2.33 | 0.21~0.44 |
| 25OHD(μg/L) | 22.0 | 30~60 |
| PTH(ng/L) | 27.3 | 12~65 |
| FN-BMD(g/cm2) | 0.406 | - |
| FN-BMD Z值 | -3.9 | - |
| LS-BMD(g/cm2) | 0.490 | - |
| LS-BMD Z值 | -0.4 | - |
| WBC:白细胞;RBC:红细胞;HGB:血红蛋白;PLT:血小板;ESR:红细胞沉降率;hsCRP:超敏C反应蛋白;CK:肌酸激酶;ALT:丙氨酸氨基转移酶;Cr:肌酐;Ca:血钙;P:血磷;ALP:碱性磷酸酶;β-CTX: Ⅰ型胶原C端肽β降解产物;25OHD: 25羟维生素D;PTH:甲状旁腺素;FN-BMD:股骨颈骨密度;LS-BMD:腰椎骨密度 | ||
|
| 图 1 进行性骨干发育不良症患者影像学表现 Figure 1 Imaging features of the PDD patient A.头颅侧位像:颅骨底板增厚、硬化(箭头);B.胸腰椎侧位像:未见明显异常;C. D. E.双侧尺桡骨、股骨正位像:骨皮质局部增厚、硬化,骨小梁粗乱,髓腔狭窄,股骨正位像亦可见髂骨、坐骨支局部骨质硬化(箭头) |
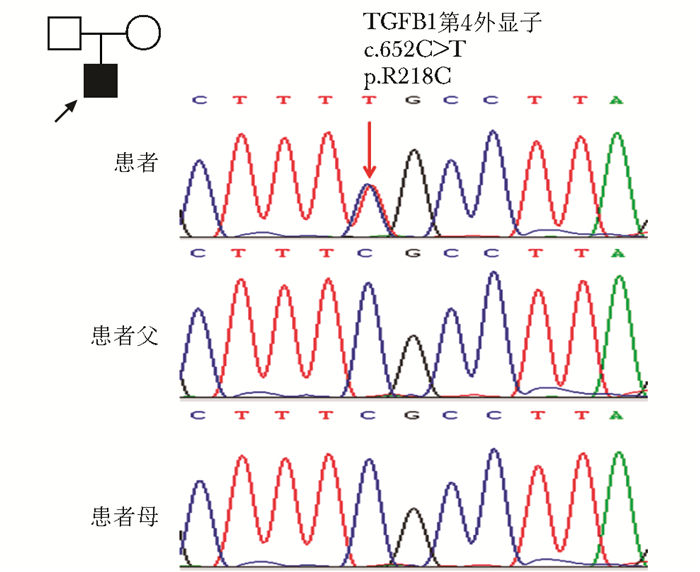
患者存在TGFB1基因第4外显子c.652C>T杂合错义突变,导致TGF-β1第218位精氨酸被半胱氨酸替换(p.R218C)。父母均未发现携带该突变,为新生突变(de novo mutation)(图 2)。该突变位点在人、小鼠、大鼠、猪、牛、马等多个物种中高度保守(图 3)。
|
| 图 2 进行性骨干发育不良症患者家系图及TGFB1基因测序结果 Figure 2 Pedigree of the PDD family and Sanger sequencing results of the TGFB1 gene PDD:进行性骨干发育不良症 |
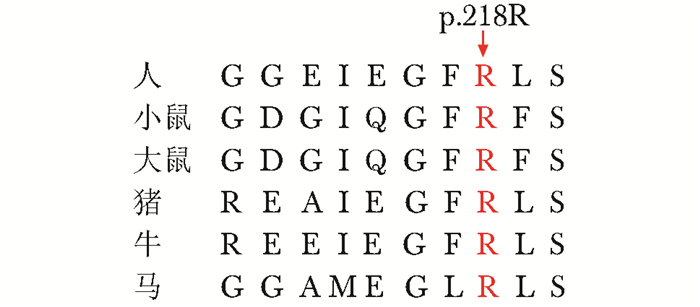
|
| 图 3 突变位点p.218R在哺乳动物中保守性分析 Figure 3 Conservation of the p.218R among mammals |
根据患者典型临床特征,结合基因检测结果,明确诊断为PDD,给予15 mg/d起始剂量的泼尼松进行试验性治疗,同时补充钙剂300 mg/d,维生素D 1 000 IU/d,目前正在随访观察中。
讨论PDD是一种罕见的单基因遗传性骨病,本研究患者自幼起病,以跨域步态、四肢乏力为主要临床表现,以四肢长骨、颅骨、骨盆局部骨质增厚硬化,骨小梁粗乱为影像特点,基因检测证实TGFB1基因第4外显子c.652C>T突变为本例致病原因。
PDD常常自幼起病,临床表型多样。比利时学者总结100例PDD患者,发现四肢疼痛、跨阈步态和肌肉无力是常见症状,分别占68%、48%和39%[5]。患者可因颅底硬化出现视力、听力下降及面瘫症状[9]。亦有研究报道PDD患者可出现青春发育延迟[10]。本例患者病程短,主要表现为跨阈步态和四肢乏力,无骨痛,有颅底局灶性骨骼硬化,但尚无视力及听力异常。生化检查,PDD患者可有红细胞沉降率增快、血红蛋白降低、骨转换指标升高[6, 9, 11]。本例患者β-CTX较同年龄儿升高,提示骨转换活跃,骨吸收增加。由于骨吸收增加,骨形成和骨吸收脱偶联,PDD患者骨密度显著降低,本例患者骨密度明显低于同年龄同性别儿童,与既往研究结果相同[6]。此外,PDD患者多存在维生素D不足,考虑可能与患者肌肉无力,活动较少相关[10, 12]。影像学方面,以往研究显示,94%患者有典型四肢长骨受累表现:四肢管状骨皮质对称性、进行性增厚,骨干不同程度增粗,骨髓腔狭窄或闭塞,但不侵犯骨骺;63%患者有骨盆受累表现:盆骨局部骨皮质增生、硬化;54%患者有颅骨受累表现:内外板增厚,板障狭窄甚至消失,颅底骨皮质增生、硬化,致使颅底孔径缩窄,但颅缝不受侵袭[5, 9]。本例患者影像学特点与之相符。
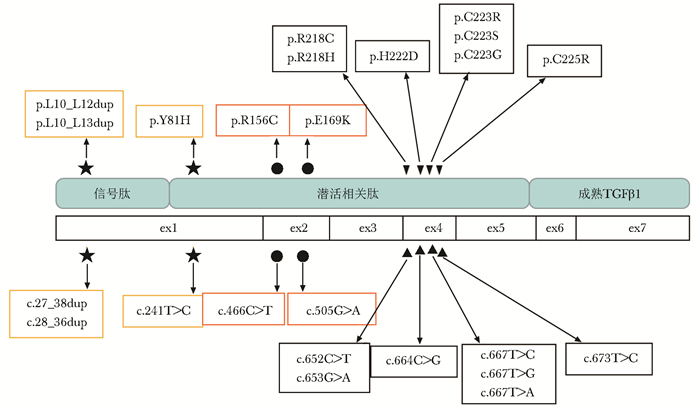
TGFB1基因突变是PDD的主要致病原因,该基因具有7个外显子,转录和翻译后形成TGF-β1前体复合物,包括信号肽、潜活相关肽(latency associated peptide,LAP)和成熟TGF-β1。在信号肽作用下,TGF-β1前体复合物分泌到细胞外。在胞外基质中经酶解后,产生LAP和TGF-β1组成无活性的环状复合物,该复合物通过LAP上二硫键相连形成二聚体。当整合素与LAP中的精氨酸-甘氨酸-天冬氨酸结构域相结合后,环状复合物二聚体解离,成熟TGF-β1被激活,从而发挥其生物学效应[13]。目前已报道12种导致PDD的TGFB1突变类型,根据对蛋白质影响分为三大类(图 4):突变位于第1外显子区域,包括信号肽区域的亮氨酸插入(p.L10_L12dup、p.L10_L13dup)和LAP的N末端错义突变(p.Y81H),导致TGF-β1前体复合物分泌到细胞外受阻,大量异常TGF-β1在胞内聚集,启动细胞的增强转录反应[14];突变位于第2外显子区域,LAP的N末端错义突变(p.R156C、p.E169K),引起局部电子异常交换,破坏环状复合物二聚体稳定性,导致TGF-β1异常活化[15];突变位于第4外显子区域,即LAP的C末端错义突变(p.R218C/H、p.H222D、p.C223R/S/G、p.C225R),破坏二硫键形成,引起LAP结构异常,环状复合物二聚体解离,TGF-β1被激活[16]。上述PDD致病突变,最终均使循环和骨骼中活性TGF-β1比例升高,引起骨细胞增生、骨转换增快,抑制正常骨骼矿化,从而出现骨转换加快,局部骨皮质增生、硬化,骨密度下降,骨折风险增加。在以上突变中,p.R218C约占所有突变60%以上,被认为是PDD的热点突变[17],中国人群中已有该突变的报道[6, 12],本例也是由该热点突变所致。该突变位点位于高度保守的疏水区,通过影响LAP二硫键形成, 导致TGF-β1异常活化[16]。
|
| 图 4 进行性骨干发育不良症患者TGFB1基因突变类型 Figure 4 TGFB1 mutations type in progressive diaphyseal dysplasia ★:影响TGF-β1前体复合物分泌; ●:引起局部电子异常交换; ▲:破坏二硫键形成; ex:外显子; 本例患者携带第4外显子区c.652C>T(p.R218C)突变 |
PDD尚无理想的治疗措施,目前均为对症治疗[12]。糖皮质激素能够抑制骨形成,缓解骨骼肌肉疼痛,已有研究报道短期使用糖皮质激素能够改善患者临床症状[12, 18],但合适的治疗剂量、疗效观察指标尚不清楚,长期药物治疗对儿童生长及骨骼的影响值得关注[5]。有研究显示双膦酸盐能够抑制PDD患者骨吸收,增加骨密度,降低骨折风险,缓解病情[19-20],但也有研究显示双膦酸盐会加重PDD患者骨痛[21]。降钙素和非甾体抗炎药主要用于缓解疼痛[5]。近期,新西兰研究发现血管紧张素Ⅱ受体拮抗剂具有抑制TGF-β1信号通路作用,能够缓解PDD患者疼痛,提高活动能力[22]。动物实验发现TGF-βⅠ型受体拮抗剂能够改善PDD骨骼损害[23]。未来针对骨骼和肌肉局部TGF-β1及其下游分子的靶向治疗,可能成为PDD的有效治疗措施[24]。
综上所述,PDD是一种罕见常染色体显性遗传性骨病,对本例PDD患者的临床表型及致病机制研究,表明TGFB1基因激活性突变可导致PDD,p.R218C突变是该病的热点突变,其导致患儿骨骼异常及肌肉减少。本研究对PDD表型及致病分子机制的研究,有助于加深对此罕见遗传性骨病的认识。
| [1] | Kinoshita A. Camurati-Engelmann disease[J]. Nihon Rinsho, 2015, 73: 2149–2159. |
| [2] | Chen Y, Xie W, Hu F, et al. Clinical diagnosis and mutation analysis of a Chinese family with Camurati-Engelmann disease[J]. Mol Med Rep, 2017, 15: 235–239. DOI:10.3892/mmr.2016.6024 |
| [3] | de Bonilla DA, Garcia GF. Camurati-Engelmann disease[J]. Reumatol Clin, 2017, 13: 48–49. DOI:10.1016/j.reuma.2015.12.004 |
| [4] | Carlson ML, Beatty CW, Neff BA, et al. Skull base manifestations of Camurati-Engelmann disease[J]. Arch Otolaryngol Head Neck Surg, 2010, 136: 566–575. DOI:10.1001/archoto.2010.68 |
| [5] | Janssens K, Vanhoenacker F, Bonduelle M, et al. Camurati-Engelmann disease:review of the clinical, radiological, and molecular data of 24 families and implications for diagnosis and treatment[J]. J Med Genet, 2006, 43: 1–11. |
| [6] | Wang C, Zhang BH, Liu YJ, et al. Transforming growth factor-beta1 gene mutations and phenotypes in pediatric patients with CamuratiEngelmann disease[J]. Mol Med Rep, 2013, 7: 1695–1699. DOI:10.3892/mmr.2013.1367 |
| [7] | Wu M, Chen G, Li YP. TGF-beta and BMP signaling in osteoblast, skeletal development, and bone formation, homeostasis and disease[J]. Bone Res, 2016, 4: 16009. DOI:10.1038/boneres.2016.9 |
| [8] | Xu H, Zhao Z, Wang H, et al. Bone mineral density of the spine in 11, 898 Chinese infants and young children:a cross-sectional study[J]. PLoS One, 2013, 8: e82098. DOI:10.1371/journal.pone.0082098 |
| [9] | Bartuseviciene A, Samuilis A, Skucas J. Camurati-Engelmann disease:imaging, clinical features and differential diagnosis[J]. Skeletal Radiol, 2009, 38: 1037–1043. DOI:10.1007/s00256-008-0642-1 |
| [10] | Whyte MP, Totty WG, Novack DV, et al. Camurati-Engelmann disease:unique variant featuring a novel mutation in TGFbeta1 encoding transforming growth factor beta 1 and a missense change in TNFSF11 encoding RANK ligand[J]. J Bone Miner Res, 2011, 26: 920–933. DOI:10.1002/jbmr.283 |
| [11] | 刘琳香. 进行性骨干发育不良的临床及影像学分析[J]. 实用放射学杂志, 2016, 32: 1814–1816. DOI:10.3969/j.issn.1002-1671.2016.11.044 |
| [12] | 徐晓杰, 马豆豆, 吕芳, 等. TGFB1基因突变导致罕见进行性骨干发育不良[J]. 协和医学杂志, 2015: 327–332. DOI:10.3969/j.issn.1674-9081.2015.05.003 |
| [13] | Shi M, Zhu J, Wang R, et al. Latent TGF-beta structure and activation[J]. Nature, 2011, 474: 343–349. DOI:10.1038/nature10152 |
| [14] | Janssens K, Ten DP, Ralston SH, et al. Transforming growth factor-beta 1 mutations in Camurati-Engelmann disease lead to increased signaling by altering either activation or secretion of the mutant protein[J]. J Biol Chem, 2003, 278: 7718–7724. DOI:10.1074/jbc.M208857200 |
| [15] | Wu S, Liang S, Yan Y, et al. A novel mutation of TGF beta1 in a Chinese family with Camurati-Engelmann disease[J]. Bone, 2007, 40: 1630–1634. DOI:10.1016/j.bone.2007.02.025 |
| [16] | Walton KL, Makanji Y, Chen J, et al. Two distinct regions of latency-associated peptide coordinate stability of the latent transforming growth factor-beta1 complex[J]. J Biol Chem, 2010, 285: 17029–17037. DOI:10.1074/jbc.M110.110288 |
| [17] | Campos-Xavier B, Saraiva JM, Savarirayan R, et al. Phenotypic variability at the TGF-beta1 locus in Camurati-Engelmann disease[J]. Hum Genet, 2001, 109: 653–658. DOI:10.1007/s00439-001-0644-8 |
| [18] | Inaoka T, Shuke N, Sato J, et al. Scintigraphic evaluation of pamidronate and corticosteroid therapy in a patient with progressive diaphyseal dysplasia (Camurati-Engelmann disease)[J]. Clin Nucl Med, 2001, 26: 680–682. DOI:10.1097/00003072-200108000-00003 |
| [19] | Iba K, Takada J, Kamasaki H, et al. A significant improvement in lower limb pain after treatment with alendronate in two cases of Camurati-Engelmann disease[J]. J Bone Miner Metab, 2008, 26: 107–109. DOI:10.1007/s00774-007-0783-7 |
| [20] | Savoie A, Gouin F, Maugars Y, et al. Treatment responses in five patients with Ribbing disease including two with 466C>T missense mutations in TGF beta1[J]. Joint Bone Spine, 2013, 80: 638–644. DOI:10.1016/j.jbspin.2013.01.007 |
| [21] | Castro GR, Appenzeller S, Marques-Neto JF, et al. Camurati-Engelmann disease:failure of response to bisphosphonates:report of two cases[J]. Clin Rheumatol, 2005, 24: 398–401. DOI:10.1007/s10067-004-1056-7 |
| [22] | Ayyavoo A, Derraik JG, Cutfield WS, et al. Elimination of pain and improvement of exercise capacity in Camurati-Engelmann disease with losartan[J]. J ClinEndocrinol Metab, 2014, 99: 3978–3982. DOI:10.1210/jc.2014-2025 |
| [23] | Tang Y, Wu X, Lei W, et al. TGF-beta1-induced migration of bone mesenchymal stem cells couples bone resorption with formation[J]. Nat Med, 2009, 15: 757–765. DOI:10.1038/nm.1979 |
| [24] | Szweras M, Liu D, Partridge E A, et al. alpha 2-HS glycoprotein/fetuin, a transforming growth factor-beta/bone morphogenetic protein antagonist, regulates postnatal bone growth and remodeling[J]. J Biol Chem, 2002, 277: 19991–19997. DOI:10.1074/jbc.M112234200 |
| (收稿日期:2017-09-18) |

