2. 730050 兰州,兰州总医院药剂科
2. Department of Pharmacy, Lanzhou General Hospital, Lanzhou 730050, China
骨质疏松症(osteoporosis,OP)是一种以骨量减少、骨的微观结构退化为特征,并表现为骨脆性增加及易于发生骨折的全身性骨骼疾病[1]。OP易发生于绝经后妇女[2-3]。蔡辉等[4]认为活血化瘀中药在治疗OP上呈现出多靶点、多环节、多通路, 效果明显, 不良反应少等特点。因此探索活血中药预防与治疗骨质疏松症无疑具有潜在价值。丹参酮ⅡA是活血化瘀中药丹参中主要有效成分之一。实验研究表明丹参酮具有较温和的雌激素样活性[5],丹参酮ⅡA对体外培养破骨细胞具有抑制作用[6-7],并能抑制骨吸收及降低骨转换率以延缓或阻断绝经后快速骨丢失[8],能防止去卵巢大鼠腰椎和胫骨松质骨的丢失[9]。本实验以卵巢摘除大鼠为骨质疏松模型,观察丹参酮ⅡA对雌激素缺乏引起OP的防治作用。
材料与方法 试剂与仪器丹参酮ⅡA(陕西宝鸡辰光生物科技有限公司,批号:20150816);炔雌醇(湖北康宝泰精细化工有限公司,批号:20160801);10%水合氯醛(天津市光复精细化工研究所);双能X线骨密度仪(Lunar Prodigy, GE公司,美国);AG-IS万能材料试验机(岛津公司,日本);SP1600硬组织切片机(LEICA公司,德国);正置荧光显微镜(BX51,Olympus公司,日本)。
实验动物3月龄SD雌性大鼠40只,体质量(240±3)g,购买于中国农业科学院兰州兽医研究所,实验动物合格证号:SCXK(甘)2015-0001,饲养于兰州军区总医院动物科SPF级实验室,实验室许可证号:SYXK(军)2012-0029,自由饮水(自来水)和进食。
分组和给药3月龄SD大鼠采用数字表法随机分为4组,每组10只,分别为假手术组(Sham组)、单纯卵巢切除组(Ovx组)、雌激素治疗组和丹参酮ⅡA治疗组。1周后每组口服给药,丹参酮ⅡA用蒸馏水配成1.1 g/L的混悬液,按每只大鼠11 mg/(kg·d)给药;雌激素组用蒸馏水将炔雌醇配成0.02 g/L的溶液,按每只大鼠200 mg/(g·d)给药;单纯卵巢摘除组与假手术组每日给予与治疗组同等体积的蒸馏水,每两周称1次体质量。根据成魁等[10]用金雀异黄酮的浓度(10 mg/kg)转换成同样摩尔浓度的蛇床子素(与前者为不同物质)的方法换算出丹参酮ⅡA的给药剂量,即为11 mg/kg。
骨密度的测定1个月测1次全身骨密度(bone mineral density,BMD),检测前先腹腔注射10%水合氯醛(0.3mL/kg)麻醉,给药3个月后处死所有实验动物,剥离椎骨、双侧股骨和胫骨,并保存于4%多聚甲醛中,测定椎骨和左侧股骨BMD。
大鼠股骨三点弯曲实验将右侧股骨从4%多聚甲醛中取出,剔除附着的组织,进行三点弯曲试验。跨距为13 mm,速度为10 mm/min。记录载荷变形曲线,得到最大载荷和弹性模量等指标。
大鼠椎骨压缩实验将椎骨从4%多聚甲醛中取出,剪取大鼠L4椎,除去附着的组织,将椎体上下两面磨平,置于钢制平台上,进行压缩实验,加载速度为2 mm/min,过最大载荷后停止加载,记录载荷变形曲线,得出最大载荷和弹性模量等指标。
骨形态计量分析将右侧胫骨从4%多聚甲醛中取出。依次进行脱水、包埋、切片,再用1 000、1 500、2 000目的砂纸均匀打磨至半透明,用品红-苦味酸Van-Gieson, VG)进行染色。镜下观察骨组织形态结构。
荧光标记大鼠处死前第21、22天皮下注射四环素,剂量为25 mg/kg;处死前第13、14天皮下注射茜素红,剂量为30 mg/kg;处死前第3、4天皮下注射钙黄绿素,剂量为10 mg/kg。按前述方法制成不脱钙切片(未染色的白片),镜下观察各组3种荧光之间的距离变化,并用IPP6.0软件进行量化。
子宫内膜形态学观察处死大鼠后,称取子宫质量,计算子宫系数(子宫系数=子宫质量/大鼠体质量)。将其固定于10%甲醛中,经过固定、脱水、包埋、切片、HE染色和封片等处理后,在光镜显微镜下进行观察各组子宫内膜厚度的变化。
统计学方法采用SPSS 17.0分析软件进行分析,数据用平均值±标准差(x±s)表示,单因素方差分析采用LSD法,以P<0.05为差异有统计学意义。
结果 各组大鼠体质量改变和子宫系数观测值Ovx组大鼠体质量明显增加,给予丹参酮ⅡA治疗大鼠体质量增长与假手术组差异无统计学意义,雌激素组大鼠体质量增加落后于其他各组,差异有统计学意义(P<0.01)。丹参酮ⅡA组的子宫系数比Ovx组高,但差异无统计学意义(P>0.05),而明显低于雌激素组,且差异有统计学意义(P<0.01)(表 1)。
| 组别 | 体质量(kg) | 子宫系数 (g/kg) |
|
| 实验前 | 实验后 | ||
| 基线组 | 240.10±9.97 | - | - |
| Ovx组 | 240.20±13.34 | 282.38±16.92 | 0.900±0.389 |
| Sham组 | 240.00±9.98 | 259.75±18.12* | 3.000±1.865** |
| 丹参酮ⅡA组 | 242.10±11.28 | 278.2±11.65 | 0.925±0.553 |
| 雌激素组 | 243.20±11.26 | 248.33±15.57** | 2.386±0.495** |
| OVX:卵巢切除;Sham:假手术;与Ovx组比较,*P<0.05,**P<0.01 | |||
3个月后,Ovx组与Sham组相比,全身BMD、离体的股骨和椎骨BMD明显下降。与Ovx组相比,丹参酮ⅡA组和雌激素组的全身BMD明显提高,差异有统计学意义(P<0.05),而丹参酮ⅡA组和雌激素组组间比较,差异无统计学意义(P>0.05)(表 2,3)。
| 组别 | 全身BMD(g/cm2) | ||
| 1个月后 | 2个月后 | 3个月后 | |
| Ovx组 | 0.143±0.006 | 0.143±0.004 | 0.143±0.005 |
| Sham组 | 0.141±0.008 | 0.146±0.006 | 0.153±0.005* |
| 丹参酮ⅡA组 | 0.144±0.007 | 0.148±0.009 | 0.149±0.008* |
| 雌激素组 | 0.147±0.005 | 0.147±0.009 | 0.153±0.008* |
| Ovx:卵巢切除;Sham:假手术;BMD:骨密度;与Ovx组比较,*P<0.05 | |||
| 组别 | 股骨BMD(g/cm2) | 椎骨BMD(g/cm2) |
| Ovx组 | 0.1343±0.0082 | 0.1346±0.0096 |
| Sham组 | 0.1433±0.0035* | 0.1461±0.0078** |
| 丹参酮ⅡA组 | 0.1426±0.0075* | 0.1440±0.0055* |
| 雌激素组 | 0.1421±0.0092* | 0.1446±0.0098** |
| Ovx:卵巢切除;Sham:假手术;BMD:骨密度;与Ovx组比较,*P<0.05,**P<0.01 | ||
Ovx组与Sham组相比,股骨三点弯曲实验和椎骨压缩实验的最大载荷均明显下降, 差异有统计学意义(P<0.05),虽然弹性模量的差异无统计学意义(P>0.05),但也有下降趋势。与Ovx组比较:丹参酮ⅡA组和雌激素组股骨三点弯曲实验和椎骨压缩实验的最大载荷均有所提高,差异有统计学意义(P<0.05),而丹参酮ⅡA组和雌激素组组间差异无统计学意义(P>0.05);丹参酮ⅡA组弹性模量与Ovx组之间差异无统计学意义(P>0.05),但丹参酮ⅡA组的均值高于Ovx组(表 4,5)。
| 组别 | 最大载荷(N) | 弹性模量(mPa) |
| Ovx组 | 140.74±13.29 | 8 036.5±2 756.2 |
| Sham组 | 161.82±23.61* | 8 747.2±3 407.9 |
| 丹参酮ⅡA组 | 159.86±12.37* | 10 043.9±2 766.5 |
| 雌激素组 | 161.96±15.75* | 11 115.6±3 208.1* |
| Ovx:卵巢切除;Sham:假手术;BMD:骨密度;与Ovx组比较,*P<0.05 | ||
| 组别 | 最大载荷(N) | 弹性模量(mPa) |
| Ovx组 | 214.13±70.30 | 284.92±110.94 |
| Sham组 | 282.77±34.79* | 416.68±170.71 |
| 丹参酮ⅡA组 | 267.58±33.42* | 292.44±128.34 |
| 雌激素组 | 271.03±30.99* | 292.39±112.29 |
| Ovx:卵巢切除;Sham:假手术;BMD:骨密度;与Ovx组比较,*P<0.05 | ||
骨组织呈红色,骨骺线下红色网状结构为骨小梁,Ovx组红色结构稀疏,丹参酮ⅡA组和雌激素组骨小梁结构与假手术Sham组相差不大,并明显密于Ovx组(图 1)。
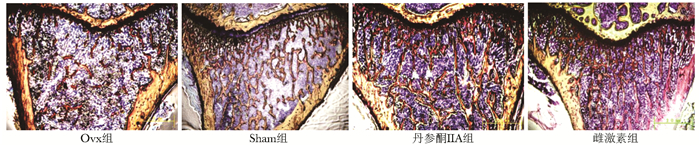
|
| 图 1 不同干预组大鼠胫骨近心干骺端骨组织形态学比较(×40) Figure 1 Morphological comparison of proximal tibial metaphysis among different intervention groups (×40) |
与Ovx组相比,丹参酮ⅡA组和雌激素组的大鼠胫骨钙黄绿素和茜素红之间、茜素红和四环素之间的距离明显较大, 表明口服丹参酮ⅡA可加快骨的生长(图 2)。给药组均与Ovx组有极显著差异,与Sham组的值相差不大(表 6)。
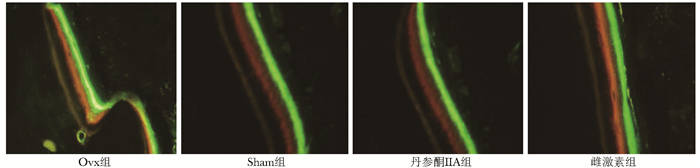
|
| 图 2 不同干预组胫骨中段皮质骨荧光标记结果比较(×20) Figure 2 Comparison of fluorescence labeling of cortical bone in the middle tibia among different intervention groups (×20) 黄色为四环素标记,红色为茜素标记,绿色为钙黄绿素标记 |
| 组别 | 荧光距离(μm) | |
| L(黄-红) | L(红-绿) | |
| Ovx组 | 15.77±0.99 | 10.09±1.23 |
| Sham组 | 22.70±1.16** | 16.08±1.09** |
| 丹参酮ⅡA组 | 22.55±1.58** | 16.78±1.24** |
| 雌激素组 | 24.10±0.85** | 16.80±0.56** |
| Ovx:卵巢切除;Sham:假手术;与Ovx组比较,*P<0.05,**P<0.01 | ||
Sham组子宫内膜较厚,腺体较多,表面为一层高而密的假柱状上皮;Ovx组子宫内膜组织萎缩变薄,腺体稀少,表面为一层小而圆的单层上皮细胞;丹参酮ⅡA组与Sham组相差不大,雌激素组子宫内膜明显增厚(图 3)。
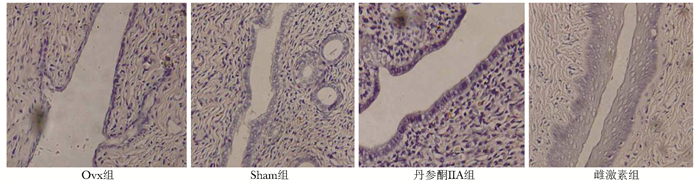
|
| 图 3 不同干预组大鼠子宫组织形态学比较(×40) Figure 3 Morphology of uterine tissue under the optical microscope(×40) |
妇女绝经或经卵巢摘除术后,由于体内雌激素水平的降低而使骨代谢呈负平衡,破骨细胞性骨吸收增强,成骨细胞性骨形成减少,骨量逐步减少。雌激素对绝经后OP的疗效已经得到充分的肯定,但其诸多的不良反应使人们不得不继续寻找有效药物。中草药治疗绝经后OP已成为国内医学界的研究热点。
骨骼强健与否有赖后天气血之充养,气血对骨骼的滋养是骨骼维持正常形态和功能的关键,而一旦瘀血阻滞,脉络不通,骨失所养,必发为“骨痿”。目前,中医临床上偏重于补肾,而忽略了活血化瘀药的作用。早期就有研究发现丹参酮可以防止以维甲酸诱导的大鼠OP模型的骨丢失,其机制可能与提高激素水平、抑制骨高转换有关[11]。因此考虑丹参酮ⅡA是否具有预防与治疗由雌激素缺乏引起的OP。目前国内外还未发现关于丹参酮ⅡA治疗以切除卵巢大鼠所致的绝经后OP症模型的相关研究。本实验以卵巢摘除大鼠为骨质疏松模型,观察丹参酮ⅡA对雌激素缺乏引起OP的防治作用。
BMD和骨生物力学是检测骨质量的两个重要的部分,其中BMD为黄金指标[12]。骨形态计量学是对骨组织微结构的一个重要的评价指标,反映了机体组织形态学方面的变化。本实验应用丹参酮ⅡA治疗的大鼠其BMD与卵巢切除组差异有统计学意义,而与假手术组的差异无统计学意义,充分肯定了丹参酮ⅡA在防治大鼠卵巢摘除后骨质疏松中的作用。从实验中切下的子宫标本看,炔雌醇组大鼠子宫明显增大增粗,而丹参酮ⅡA组与假手术组相近,卵巢切除组则明显萎缩,在子宫系数的对比中可以看到这一明显趋势。研究各项指标显示炔雌醇的防治作用优于丹参酮ⅡA,但是其对子宫的不良反应大。
综上所述,3个月后,单纯摘除卵巢组与假手术组相比,全身BMD、骨质量明显下降,而丹参酮ⅡA和雌激素明显提高了大鼠BMD和骨质量,并改善了骨的微观结构、加快了骨的生长。表明丹参酮ⅡA和炔雌醇对去卵巢大鼠所致的骨丢失起到防治作用。但丹参酮ⅡA在体内的代谢尚不清楚,进一步探索丹参酮ⅡA对绝经后OP的研究很有必要,可为更具选择性与安全性的绝经后OP治疗新药的开发提供理论依据与实验基础。
| [1] | Ohta H, Solanki J. Incorporating bazedoxifene into the treatment paradigm for postmenopausal osteoporosis in Japan[J]. Osteoporos Int, 2015, 26: 849–863. DOI:10.1007/s00198-014-2940-x |
| [2] | Cosman F, de Beur SJ, Leboff MS, et al. Clinician's guide to prevention and treatment of osteoporosis[J]. Osteoporosis Int, 2015, 26: 2045–2047. DOI:10.1007/s00198-015-3037-x |
| [3] | Zhao XL, Feng YX, Peng Y. Prevention and treatment of osteoporosis with Chinese herbal medicines[J]. Chin Herb Med, 2012, 4: 265–270. |
| [4] | 蔡辉, 邱艳, 赵凌杰. 单味活血化瘀中药治疗骨质疏松症的实验研究进展[J]. 中医药导报, 2014, 20: 55–57. DOI:10.3969/j.issn.1672-951X.2014.09.024 |
| [5] | 高玉桂, 王灵芝, 唐冀雪. 丹参酮的性激素样活性[J]. 中国医学科学院学报, 1980, 2: 190. |
| [6] | 杨玉鹏. 丹参酮ⅡA对破骨细胞形成及分化的影响[D]. 石家庄: 河北医科大学, 2009, 30. |
| [7] | Kwak HB, Yang D, Ha H, et al. Tanshinone ⅡA inhibits osteoclast differentiation through down-regulation ofc-Fos and NFATc1[J]. Exp Mol Med, 2006, 38: 256–264. DOI:10.1038/emm.2006.31 |
| [8] | Nicolin V, Dal Piaz F, Nori SL. Inhibition of bone resorption by tanshinone Ⅵ isolated from salvia miltiorrhiza bunge[J]. Eur J Histochem, 2010, 54: 104–106. |
| [9] | Cui L, Wu T, Liu YY, et al. Tanshinone prevents cancellous bone loss induced by ovariectomy in rats[J]. Acta Pharmacol Sin, 2004, 25: 678–684. |
| [10] | 成魁, 葛宝丰, 甄平, 等. 蛇床子素与金雀异黄酮对大鼠峰值骨量影响的比较研究[J]. 中国骨伤, 2014, 27: 587–591. DOI:10.3969/j.issn.1003-0034.2014.07.013 |
| [11] | 周延萌, 刘玉波, 高允生. 丹参酮对维甲酸致小鼠骨质疏松的防治作用[J]. 中国中药杂志, 2010, 35: 2923–2926. |
| [12] | Steven RC, David B, Dennis MB. Clinical use of bone densitometry[J]. JAMA, 2002, 288: 1898–1900. DOI:10.1001/jama.288.15.1898 |
| (收稿日期:2017-09-30) |

