2. 661000 个旧,昆明医科大学第五附属医院/红河州滇南中心医院超声医学科;
3. 661000 个旧,昆明医科大学第五附属医院/红河州滇南中心医院核医学科
2. Department of Ultrasonic Medicine, The Fifth Affiliated Hospital of Kunming Medical University Yunnan(Honghe South Central Hospital) Gejiu 661000, Yunnan, China;
3. Department of Nuclear Medicine, The Fifth Affiliated Hospital of Kunming Medical University Yunnan(Honghe South Central Hospital) Gejiu 661000, Yunnan, China
自身免疫性多内分泌腺病综合征(autoimmune polyendocrinopathy syndrome,APS)指两个或两个以上的内分泌腺体因为自身免疫功能缺陷而同时发生功能减退或亢进。本文报告1例以精神神经异常为主要症状、长期接受抗抑郁及抗癫痫药物治疗的特发性甲状旁腺功能减退症(idiopathic hypopatarhroidism,IHP)患者,伴肌酶升高,同时并发桥本甲状腺炎,临床考虑APS-1型的诊断,以期提高临床医生对IHP及APS-1型的认识。
病历摘要患者女性,22岁,因“情绪低落、消极、悲观、绝望2年,反复四肢强直性痉挛1年半”于2016年9月就诊于昆明医科大学第五附属医院。患者2年前无明显诱因出现头昏、情绪低落、悲观厌世,1年半来无明显诱因反复出现四肢强直性痉挛,发作时意识清楚、全身肌肉酸痛,无头痛、呼吸障碍或恶心、呕吐,无唇舌咬伤、二便失禁,每次发作持续约数秒至数分钟,休息后自行缓解,无肢体感觉或活动不灵,2015年4月至2016年8月以上抽搐共发作数十次,有时1日内可发作2~3次。曾在当地医院门诊查“血钙低”(不详)及“脊柱侧弯、腰椎间盘脱出”。CT提示右肺下叶基底段钙化,诊断为“重度抑郁、癫痫样大发作”,予“左乙拉西坦片0.5 g,1~2次/d,奥氮平1.25 mg,1次/d”治疗,同时不规律自服“钙片,1片,2次/d”及“中药”(不详)治疗至今。近2~3个月自觉悲观情绪有好转,但食欲低下、烦躁易怒、兴趣减低、记忆力差、手足阵发麻木,脱发较为明显。未按时服用“左乙拉西坦”时四肢抽搐仍时有发作,但发作时间和症状较前减轻,及时服药后可逐渐缓解。无皮肤变黑,平日不易感冒,无乏力、纳差或口干、多尿、多饮,无脸变圆红、皮肤紫纹、多毛、痤疮,无手足变大,无眉弓、额头或下颌突出,无视力下降,否认怕冷、怕热、心悸、多汗、消瘦,否认皮疹或口腔、会阴、肛周溃疡,否认脱发、光过敏、游走性骨关节痛或脆性骨折,否认腰痛、肉眼血尿或尿中排石,否认高血压病史。精神、体力可,全日尿量约2 100 mL,夜尿1次,大便1次/d,无便秘,体质量稳定。既往史、个人史无特殊,否认家族中类似病史。
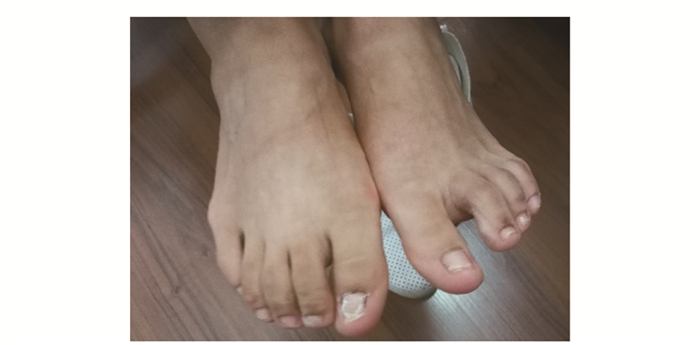
查体身高157 cm,体质量50 kg,脉搏70次/min,血压100/70 mmHg(1 mmHg=0.133 kPa),皮肤不干不潮,颜色正常,掌纹不深,关节易摩擦处无色素沉着,无脸圆、颈短、短指、趾畸形或牛奶咖啡斑,未见口腔、会阴、肛周白斑或溃疡,指/趾甲无真菌感染征象。双眼不突,眼球活动度好,粗侧视力、视野正常,牙齿正常,甲状腺不大,质地中等,无压痛或结节,活动度好,无血管杂音,心率70次/min,律齐,双肺无啰音,腹软,无压痛,肝脾未及,肝肾区无叩痛,脊柱向右侧弯,棘突无压痛,双下肢不肿,双侧第一足趾趾甲粗糙(图 1),四肢腱反射亢进,面神经叩击试验及束臂加压试验阳性。
|
| 图 1 患者脚趾甲:第一足趾甲粗糙变形 Figure 1 Toe nails of the patient:rough deformation of the first toe nail |
血、尿、便常规,肝、肾功能,血脂、尿酸正常。动脉血气分析:酸碱度7.42,碱剩余0 mmol/L(-3~+3 mmol/L),实际碳酸氢根离子25 mmol/L(22~27 mmol/L),二氧化碳总量26 mmol/L(24~32 mmol/L)。血钠141 mmol/L(135~146 mmol/L),血钾3.77 mmom/L(3.5~5.5 mmol/L),血氯101 mmol/L(98~109 mmol/L),血清总钙1.16 mmol/L(2.10~2.90 mmol/L),离子钙0.50 mmol/L(1.15~1.35 mmol/L),血磷2.89~3.26 mmol/L(0.80~1.50 mmol/L),血镁0.73 mmol/L(0.8~1.2 mmol/L);尿钠152 mmol/24 h(130~260 mmol/24 h),尿钾54 mmol(25~100 mmol/24 h),尿氯150 mmol(170~250 mmol/24 h),尿钙0.5 mmol(2.5~7.5 mmol/24 h)、尿磷8.14 mmol(22~48 mmol/24 h)、24 h尿量2 670 mL;肌酸激酶(creatine kinase,CK)1 132 U/L(24~195 U/L),肌酸激酶同工酶(creatine kinase-MB,CK-MB) 8.62 μg/L(0~5 μg/L),乳酸脱氢酶(lactate dehydrogenase,LDH)373 U/L(114~240 U/L),天门冬氨酸氨基转移酶(aspartate transaminase,AST) 34 U/L(0~40 U/L),碱性磷酸酶(alkaline phosphatase,ALP) 36 U/L(42~140 U/L);甲状旁腺素(parathyroid hormone,PTH)14.60 ng/L(16.9~78.6 ng/L),游离三碘甲状腺原氨酸(free triiodothyronine,FT3)2.77 pmol/L(3.39~6.78 pmol/L),游离甲状腺素(free thyroxine,FT4)6.43 pmol/L(10.30~22.91 pmol/L),促甲状腺激素(thyroid stimulating hormone,TSH)10.30 mIU/L(0.3~3.6 mIU/L),甲状腺过氧化物酶抗体38.59 IU/mL(1.0~16 IU/mL),甲状腺球蛋白抗体39.18 IU/mL(5~100 IU/mL),甲状腺微粒体抗体(thyroid microsome antibody,TM-Ab)58.30/5001.20 IU/mL(1~16 IU/mL);25羟维生素D(25 hydroxy-vitamin D,25OHD)43.5 nmol/L(62.5~175 nmol/L),血醛固酮14.23 μg/L(1.97~26.00 μg/L),血皮质醇6.8 mg/L(4.5~24.0 mg/L),血生长激素0.13~0.24 μg/L(0.01 μg/L),性腺激素正常。口服糖耐量试验、抗核抗体、抗ds-DNA抗体、抗ENA抗体、抗Jo-1抗体、阴道分泌物查真菌均阴性。
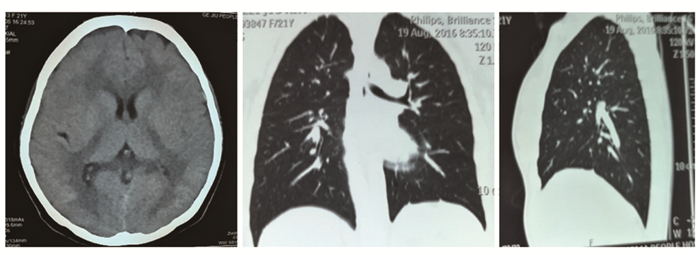
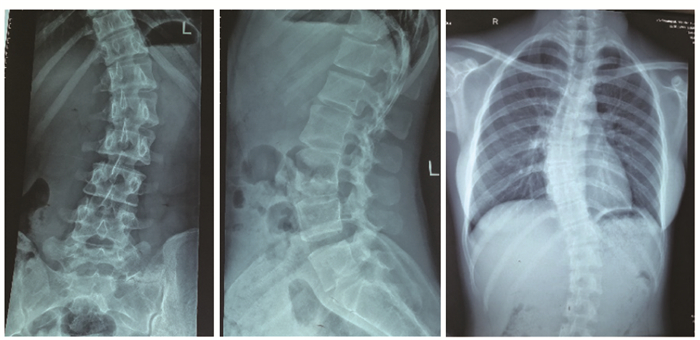
影像学检查心电图未见异常,肝、胆、胰、脾、双肾、输尿管、膀胱、子宫和双侧卵巢超声检查未见异常,未见肾结石。B超示甲状腺轮廓影像增大,右侧:1.9 cm×1.5 cm×6.2 cm,左侧:1.9 cm×1.6 cm×5.7 cm,甲状腺实质回声不均匀减低,其内见较多条索状稍强回声,呈网格状改变,甲状腺实质内血供稍丰富,桥本甲状腺炎可能,双侧颈淋巴结无肿大。头颅及胸部CT平扫:松果体及双侧脉络从点状钙化、右肺下叶基底段钙化(点状)(图 2);垂体MRI平扫+增强:垂体后缘小条状低信号。胸腰椎X片:脊柱胸腰段呈S型弯曲(图 3);腰椎及右股骨骨密度测定正常。裂隙灯检查:屈光不正,未见白内障。
|
| 图 2 头颅及胸部CT Figure 2 Cranial and chest CT scan 松果体及双侧脉络从点状钙化;右肺下叶基底段钙化 |
|
| 图 3 胸腰椎X片 Figure 3 Thoracolumbar spine X-ray 脊柱胸腰段呈S型弯曲 |
给予VD钙咀嚼片600、600、600 mg/次分别于早、中、晚口服(元素钙1 800 mg/d,维生素D 600 IU/d)、骨化三醇0.25 μg,每12小时1次及左甲状腺素片25 μg,1次/d,并停用抗癫痫药物,患者情绪明显改善,自觉记忆力好转,未再出现肢体抽搐。2016年9月27日复查血清总钙1.82 mmol/L,血磷2.58 mmol/L,血镁0.74 mmol/L,给予VD钙咀嚼片600、600、600 mg分别于早、中、晚口服(元素钙1 800 mg/d,维生素D 600 IU/d)、骨化三醇0.25 μg,每8小时及左甲状腺素片37.5 μg,1次/d治疗;2017年1月7日复查血清总钙2.10 mmol/L,血磷2.07 mmol/L,血镁0.77 mmol/L,尿钙4.6 mmol/24 h,尿磷11.10 mmol/24 h,尿量2 075 mL/24 h,给予VD钙咀嚼片600、300、600 mg分别于早、中、晚口服(元素钙1 500 mg/d,维生素D 500 IU/d)、善存银片1片(元素钙100 mg,维生素D 400 IU,镁100 mg),1次/d,骨化三醇0.25 μg,每12 h/次及左甲状腺素片50 μg/d治疗;2017年8月复查血清总钙2.25 mmol/L,血磷1.09 mmol/L,24 h尿钙7.9 mmol,尿磷11.66 mmol,尿量2 850 mL,FT3 3.48 pmol/L,FT4 10.68 pmol/L,TSH 3.65 mIU/L,AST 14 U/L,CK 89 U/L,CKMB 1.01 μg/L,LDH 144 U/L。头颅CT及垂体MRI较前无变化,泌尿系超声未见明显异常,给予VD钙咀嚼片600、300、600 mg分别于早、中、晚口服(元素钙1 500 mg/d,维生素D 500 IU/d)、善存银片1片(元素钙100 mg,维生素D 400 IU,镁100 mg),1次/d,骨化三醇0.25 μg每12小时/次及左甲状腺素片50 μg,1次/d,治疗,予以随诊。
讨论甲状旁腺功能减退症(hypoparathyroidism,HPT)是由于多种原因导致PTH分泌不足或PTH靶器官抵抗的一组临床综合征[1],其病因包括PTH分泌不足、受体缺陷和受体后缺陷[2]。IHP是指病因尚不清楚或未找到明确病因的甲状旁腺功能减退症[3]。HPT起病隐匿,临床表现多样,患者常因为某一系统或器官的症状突出而就诊。
由于钙离子依赖型酪氨酸羟化酶为合成去甲肾上腺素的限速酶,低钙血症可能由此影响中枢神经系统儿茶酚胺能神经元活动,故HPT患者可能出现多种精神症状,主要表现为焦虑、躁动、谵妄、幻觉等易烦躁、易激惹为主的情感障碍、神经衰弱、癔症和孤独症等。手足搐搦和癫痫样发作为IHP最常见的特征性临床表现,以手足搐搦为首发症状者占88.8%,癫痫样发作常见,占84.6%[4]。一般血清总钙≤1.88 mmol/L,血离子钙≤0.95 mmol/L时可出现症状。早期可有口周或肢端麻木、皮肤刺痛、蚁走感、肌肉发紧,后期手足抽搐,呈鹰爪状或助产士手状,严重者全身骨骼肌及平滑肌痉挛,可发生喉痉挛,支气管痉挛,哮喘、喉鸣。胆、肠、膀胱痉挛可引起腹痛、腹泻、尿急。持续发作者可因呼吸窒息或心脑缺血缺氧死亡。动脉痉挛时有偏头痛、心绞痛或肢端雷诺现象,称内脏型或血管型搐搦[5-6]。HPT患者血磷增高促使钙离子自骨到软组织内沉积,可出现在皮下、血管壁、四肢、关节周围及颅内,可出现钙化组织的相应损害,如引起肾结石、肾功能衰竭、皮肤顽固性瘙痒等,其中颅内钙化较特异,IHP颅内钙化发生率高达93%[7],其钙化发生的频度依次为苍白球、尾状核、壳核、视丘、额叶、齿状核、小脑皮质及脑干中部[5, 8],内囊区不易钙化而出现典型的“内囊空白征”。此外,HPT患者还可出现低钙性白内障、牙齿生长发育异常、多发龋齿或牙齿残缺、皮肤干燥脱屑、色素沉积,指/趾甲出现纵嵴,变脆、粗糙和裂纹,毛发粗干且易脱落等外胚层营养不良表现。可引起肌酶升高、心肌痉挛猝死、心动过速或心律不齐、Q-T间期延长,左室复极迟缓,非特异性T波改变、HPT性心肌病表现。因PTH不足,骨转换受抑制和骨矿化增加,可致骨密度增加,患者身高增长停滞。关节周围组织可有异位钙化、骨化,赘生骨可引起腰背、髋部骨骼疼痛和关节僵直疼痛[7]。长骨骨皮质增厚及颅骨内外板增宽,腰椎骨质增生,韧带钙化、椎旁骨化,骨盆出现髋臼钙化,髋关节致密性骨炎等。此外,低钙血症使维生素B12与内因子结合欠佳,可发生巨幼红细胞性贫血[9-10],还伴有胃酸缺乏、恶心、呕吐、肠吸收不良、腹痛、腹泻或便秘等胃肠道功能紊乱症状[5-6]。
该患者为青年女性,慢性病程,首发临床表现为情绪悲观,随后反复四肢强直性痉挛、癫痫样发作,发作时意识清楚,持续数秒至数分钟[6],为HPT典型神经肌肉症状。查体:脊柱向右侧弯,双侧大趾甲粗糙,四肢腱反射亢进,面神经叩击征及束臂加压试验阳性;实验室检查示低血钙、高血磷,轻度低镁血症、低PTH血症,24 h尿钙低,血碱性磷酸酶正常,脊柱胸腰段呈S型弯曲;用大剂量维生素D和钙剂治疗有效,HPT诊断明确。从出现临床症状到确诊历时2年,长期服用抗抑郁药物和抗癫痫药物治疗效果差,而大部分抗癫痫药如丙戊酸钠、卡马西平等均为肝酶诱导剂,可加速肝脏对PTH的代谢而进一步降低PTH水平,另一方面,抗癫痫药物也可能干扰肝脏羟化酶影响活性维生素D的生成而进一步加重IHP癫痫样发作。如患者年龄小,且诊治不及时,可出现多器官系统损害,影响骨骼生长及智力发育,甚至猝死,严重影响生活质量及生存时间。故临床遇精神症状及以上神经肌肉症状,尤其是并发有多器官系统病变,如异位钙化、外胚层营养不良、心血管系统表现、骨与关节病变、消化道症状等应警惕HPT;对所有诊断癫痫的患者或经抗癫痫药物治疗效果不佳的患者,尤其是儿童、青少年患者均需关注其血钙、磷、PTH状态以确诊或排外HPT,勿轻易诊断器质性精神病或原发性癫痫。
除头颅及胸部CT平扫提示松果体及双侧脉络从点状钙化、右肺下叶基底段钙化表现外,未发现患者有低钙性白内障、牙齿、毛发异常,无贫血、特异性心血管表现及骨密度增加表现,无胃肠道功能紊乱等症状、体征。考虑可能原因:(1) HPT患者临床表现存在个体差异;(2)HPT异位钙化的程度、范围与病程有关,患者病程较短,可无颅内钙化灶或钙化程度轻、范围小;(3)HPT患者颅内钙化的有无与癫痫发作无明显相关性[11]。这也提示对于病程长、典型颅内基底节区钙化及颅内多处、大范围钙化患者,临床上容易诊断HPT。但对于病程较短、未出现典型颅内钙化征象或出现松果体、双侧脉络丛钙化等非特异性钙化患者,影像科医生及临床医生容易忽视。故临床遇颅内钙化,包括松果体、双侧脉络丛钙化,均应结合患者年龄、病史、血钙、磷、PTH综合分析,勿轻易诊断生理性或特发性钙化。
HPT致肌酶升高多为IHP,多数治疗不规律,处于慢性持久的低钙血症状态,伴或不伴有手足搐搦和癫痫样发作,易被误诊为多发性肌炎[11]。肌酶增高初期可无症状,长期严重低钙血症可致肌病,但一般为轻中度肌损害,经补充钙剂和维生素D后可恢复[12]。肌电图和肌活检均为非特异性、非炎性表现,肌活检见轻中度肌细胞空泡状变性、肌纤维玻璃样变性、肌纤维膜细胞增生及肌萎缩[13]。本例患者就诊时血钙低、血磷高,无自觉肌肉乏力、酸痛,CK、CKMB、LDH升高,低血钙纠正后复查以上肌酶恢复正常,与文献报道类似,应诊断HPT性肌病,必要时行肌电图及肌肉活检明确。临床对于肌酶升高伴或不伴有特异性肌病患者,应询问有无肢体抽搐病史,并筛查血钙、磷、PTH等了解有无HPT。本例患者还合并甲状腺自身抗体阳性及原发性甲状腺功能减退症,结合超声检查应诊断桥本甲状腺炎(Hashimoto's thyroiditis,HT),不排除以上疾病与HPT共同作用引起肌酶升高。
PTH减少使肠道镁的吸收减少,高磷血症会使血镁降低,而低镁血症又进一步阻止PTH的生物合成[14],造成恶性循环,致低钙血症难以纠正,因此HPT患者应注意监测及纠正低镁血症[15]。本例患者出现轻度低镁血症,本例患者在给予口服钙剂及维生素D治疗的同时积极补镁,取得了较好疗效。
该患者青年起病,无肾功能不全、慢性腹泻、脂肪性腹泻或碱中毒,无甲状腺、甲状旁腺或颈部手术史,无颈部放射线照射等情况,否认家族中类似病史,IHP诊断明确。结合双侧大趾甲粗糙、甲状腺自身抗体阳性及原发性甲状腺功能减退症,符合两个或两个以上的内分泌腺体因为自身免疫功能缺陷而同时发生功能减退及30岁前已有两个内分泌腺功能减低,应考虑为APS Ⅰ型,可进一步行自身免疫调节基因(autoimmune regulator gene,AIRE)检测以明确诊断。患者未出现文献报道典型“三联征”中的念珠菌感染,考虑可能与APSⅠ型患者临床表现存在民族和地区之间的差异有关。因其组成成分较多,可在数十年间序贯发生,今后还需长期监测随诊有无APS Ⅰ型的其他表现,如自身免疫性肾上腺皮质功能减退症、念珠菌病、1型糖尿病、原发性性腺功能减退等自身免疫性内分泌腺病及慢性萎缩性胃炎、恶性贫血、慢性活动性肝炎、自身免疫性肝炎、急慢性间质性肾炎、脂肪泻等自身免疫性非内分泌腺病及多种自身抗体,并关注各内分泌腺体之间的相互影响,综合判断、系统治疗。
IHP及APS Ⅰ型均为临床少见病,临床易误诊、漏诊。建议对于以精神症状、癫痫样发作起病、经抗精神病药及癫痫药物治疗效果不佳的患者、尤其是并发多器官系统病变,多个内分泌腺体病变、自身抗体阳性的儿童、青少年患者,临床医生应考虑有无IHP及APS可能,及时详细询问病史进行有关检查,使患者得到及时、准确的治疗,尽早消除低血钙所造成的神经精神症状,防治各种并发症,提高患者生存质量及生存率。
| [1] | Bollerslev J, Rejnmark L, Marcocci C, et al. European Society of Endocrinology Clinical Guideline:treatment of chronic hypoparathyroidism in adults[J]. Eur J Endocrinol, 2015, 173. |
| [2] | 张凤丽, 王鸥, 邢小平. 特发性甲状旁腺功能减退症临床分析[J]. 中国医药, 2012, 7: 841–842. |
| [3] | 葛均波, 徐永健. 内科学[M]. 8版. 北京: 人民卫生出版社, 2014: 724-726. |
| [4] | 郑培华. 表现为神经系统症状的甲状旁腺疾病误诊分析并文献复习[J]. 临床误诊误治, 2016, 10: 44–48. |
| [5] | 史轶蘩. 协和内分泌和代谢学[M]. 北京: 科学出版社, 1999: 1478-1629. |
| [6] | 陈家伦. 临床内分泌学[M]. 上海: 上海科学技术出版社, 2011: 1371-1566. |
| [7] | 刘正, 王海芹, 李方元. 特发性甲状旁腺功能减退症22例颅脑病变的CT诊断[J]. 中国临床新医学, 2013, 12: 1206–1208. DOI:10.3969/j.issn.1674-3806.2013.12.27 |
| [8] | 母义明, 陆菊明, 潘长玉. 临床内分泌代谢学[M]. 北京: 人民军医出版社, 2014: 334-649. |
| [9] | 施秉银, 陈璐璐. 内分泌与代谢系统疾病[M]. 北京: 人民卫生出版社, 2015: 130-132. |
| [10] | 廖二元, 莫朝辉. 内分泌学[M]. 2版. 北京: 人民卫生出版社, 2007: 719-1281. |
| [11] | 佟强, 李红, 方小正, 等. 特发性甲状旁腺功能减退症患者血清钙对血清肌酶的影响[J]. 中华内科杂志, 2014, 53: 891–893. DOI:10.3760/cma.j.issn.0578-1426.2014.11.012 |
| [12] | 王文博, 胡莹莹, 姜艳, 等. 双手搐搦-低钙血症-肌酶升高[J]. 中华骨质疏松和骨矿盐疾病杂志, 2015, 3: 246–250. DOI:10.3969/j.issn.1674-2591.2015.03.011 |
| [13] | Dai CL, Sun ZJ, Zhang X, et al. Elevated muscle enzymes and muscle biopsy in idiopathic hypoparathyroidism patients[J]. J Endocrinol Invest, 2012, 35: 286–289. |
| [14] | 全婷婷, 王鸥, 聂敏, 等. 甲状旁腺功能减退症发病机制的遗传学进展[J]. 中华骨质疏松和骨矿盐疾病杂志, 2017, 10: 186–193. DOI:10.3969/j.issn.1674-2591.2017.02.016 |
| [15] | Garrahy A, Murphy MS, Sheahan P. Impact of postoperative magnesium levels on early hypocalcemia and permanent hypoparathyroidism after thyroidectomy[J]. Head Neck, 2016, 38: 613–619. DOI:10.1002/hed.v38.4 |
| (收稿日期:2017-09-12) |

