扩展功能
文章信息
- 高东升, 杨晓燕, 马临庆, 龙莉莉, 肖波
- GAO Dong-Sheng, YANG Xiao-Yan, MA Lin-Qing, LONG Li-Li, XIAO Bo
- 电针百会和大椎穴对癫痫大鼠海马CA3和DG区ephrinA5表达的影响
- Effect of electroacupuncture at Baihui and Dazhui points on the expression of ephrinA5 in the CA3 and DG regions of the hippocampus in epileptic rats
- 国际神经病学神经外科学杂志, 2021, 48(1): 50-54
- Journal of International Neurology and Neurosurgery, 2021, 48(1): 50-54
-
文章历史
收稿日期: 2020-10-16
修回日期: 2021-01-11
2. 苏州高新区人民医院神经内科, 江苏 苏州 215000;
3. 中南大学湘雅医院神经内科, 湖南 长沙 410008
2. Department of Neurology, People's Hospital of Suzhou High-Tech Zone, Suzhou, Jiangsu 215000, China;
3. Department of Neurology, Xiangya Hospital, Central South University, Changsha, Hunan 410008, China
颞叶癫痫(temporal lobe epilepsy, TLE)患者常有意识障碍、广泛的神经认知功能障碍和生活质量下降,是临床环境中最常见的部分复杂癫痫发作类型[1-3]。20%~30%的颞叶癫痫患者使用抗癫痫药物效果不佳[4];同时,颞叶癫痫也是最常见的难治性局灶性癫痫,在癫痫患者中发生率为40%[5],其发病机制一直是癫痫研究的热点。颞叶癫痫存在神经发生和血管生成,其病理表现主要为海马齿状回(DG)、CA1及CA3区的神经元丢失、代偿的胶质增生、新生颗粒细胞的形成及突触的重建和异常神经环路的形成[6]。癫痫后海马DG新生神经元可出现树突的延长并伸入至CA3区内分子层与锥体细胞树突形成新的突触联系,从而形成新的异常的神经环路,成为自发性痫性发作的爆发点[6]。
研究表明,在脊椎动物中枢神经系统的正常发育中,Eph受体及其配体ephrins发挥着轴突导向的重要作用,并在海马内有着广泛的表达[6],它们是受体酪氨酸激酶的最大成员,通过细胞间接触的相互作用参与细胞增殖、分化、迁移和组织重塑[7-9]。EphA5及其配体ephrinA5相互作用引起N-甲基-D-天冬氨酸受体(N-methyl-D-aspartate receptor,NMDAR)和突触后密度蛋白95(PSD-95)的协同表达,可能诱导α-氨基-3-羟基-5-甲基-4-异恶唑丙酸受体(α-amino-3-hydroxy-5-methyl-4-isoxazolepropionic acid receptor, AMPAR)及其相互作用蛋白表达以及向突触调节过渡的发育转换,可以在海马早期发育过程中触发突触形成[10-11]。TLE小鼠模型在持续癫痫发作后的第3天,将ephrinA5-Fc注入海马,连续处理7 d后,小鼠的自发性、复发性癫痫发作频率和强度均减弱,双皮质素阳性的神经元祖细胞在颗粒下区域减少,而微血管的密度在门静脉减少,这些均表明体外注射ephrinA5-Fc融合蛋白可有效抑制癫痫的发作[12]。Liu等[13]应用氯化锂-匹罗卡品颞叶癫痫大鼠模型发现配体ephrinA5协同受体EphA5在海马CA3区的表达下调,认为ephrinA5与EphA5可能共同参与了CA3区的苔藓纤维出芽作用机制,并与癫痫的发生、发展关系密切。
治疗癫痫的方法目前主要包括药理学和非药理学方法,其中药理学中许多抗癫痫药物的作用源于γ-氨基丁酸(gamma-aminobutyric acid, GABA)介导的抑制作用增强,γ-氨基丁酸是成人中枢神经系统的主要抑制性神经递质,γ-氨基丁酸受体功能的改变与颞叶癫痫有关[14]。然而,研究发现将近20%~40%的癫痫患者可能患有耐药性癫痫(drug resistant epilepsy, DRE)。在这些患者中,抗癫痫药物不能有效地控制癫痫发作[15]。近些年来,非药理学方法在治疗癫痫中越来越受到关注。非药理学方法主要有饮食疗法和神经调节疗法[15]。其中,神经调节技术包括迷走神经刺激、脑深部刺激和经颅磁刺激[15]。研究表明,耳针电针可以有效降低晚期创伤性癫痫的发生[16];低频率的电针刺激风池穴对改善癫痫和癫痫引起的睡眠障碍有好处[17];针刺足三里(St36)、大椎(Du14)、百会(Du20)等特定穴位,能够有效治疗癫痫[18-19]。尽管非药理学在癫痫的临床治疗方面有明确的疗效,但其内在机制却缺乏深入的研究,鉴于非药理学及癫痫发作和治疗机制的研究结果,电针的抗癫痫作用和抗癫痫机制是否与已知的ephrinA5调控机制有关,目前尚未有报道。
本研究将大鼠致癫痫后的海马CA3及DG区作为主要的研究区域,应用与人颞叶癫痫临床及病理特征相似的氯化锂-匹罗卡品颞叶大鼠作为模型,通过行电针百会和大椎穴治疗处理,测定ephrinA5 mRNA及蛋白在海马CA3及DG区表达的变化特点,分析电针百会和大椎穴对ephrinA5在颞叶癫痫中表达的影响,进而探讨针灸对癫痫治疗的内在机制。
1 材料与方法 1.1 实验动物30只SD雄性大鼠均来自北京维通利华动物实验中心,体质量220~250 g,温度(22±3)℃、12 h明暗循环的饲养环境中,给予自由饮食和饮水。适应性喂养1周后随机选取10只作为对照组,20只用于癫痫造模。取10只造模成功后的大鼠用于电针治疗。所有实验内容经苏州高新区人民医院动物伦理委员会同意。
1.2 仪器和试剂戊巴比妥钠(1507002-200MG);脑立体定位仪(51600,美国stoelting);G6805-2电针治疗仪(中国青岛鑫升实业有限公司);LiCl(美国Boehringer Mannheim公司);PILO(美国Sigma公司);ephrinA5抗体(ab70114, Abcam)。
1.3 大鼠癫痫模型的制备大鼠腹腔注射3 mEq/kg(约125 mg/kg)的LiCl;18 h后腹腔注射PILO,每次10 mg/kg,每30 min 1次,直至大鼠出现癫痫持续状态(SE)30 min,则可用10%水合氯醛终止发作。发作程度按Racine制定的标准进行分级。
1.4 电针治疗大鼠吸入乙醚进行麻醉,然后将大鼠头部固定于脑立体定位仪上。选用1寸毫针平刺百会穴和斜刺大椎穴,约7 mm。用G6805-2电针治疗仪进行电针。电针采用疏密波,密波:6.25 Hz,强度:1.0 mA,时间:2.08 s;疏波:3.85 Hz,强度:1.0 mA,时间:1.28 s;持续30 min。
1.5 实时荧光定量PCR(qRT-PCR)检测检测ephrinA5 mRNA水平表达检测大鼠脑组织ephrinA5 mRNA表达。将脑组织于冰上匀浆,提取脑膜组织中总RNA,利用逆转录试剂盒将RNA逆转录为cDNA,应用Primer 5.0软件设计ephrinA5和GAPDH mRNA的特异性引物,GAPDH作为内参照。引物序列分别为:大鼠GAPDH正向5'-ACTCCCATTCT-TCCACCTTTG-3';反向5'-CCCTGTTGCTGTAGCCATATT-3';ephrinA5正向5'-AGTCGTCGCCGACCGCTACGCCGT-3';反向5'-TCTGGGACAGAGTCCTCATAGTGA-3';每个样本做3个复孔检测,PCR反应体系总体积为20 μL,反应条件:42℃孵育2 min;95℃预变性30 s;95℃ 5 s,60℃ 34 s,40个循环;用ABI7500系统软件进行数据采集、分析。利用qRT-PCR测定对照基因和目的基因的Ct值,将Ct值转化为相对倍数。从而计算目的基因的表达量:采用实验组/对照组=2-ΔΔCt进行计算;其中Ct=(Ct目的-Ct参照)实验-(Ct目的-Ct参照)对照。
1.6 Western blotting检测ephrinA5蛋白表达取大鼠脑组织,液氮磨成粉末,加入100 μL PBS,50 μL收集的蛋白中,加入150 μL 4×loading buffer,混匀后,100度水浴5 min,冰上冷却。
配置好分离胶和浓缩胶,每孔上样40 μL,电泳90 min。转移结束后关掉电源,取出PVDF膜放入容器(培养皿)中,加适量的封闭缓冲液(含5%(w/v)脱脂奶粉的PBS缓冲液),室温轻轻摇动温育1~2 h。换新的培养皿,加入10 ml上述封闭缓冲液,并按1:1000的量加入兔抗大鼠ephrinA5多克隆抗体(一抗),4℃孵育过夜。PBS缓冲液洗涤3次,每次10 min。将PVDF膜转移至另一培养皿中,加入含有5%脱脂奶粉的二抗缓冲液,并以1∶5000量加入HRP标记羊抗兔IgG(二抗),室温摇动温育1 h。再将PVDF膜转移至另一培养皿中,加适量二抗缓冲液(150 mmol/L NaCl,50 mmol/L Tris-Cl pH 7.5),室温洗涤3次,每次10 min。ECL加底物显色液,拍照。
1.7 免疫组织化学检测ephrinA5蛋白表达3组大鼠进行灌注取材,腹腔注射10%水合氯醛麻醉大鼠,迅速取出脑组织,4℃ 4%多聚甲醛固定12 h。取出脑组织后常规梯度酒精脱水,二甲苯透明,在石蜡中浸泡并进行包埋。以切片厚度4 μm进行连续冠状切片。石蜡切片常规二甲苯脱蜡,梯度酒精至水;加入含1%Triton和3% H2O2的PBS溶液,于4℃冰箱中孵育30 min,以去除内源性过氧化物酶,PBS漂洗3次,每次5 min;滴加含有10%BSA的封闭液封闭约2 h;加入1∶100稀释的兔抗大鼠ephrinA5多克隆抗体(一抗),于4℃冰箱中孵育过夜,PBS漂洗3次,每次5 min;然后滴加生物素标记羊抗兔IgG(二抗)工作液,室温下孵育约1 h,PBS漂洗3次,每次5 min;DAB显色液显色,显微镜下观察显色情况并予PBS终止显色反应。
1.8 统计学方法采用SPSS 21.0统计软件包对数据进行统计学分析。计量资料用均数±标准差(x±s)表示,多组间比较采用单因素方差分析(One-way ANOVA),两两比较采用LSD-t检验。P < 0.05为差异有统计学意义。
2 结果 2.1 癫痫大鼠电针治疗后海马组织ephrinA5 mRNA表达变化qRT-PCR结果显示:与对照组比较,ephrinA5 mRNA在癫痫组大鼠海马组织中的表达下调,差异有统计学意义(P < 0.05);连续8周电针百会和大椎穴治疗后,大鼠海马组织中ephrinA5 mRNA表达水平与癫痫组相比有上调,差异有统计学意义(P < 0.05)。见表 1。
| 组别 | 例数 | ephrinA5 mRNA相对表达量 |
| 对照组 | 6 | 1.0204±0.2264 |
| 癫痫组 | 6 | 0.5262±0.1189① |
| 癫痫+电针组 | 6 | 0.8322±0.0801② |
| 注:①与对照组比较,P < 0.05;②与癫痫组比较,P < 0.05 | ||
Western blotting结果显示,与对照组比较,癫痫组大鼠海马组织中ephrinA5蛋白表达有下调;连续8周电针百会和大椎穴治疗后,与癫痫组相比,大鼠海马组织中ephrinA5蛋白表达水平上调(图 2)。这个结果和qRT-PCR结果相一致。
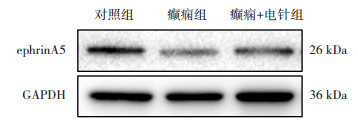
|
| 图 2 Western blotting检测3组大鼠海马组织ephrinA5蛋白表达变化 |
免疫组化实验结果显示,ephrinA5在对照组大鼠海马CA3和DG区锥体细胞层均有广泛表达(图 3A和图 3D)。与对照组比较,ephrinA5蛋白在癫痫组大鼠海马CA3区的表达也减少(图 3E);与癫痫组相比,癫痫+电针组大鼠海马CA3区ephrin A5的表达增加(图 3F)。在DG区,癫痫组和电针+癫痫组中ephrinA5蛋白水平与对照组相比变化不明显(图 3A、图 3B和图 3C)。因此,ephrinA5蛋白在癫痫组和癫痫+电针组中大鼠海马组织CA3区的表达结果与ephrinA5 mRNA的表达变化相一致。
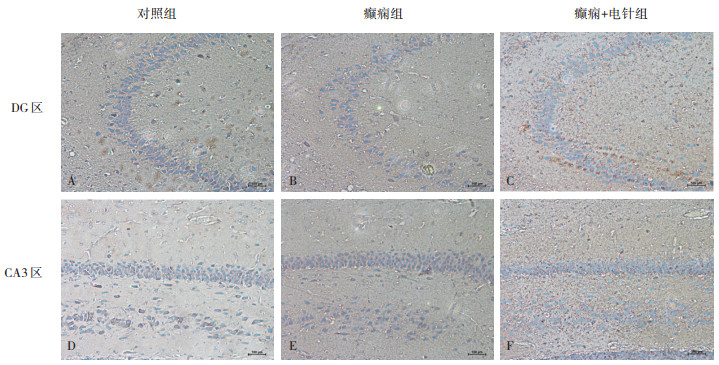
|
| A: 对照组DG区; B: 癫痫组DG区; C: 癫痫+电针组; D: 对照组CA3区; E: 癫痫组CA3区; F: 癫痫+电针组CA3区 图 3 ephrinA5在海马DG区的表达变化(免疫组化,×200) |
颞叶癫痫是一种临床上常见的复杂癫痫类型,其发病机制是癫痫研究中的重点。通过氯化锂-匹罗卡品颞叶癫痫大鼠模型与人类颞叶癫痫相似[20],是研究颞叶癫痫发生机制的重要途径。研究表明,颞叶癫痫病理主要表现为海马DG、CA1及CA3区的神经元丢失、代偿的胶质增生、新生颗粒细胞的形成及突触的重建和异常神经环路的形成[6]。癫痫发生时,海马DG新生神经元出现树突的延长,并伸入至CA3区内分子层与锥体细胞树突形成新的突触联系,从而形成自发性[6]。海马CA3和DG区是颞叶癫痫的重要参与者[21]。最近的研究表明,脑中ephrinA5及其受体EphA5有很高的表达[22],而氯化锂-匹罗卡品致痫后,ephrinA5 mRNA在CA3区的表达明显下调[13]。本研究中RT-PCR和Western blotting结果也证实了ephrinA5 mRNA和蛋白表达水平在癫痫组大鼠海马组织中均下调。鉴于Eph受体及其配体ephrins在调节神经元突触结构及其生理特性中的关键作用[23-26],而且ephrinA5在海马发育的突触连接和重建上发挥着重要作用[27],可以说明ephrinA5在海马区表达量下调和功能缺失对颞叶癫痫发作至关重要。
作为一种代表性的非药理学治疗方法,电针目前已经应用于癫痫患者临床治疗。Dos等[28]研究表明,电针足三里穴可防止一些边缘结构的萎缩,并且能够改善毛果芸香碱引起的癫痫模型大鼠的认知缺陷。电针治疗后,一氧化氮合酶的减少[29]和褪黑素的增加[30],有助于抗癫痫作用。研究还发现电针能提高癫痫大鼠中枢神经系统γ-氨基丁酸水平,说明电针抗癫痫作用可能部分归因于其调节中枢神经系统γ-氨基丁酸水平的作用[31]。然而,电针治疗癫痫是否还存在其他可能的原因尚待进一步的研究,其中深入分析电针与癫痫发生密切相关的ephrinA5基因表达尤为重要。本研究结果表明,在氯化锂-匹罗卡品诱导的癫痫大鼠中,电针百会和大椎穴可以有效提高ephrinA5的mRNA和蛋白表达水平,从而起到一定的抗癫痫作用。在TLE小鼠模型中,体外注射ephrinA5-Fc至海马区,小鼠的自发性复发癫痫发作频率和强度在接下来的2周中明显减弱[10]。结合本研究结果,说明电针治疗癫痫的机制可能与其促使大鼠海马中ephrinA5表达的升高直接相关。免疫组化结果显示,持续的电针治疗可以提高ephrinA5在海马CA3区中的表达;而DG区无论是癫痫组还是癫痫+电针组,变化均不明显。
这些结果说明虽然海马CA3和DG区都是是颞叶癫痫的重要参与者,但颞叶癫痫发生与海马CA3区中ephrinA5表达失控关系更为密切,海马CA3区中ephrinA5的表达对电针刺激也更为敏感。这为电针治疗癫痫提供了数据支持,同时,也为电针的抗癫痫作用和抗癫痫机制研究提供了一定的理论证据。
| [1] |
Englot DJ, Morgan VL, Chang C. Impaired vigilance networks in temporal lobe epilepsy: mechanisms and clinical implications[J]. Epilepsia, 2020, 61(2): 189-202. DOI:10.1111/epi.16423 |
| [2] |
Allone C, Lo Buono V, Corallo F, et al. Neuroimaging and cognitive functions in temporal lobe epilepsy: a review of the literature[J]. J Neurol Sci, 2017, 381: 7-15. |
| [3] |
王新军, 杨胜, 武跃辉, 等. 影响难治性颞叶癫痫外科疗效的临床特征及相关因素分析[J]. 国际神经病学神经外科学杂志, 2018, 45(1): 25-29. |
| [4] |
Perry MS, Duchowny M. Surgical versus medical treatment for refractory epilepsy: outcomes beyond seizure control[J]. Epilepsia, 2013, 54(12): 2060-2070. DOI:10.1111/epi.12427 |
| [5] |
Engel J Jr, International League Against Epilepsy (ILAE). A proposed diagnostic scheme for people with epileptic seizures and with epilepsy: report of the ILAE Task Force on Classification and Terminology[J]. Epilepsia, 2001, 42(6): 796-803. DOI:10.1046/j.1528-1157.2001.10401.x |
| [6] |
Zhang YF, Xiong TQ, Tan BH, et al. Pilocarpine-induced epilepsy is associated with actin cytoskeleton reorganization in the mossy fiber-CA3 synapses[J]. Epilepsy Res, 2014, 108(3): 379-389. DOI:10.1016/j.eplepsyres.2014.01.016 |
| [7] |
Barquilla A, Pasquale EB. Eph receptors and ephrins: therapeutic opportunities[J]. Annu Rev Pharmacol Toxicol, 2015, 55: 465-487. DOI:10.1146/annurev-pharmtox-011112-140226 |
| [8] |
Xavier GM, Miletich I, Cobourne MT. Ephrin ligands and Eph receptors show regionally restricted expression in the developing palate and tongue[J]. Front Physiol, 2016, 7: 60. |
| [9] |
Arvanitis DN, Davy A. Regulation and misregulation of Eph/ephrin expression[J]. Cell Adh Migr, 2012, 6(2): 131-137. DOI:10.4161/cam.19690 |
| [10] |
Suo GH, Shen FF, Sun BL, et al. Abnormal expression of ephrinA5 affects brain development of congenital hypothyroidism rats[J]. Neuroreport, 2018, 29(11): 877-882. DOI:10.1097/WNR.0000000000001047 |
| [11] |
Akaneya Y, Sohya K, Kitamura A, et al. Ephrin-A5 and EphA5 interaction induces synaptogenesis during early hippocampal development[J]. PLoS One, 2010, 5(8): e12486. DOI:10.1371/journal.pone.0012486 |
| [12] |
Shu Y, Xiao B, Wu Q, et al. The Ephrin-A5/EphA4 interaction modulates neurogenesis and angiogenesis by the p-Akt and pERK pathways in a mouse model of TLE[J]. Mol Neurobiol, 2016, 53(1): 561-576. DOI:10.1007/s12035-014-9020-2 |
| [13] |
刘田田, 肖波, 李蜀渝, 等. EphA5/ephrinA5在癫癎大鼠海马CA3区的表达变化及作用[J]. 中国当代儿科杂志, 2017, 19(12): 1272-1277. |
| [14] |
Martinello K, Sciaccaluga M, Morace R, et al. Loss of constitutive functional γ-aminobutyric acid type A-B receptor crosstalk in layer 5 pyramidal neurons of human epileptic temporal cortex[J]. Epilepsia, 2018, 59(2): 449-459. DOI:10.1111/epi.13991 |
| [15] |
Sondhi V, Sharma S. Non-pharmacological and non-surgical treatment of refractory childhood epilepsy[J]. Indian J Pediatr, 2020, 87(12): 1062-1069. DOI:10.1007/s12098-019-03164-3 |
| [16] |
Shen CC, Jiang JF. Auricular electroacupuncture for late posttraumatic epilepsy after severe brain injury: a retrospective study[J]. Evid Based Complement Alternat Med, 2019, 2019: 5798912. |
| [17] |
Yi PL, Lu CY, Jou SB, et al. Low-frequency electroacupuncture suppresses focal epilepsy and improves epilepsy-induced sleep disruptions[J]. J Biomed Sci, 2015, 22(1): 49. DOI:10.1186/s12929-015-0145-z |
| [18] |
Ren YX. Acupuncture treatment of Jacksonian epilepsy——a report of 98 cases[J]. J Tradit Chin Med, 2006, 26(3): 177-178. |
| [19] |
Peng YS. Clinical study on treatment of infantile primary epilepsy with acupoint catgut-implantation therapy[J]. World J Acupunct Moxibustion, 2003, 13(1): 38-41. |
| [20] |
He XH, Wang W, Ruan XZ, et al. Effects of antisense glutamic acid decarboxylase oligodeoxynucleotide on epileptic rats induced by pentylenetetrazol[J]. Chin Med J (Engl), 2002, 115(3): 425-429. |
| [21] |
Houser CR. Morphological changes in the dentate gyrus in human temporal lobe epilepsy[J]. Epilepsy Res Suppl, 1992, 7: 223-234. |
| [22] |
Teng T, Gaillard A, Muzerelle A, et al. EphrinA5 signaling is required for the distinctive targeting of raphe serotonin neurons in the forebrain[J]. eNeuro, 2017, 4(1): ENEURO.0327-16.2017. |
| [23] |
Szepietowska B, Zhu WL, Czyzyk J, et al. EphA5-EphrinA5 interactions within the ventromedial hypothalamus influence counterregulatory hormone release and local glutamine/glutamate balance during hypoglycemia[J]. Diabetes, 2013, 62(4): 1282-1288. DOI:10.2337/db12-0982 |
| [24] |
Murai KK, Pasquale EB. Eph receptors, ephrins, and synaptic function[J]. Neuroscientist, 2004, 10(4): 304-314. DOI:10.1177/1073858403262221 |
| [25] |
Noh H, Park E, Park S. In vivo expression of ephrinA5-Fc in mice results in cephalic neural crest agenesis and craniofacial abnormalities[J]. Mol Cells, 2014, 37(1): 59-65. DOI:10.14348/molcells.2014.2279 |
| [26] |
Murai KK, Van Meyel DJ. Neuron glial communication at synapses: insights from vertebrates and invertebrates[J]. Neuroscientist, 2007, 13(6): 657-666. DOI:10.1177/1073858407304393 |
| [27] |
Szepietowska B, Horvath TL, Sherwin RS. Role of synaptic plasticity and EphA5-ephrinA5 interaction within the ventromedial hypothalamus in response to recurrent hypoglycemia[J]. Diabetes, 2014, 63(3): 1140-1147. DOI:10.2337/db13-1259 |
| [28] |
Dos Santos JG Jr, Tabosa A, do Monte FH, et al. Electroacupuncture prevents cognitive deficits in pilocarpine-epileptic rats[J]. Neurosci Lett, 2005, 384(3): 234-238. DOI:10.1016/j.neulet.2005.04.079 |
| [29] |
Yang R, Huang ZN, Cheng JS. Anticonvulsion effect of acupuncture might be related to the decrease of neuronal and inducible nitric oxide synthases[J]. Acupunct Electrother Res, 2000, 25(3-4): 137-143. |
| [30] |
Chao DM, Chen G, Cheng JS. Melatonin might be one possible medium of electroacupuncture anti-seizures[J]. Acupunct Electrother Res, 2001, 26(1-2): 39-48. |
| [31] |
Shu J, Liu RY, Huang XF. The effects of ear-point stimulation on the contents of somatostatin and amino acid neurotransmitters in brain of rat with experimental seizure[J]. Acupunct Electrother Res, 2004, 29(1-2): 43-51. |
 2021, Vol. 48
2021, Vol. 48




